两株苏云金芽胞杆菌晶体与芽胞形成过程的细胞学对比分析
2020-05-28全梅芳彭金莉何昊城夏立秋丁学知
全梅芳,彭金莉,何昊城, 夏立秋, 丁学知*
(1.湖南师范大学医学院, 长沙 410013; 2.微生物分子生物学湖南省重点实验室, 淡水鱼类发育生物学国家重点实验室, 湖南师范大学生命科学学院, 长沙 410081)
苏云金芽胞杆菌(Bacillusthuringiensis, Bt)是一种自然界广泛分布的革兰阳性细菌,其主要特征是在菌体形成芽胞的同时,伴随有大量杀虫晶体蛋白(insecticidal crystal proteins,ICPs)产生[1]。这种ICPs的高效表达源于它特殊的转录调控模式,且与芽胞形成过程紧密偶联。芽胞形成主要通过顺序激活6个RNA聚合酶 σ 因子,分别为:σA、σH、σF、σE、σG和σK。这些因子在菌体生长的不同阶段分别发挥调控功能,指导芽胞形成相关基因有序而准确的表达[2]。
Bt的芽胞形成过程与枯草芽胞杆菌(Bacillussubtilis)极为相似,大致分为以下7个阶段。第一阶段(Stage Ⅰ),与营养体细胞在形态上没有明显差别;第二阶段(Stage Ⅱ),轴丝和芽胞隔膜开始形成;第三阶段(Stage Ⅲ),前芽胞内卷,游离在母细胞的胞质里,可观察到伴胞晶体;第四阶段(Stage Ⅳ),芽胞外壁逐渐形成;第五阶段(Stage Ⅴ),芽胞内衣沉积形成;第六、七阶段(Stage Ⅵ&Ⅶ),皮层形成,芽胞逐渐成熟,随后,芽胞和伴胞晶体从裂解的母细胞中释放。其中cry基因的表达调控主要是由σE和σK因子控制,ICPs出现最初始于Stage Ⅲ早期,在Stage Ⅳ至Ⅴ阶段完成其形成过程[3,4]。
Bt 4.0718 菌株为本室选育的一株库斯塔克亚种高毒力菌株,能产生椭圆形芽胞和典型的菱形与方形晶体,对棉铃虫、小菜蛾和甜菜夜蛾等农业害虫表现出很强的毒杀活性[5,6]。Bt ΔleuB是以Bt 4.0718为出发菌株,对其3-异丙基苹果酸脱氢酶(3-isopropylmalate dehydrogenase)基因leuB实现无痕敲除得到的一株工程菌。Bt ΔleuB在液体LB培养基中生长时无芽胞出现,只产生晶体,这种特殊表型打破了现有认识,即认为Bt的晶体必须伴随芽胞而出现。
FM4-64染料是亲脂性苯乙烯基化合物,能与质膜及细胞器膜结构特异结合后发出红色荧光,可被应用于芽胞杆菌中芽胞形成及母细胞凋亡过程的研究[7-9]。本研究以Bt 4.0718 和Bt ΔleuB菌株为研究对象,采用FM4-64染料对不同生长阶段的菌体进行染色,在激光共聚焦扫描显微镜(confocal laser scanning microscope,CLSM)下对比观察两株菌芽胞发育与晶体形成的过程,以期从细胞水平上为理解这一类特殊表型发生的机制提供线索。
1 材料与方法
1.1 菌株与培养基
Bt 4.0718菌株(BacillusthuringiensisCCTCC No.M200016)为本室选育,属于库斯塔克亚种。Bt ΔleuB(CCTCC No.M2019112)是以Bt 4.0718为出发菌株,leuB基因无痕敲除的工程菌。Bt菌株的培养采用LB培养基(NaCl 10 g,tryptone 10 g,yeast extract 5 g,pH7.0,加超纯水定容至1 L,121 ℃灭菌20 min)。
1.2 主要试剂与仪器
FM4-64(T3166)购自Invitrogen公司。基因组DNA去除以及逆转录反应试剂盒HiScript®II Q RT SuperMix for qPCR(+gDNA wiper)购自Vazyme公司。实时荧光定量PCR反应(qRT-PCR)试剂盒PowerUPTM SYBRTM Green Master Mix购自ABI公司。正置显微镜购自德国卡尔-蔡司公司,型号为AXIO SCOPE A1;激光共聚焦扫描显微镜购自卡尔-蔡司,型号为LSM 710。
1.3 生长情况分析
将各菌株接种于10 mL LB 液体培养基过夜活化后,按照1%比例分别转接于50 mL LB培养基继续培养,每组设置3个平行。每2 h取样,以新鲜LB作为空白对照,利用分光光度计测定OD600值,确定各菌株的生长曲线。
1.4 染色液配置
1 mg FM4-64 染料溶解于0.5 mL DMSO中配备成母液,再用Hank’s平衡盐溶液(8 g/L NaCl,0.4 g/L KCl,1 g/L Glucose,0.06 g/L KH2PO4,0.126 g/L Na2HPO4·12H2O,0.35 g/L NaHCO3)稀释成工作液(25 μg/mL)。
1.5 染色与显微镜观察
染色:收集100 μL菌液,水洗3遍后重悬于200 μL无菌水中;取上述待染菌悬液10 μL,加入FM4-64工作液100 μL混匀,冰上染色1 min。
显微镜制样:取染色后的菌悬液(或未染菌悬液)6 μL滴于洁净载玻片上,盖上盖玻片、压片,激光共聚焦扫描显微镜(或倒置显微镜)观察。
1.6 总RNA提取与目的基因转录水平分析
活化过夜的Bt菌液按1%的接种量接种于30 mL液体LB培养基,30 ℃培养30 h,12 000 r/min离心3 min,收集0.1 g菌体;总RNA提取使用Trizol试剂;基因组DNA去除、逆转录反应及qRT-PCR反应按试剂盒说明书进行;引物序列及名称见表1;各基因的mRNA相对表达水平以16s rRNA为内参进行归一化处理;基因相对表达量计算按照2-ΔΔCT标准方法进行。

表1 本研究所用引物Tab.1 Primers used in this study
2 结果与分析
2.1 Bt 4.0718与Bt ΔleuB的生长情况分析
生长曲线测定结果显示,在延滞期、对数生长期和稳定期前、中期,Bt 4.0718与Bt ΔleuB两株菌的生长曲线没有显著差异,但从 26 h 开始(稳定期后期),Bt 4.0718由于菌体的迅速裂解,导致培养物的OD600值急剧下降,然而Bt ΔleuB的OD600值始终维持在比较平稳的状态(图1)。

图1 Bt 4.0718和Bt ΔleuB在LB培养基中的生长曲线比较Fig.1 Growth curves of Bt 4.0718 and Bt ΔleuB in LB medium
2.2 相差显微镜观察
相差显微镜观察结果显示:在培养至24 h时(稳定期后期),Bt 4.0718 细胞内可见典型的卵圆形芽胞和菱形晶体;同时期的 Bt ΔleuB无芽胞,大部分菌体内可见规则的菱形晶体。Bt 4.0718菌体细胞在48 h 时已完全裂解,芽胞和晶体随之释放;而Bt ΔleuB培养至96 h 时仍未裂解,菌体内包裹的菱形晶体体积进一步增大,有的甚至占据母细胞体积的1/3(图2)。

图2 Bt 4.0718和Bt ΔleuB在LB培养基中相差显微镜观察Fig.2 Observation of Bt 4.0718 and Bt ΔleuB cells in LB medium by phase-contrast microscopyS:芽胞;C:伴胞晶体S:Spores;C:Parasporal crystals
2.3 激光共聚焦扫描显微镜观察
为了探索Bt ΔleuB特殊表型背后的生物学机制,分别将菌株Bt 4.0718和Bt ΔleuB培养至芽胞期,取不同生长时间点的样品,用FM4-64染料对菌体染色,CLSM观察对比分析两株菌的芽胞发育过程。结果表明:当Bt 4.0718菌株生长到10 h时,少部分细胞开始形成不对称隔膜;14 h时,大部分细胞进入前芽胞内吞阶段;17 h时,芽胞内吞已完成,此时芽胞未能标记上FM4-64,只能观察到活细胞的外部膜状轮廓,相差模式下可见明显的芽胞和晶体;24 h时,进入凋亡阶段,母细胞膜破裂,FM4-64进入母细胞胞质溶胶,与聚集的膜碎片结合,导致细胞的外部轮廓不规则(图3)。
样品Bt ΔleuB的观察结果显示,14~17 h时,菌体逐渐形成不对称隔膜,相差模式下17 h时细胞内已可见明显的菱形晶体;24 h时,部分细胞进入胞吞阶段,隔膜形成期细胞仍然可见,晶体体积进一步增大;31 h时的芽胞发育状态与24 h无明显差别(结果未显示);40 h时,晶体体积达到最大,但仍无芽胞,母细胞尚无裂解迹象。然而CLSM观察发现:红色荧光在细胞内聚集,且显示的细胞外部轮廓不规则,表明大部分母细胞的质膜可能已破裂(图4)。

图3 激光共聚焦扫描显微镜分析Bt 4.0718菌株的芽胞发育过程以及母细胞裂解情况Fig.3 Analysis of the spore development process and mother cell lysis in Bt 4.0718 by CLSM箭头1:不对称隔膜;箭头2:前芽胞内吞;箭头3:伴胞晶体;箭头4:芽胞Arrow 1:The asymmetric septum;Arrow 2:The process of spore engulfment;Arrow 3:Parasporal crystal;Arrow 4:Spore

图4 激光共聚焦扫描显微镜分析Bt ΔleuB菌株的芽胞发育过程以及母细胞裂解情况Fig.4 Analysis of the spore development process and mother cell lysis in Bt ΔleuB by CLSM箭头1:不对称隔膜;箭头2:前芽胞内吞;箭头3:伴胞晶体Arrow 1:The asymmetric septum;Arrow 2:The process of spore engulfment;Arrow 3:Parasporal crystal
2.4 σE、spoIIR和spoIIGA的转录水平分析
晶体蛋白形成依赖于芽胞形成,因为cry基因的表达调控主要受σE和σK因子控制,它们分别在芽胞形成早期和晚期的母细胞中表达。鉴于Bt ΔleuB菌株的特殊表型,推测其细胞内维持ICPs正常表达的主要为σE。qRT-PCR结果显示,相对于Bt 4.0718,Bt ΔleuB中σE和上游信号分子spoIIR以及负责pro-σE切割活化的蛋白酶spoIIGA的转录水平均上升。
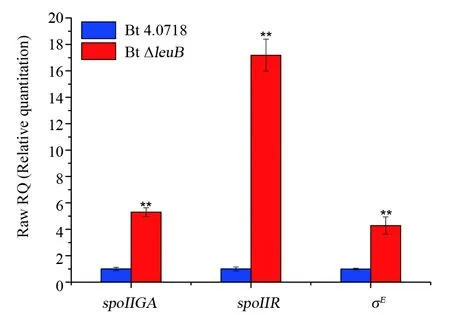
图5 两株Bt菌株中spoIIGA、spoIIR和σE基因的相对转录水平分析。** :P≤0.01 vs Bt 4.0718Fig.5 The relative transcriptional levels of the spoIIGA,spoIIR and σE genes in the two Bt strains. ** :P≤0.01 vs Bt 4.0718
3 讨论
在生长稳定期后期,Bt细胞会逐渐区室化形成一个卵圆形的芽胞,同时在母细胞内会形成伴胞晶体,这也是Bt区别于蜡状芽胞杆菌(Bacilluscereus)和炭疽芽胞杆菌(Bucilusanthracis)的显著特征,而只产生芽胞或晶体的突变菌株是研究Bt芽胞与晶体关系的重要遗传材料。无晶体突变株的构建方法已非常成熟,编码晶体蛋白的基因大多数位于Bt质粒上,因此多采用质粒消除的方法得到无晶体突变株[10]。只产生晶体的无芽胞突变菌株的构建原理则相对较复杂,这一类工程菌基本上是芽胞形成关键调控因子如spo0A、σE、spoIIID或σK因子的基因缺陷型突变株。其中spo0A或σE因子突变将严重影响芽胞形成依赖型cry基因的转录。Lereclus等[11]将cry3A或受cry3A启动子控制的cry1基因转入spo0A突变株后,能过量表达晶体蛋白且母细胞不裂解,晶体被包裹在细胞内,对解决晶体蛋白的紫外稳定性差等问题具有潜在应用价值[11]。spoIIID或σk基因缺失突变株基本丧失芽胞形成能力,但依然形成晶体[12,13]。与之相似的是,本研究中的Bt ΔleuB菌株也不能正常产生芽胞,但能形成伴胞晶体。已知Bt ΔleuB中的晶体蛋白编码基因为典型的芽胞依赖型cry基因,因此推断Bt ΔleuB菌株在生长过程中应该能够进入芽胞期,但没能顺利完成芽胞发育过程,而是被阻断于中间某一阶段。
芽胞形成以不对称细胞分裂开始,原来的细胞被双层膜结构的隔膜分成了大小不等的两个区室,即前芽胞(较小的区室)和母细胞。在不对称分裂之后,芽胞形成的下一个形态学阶段是母细胞吞噬前芽胞,使前芽胞成为其细胞质中的游离原生质体。接下来位于芽胞核心周围的一系列保护结构被逐渐组装,如皮质层、芽胞衣结构等[2,14,15],最后母细胞经由程序性细胞死亡机制裂解后,成熟的芽胞得以释放,其中前芽胞内吞的完成是控制芽胞后期发育成熟的关键事件。CLSM观察结果显示:Bt 4.0718和Bt ΔleuB分别于10 h、14 h左右时开始形成不对称隔膜(Stage Ⅱ);并分别于14 h、24 h左右时开始进入前芽胞内吞阶段(Stage Ⅲ),这表明突变株能顺利进入芽胞形成期,然而相比野生菌Bt 4.0718能完成芽胞发育的整个过程,Bt ΔleuB的芽胞发育可能被阻断于内吞阶段,因此导致该菌株无芽胞产生,但伴胞晶的体形成从细胞不对称分裂期就已开始,且晶体体积较大。
Bt在芽胞发育过程中通过先后激活6个不同的σ因子,使调控芽胞形成基因准确无误地表达。其中σF和σE分别在芽胞形成早期的前芽胞和母细胞中表达,σG和σK分别在芽胞形成晚期的前芽胞和母细胞中表达。细胞完成不对称分裂后不久,激活的σF致使前芽胞分泌信号蛋白spoIIR进入母细胞,一旦接收到来自前芽胞的信号,定位于膜上的pro-σE即被天冬氨酸蛋白酶spoIIGA切割为活化的σE,活化的σE启动母细胞中cry基因的转录[16,17]。qRT-PCR结果显示,Bt ΔleuB中σE、spoIIR和spoIIGA的转录水平均显著上调。因此,虽然Bt ΔleuB菌株芽胞发育缺陷(被阻滞于胞吞阶段),但晶体蛋白积累并未受到影响,这再次印证了Bravo等[12]的研究结论,单独的σE因子就足以支撑σE、σK依赖型双重叠启动子(Bt Ⅰ+ Bt Ⅱ)cry基因的高水平表达。另一方面,Bt ΔleuB菌株母细胞不裂解的表型与其芽胞发育缺陷密切相关,中国农科院张杰研究员等[18]研究发现,细胞壁水解酶基因cwlC的转录受σK控制,并且cwlC缺失可完全阻断Bt母细胞的裂解。因此我们推测,Bt ΔleuB菌株中晚期sigma因子σK活性降低或缺失是其母细胞裂解受阻的关键因素。比较有趣的是,与Hosoya等[7]的结果一致,CLSM观察结果发现,24 h时,Bt 4.0718细胞在相差模式下还有完整的细胞形态,但FM4-64染色结果显示细胞膜已破裂,这表明在Bt细胞程序性死亡过程中,细胞膜破裂是早于细胞壁裂解的生物学事件。并且在Bt ΔleuB菌株中,虽然细胞壁裂解受阻断,但在40 h时,细胞已开启死亡程序(膜破裂)。
选择一株具有特殊表型的Bt突变株及其出发菌株作为研究对象,利用荧光染料进行细胞发育过程的形态学观察,为研究芽胞发育、晶体形成以及母细胞裂解三者之间的关系提供了一些线索,但具体的分子机制还有待进一步深入研究。
