Ⅰ型胶原修饰微球对骨髓间充质干细胞粘附增殖及成骨行为的影响
2020-05-28竺鑫晨章非敏
竺鑫晨,刘 俊,严 佳,胡 克,陈 刚,刘 梅,章非敏
骨缺损是临床常见的疾病,目前治疗的临床标准仍是自体骨移植、异体骨移植[1],但这些方法存在来源受限、诱导继发创伤、免疫排斥等缺点。组织工程将材料、生物及机械工程的原理与技术相结合,制造各种各样的骨替代材料[2],被认为是最有前景的骨缺损治疗方法。有机高分子合成材料聚己内酯(Polycaprolactone,PCL)是一种半结晶的可吸收脂肪族聚酯,其降解产物可以通过三羧酸循环或肾脏分泌物完全排出,对人体无毒副作用[3],具有良好的机械灵活性、生物相容性、降解性,已被美国FDA批准可用于临床[4]。但由于PCL的疏水性、缺乏细胞可识别的生物活性位点,使材料表面的初始细胞附着率和增殖率较低[5]。因此,近年来学者们探索了使用不同方法改变PCL支架表面特性来克服这些限制,如与胶原蛋白、生物陶瓷及化学试剂混合[6-8]。胶原蛋白是细胞外基质的主要组成部分,存在于软骨、骨、椎间盘、血管、肌腱、韧带、皮肤和角膜中,其中Ⅰ型胶原是28种已知胶原中含量最丰富的一种,也是骨中含量最丰富的一种,构成了骨有机质量的90%,有亲水性好、抗原性低、加工方便等优点[9],但力学性能较差、易膨胀、在体内代谢率过高等缺点限制了胶原支架在体内外的应用[10],因此常与其他材料混合使用[11-12]。
本实验通过在PCL微球表面修饰0.1%、0.5%、2.0%的Ⅰ型牛腱胶原,模拟天然骨组织微环境,研究其对微球上BMSCs细胞附着、增殖及成骨能力的影响,以指导制备出利于骨组织再生的支架。
1 材料与方法
1.1 主要试剂与仪器
PCL(济南岱罡生物工程有限公司,中国山东),二氯甲烷(国药,中国北京),BMSCs(P2,cyagen,中国上海),Oricell SD大鼠骨髓间质干细胞完全培养基、Oricell SD大鼠骨髓间质干细胞成骨诱导分化培养基(cyagen,中国上海),0.25%胰酶/EDTA(Gibco,美国),磷酸盐缓冲液(phosphate buffered solution,PBS,Hyclone,美国),Triton X-100(solarbio,中国北京),CCK-8(碧云天生物技术有限公司,中国上海),鬼笔环肽(Cytoskeleton,美国),DAPI(碧云天生物技术有限公司,中国上海),碱性磷酸酶(ALP)检测试剂盒(建成生物工程研究所,中国南京),BCA蛋白检测试剂盒(雷根生物技术有限公司,中国北京),LGJ-10冷冻干燥机(松源华兴科技发展有限公司,中国北京),激光共聚焦显微镜(Jena,德国),Spectra Max 190酶标仪(Molecular device,美国),Ⅰ型胶原由江南大学药学院陈敬华教授课题组提供。
1.2 PCL微球制备及表面修饰
微球的制备:取5 mL明胶溶液,将其倒入10 mL PCL二氯甲烷溶液中,匀浆后倒入50 mL的1% PVA水溶液中,500 r/min搅拌1 min,将混合液体倒入400 mL 0.1% PVA水溶液,300 r/min搅拌4~6 h。50 ℃双蒸水冲洗,过滤,得PCL微球,密封保存。
表面修饰:将冷冻干燥后的微球分别浸泡在0.1%、0.5%、2.0%的Ⅰ型胶原+0.05 mol/L乙酸溶液(已用氢氧化钠将pH调至7)中24 h,吸弃溶液,室温蒸发4 h,冷冻干燥。
因此一共4组:未修饰,0.1%、0.5%、2.0%的Ⅰ型胶原修饰,用于以下实验。
1.3 表面形貌观察
PCL微球经过冷冻干燥24 h后,喷金3 min,置于场发射扫描电子显微镜下观察其表面形貌。
1.4 微球吸水率
用比重法测量四组微球的吸水率。每组样品制作3个平行样,室温下,将干重为W0的材料在双蒸水中浸泡24 h后拿出,吸干材料表面水分并称重为W1。按照公式吸水率=(W1-W0)/W0×100%计算吸水率。
1.5 细胞学检测
细胞培养条件:37 ℃、5% CO2、100%湿度,培养液每两天换1次。接种细胞前,微球于75%乙醇溶液浸泡1 h,无菌PBS漂洗3次,完全培养液中预培养过夜,备用。
1.5.1 细胞增殖情况检测 将四种微球铺满96孔板底部,每孔接种5×103个BMSCs,按前述条件培养细胞。在细胞接种后第1、3、5、7天弃原培养液,加入工作液100 μL(CCK-8与完全培养液以1∶10混合),37 ℃孵育2 h,每孔吸取80 μL液体至96孔板,于酶标仪上测试在450 nm波长处的光密度(OD)值。
1.5.2 细胞粘附能力检测 用激光共聚焦显微镜观察细胞在微球上的铺展形态。细胞接种于24孔板中,1×104个/孔。于6、12、24 h后以4%多聚甲醛室温固定10 min,0.5% Triton X-100打孔3 min,鬼笔环肽37 ℃避光孵育30 min,PBS冲洗3次,DAPI避光染色30 s,PBS冲洗3次,激光共聚焦显微镜下观察。
1.5.3 ALP活性检测 将微球铺满6孔板底部,每孔接种细胞2.5×105个,BMSCs专用成骨诱导培养基下培养3、7 d后,弃原培养液,PBS冲洗3次,每孔加300 μL 0.5% Triton X-100裂解30 min,离心收集上清液进行分析。ALP活性和总蛋白浓度分别按照ALP检测试剂盒和BCA蛋白检测试剂盒说明书进行检测。
1.6 统计学分析
2 结 果
2.1 四种微球表面形貌及微观结构
场发射扫描电子显微镜下(图1)观察发现:PCL微球粒径约为450~500 μm,呈疏松有孔状。对照组PCL框架表面光滑,0.1% COLⅠ组、0.5% COLⅠ组可见蜘蛛网状胶原覆盖微球表面,胶原丝直径约为150~200 nm;2.0% COLⅠ组可见胶原丝直径较粗,约为600~800 nm,微球表面较多膜状、颗粒状胶原覆盖,分布不规则。
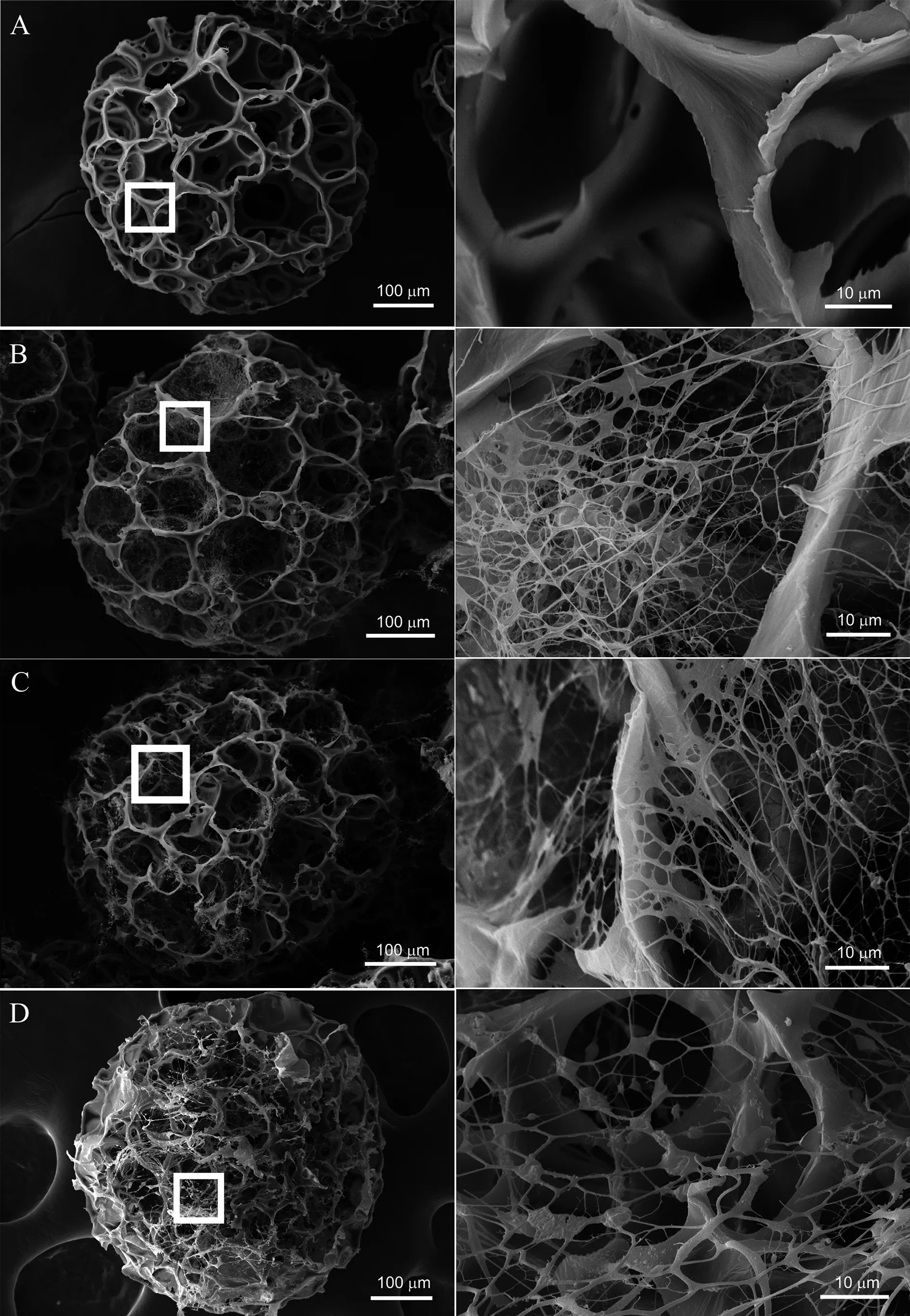
A:对照组;B:0.1% COLⅠ组;C:0.5% COLⅠ组;D:2.0% COLⅠ组
图1 四组微球的表面电镜图
Fig.1Field emission scanning electron microscopyimages of microspheres of four groups
2.2 吸水率
吸水率如图2显示,三组胶原修饰后的PCL微球与对照组相比吸水率均有显著增长(0.1% COLⅠ组P=0.027,0.5% COLⅠ组P=0.021,2.0% COLⅠ组P=0.018),2.0% COLⅠ组高于0.1% COLⅠ组(P=0.011),但与0.5% COLⅠ组无明显差异(P=0.617)。
2.3 细胞增殖
CCK-8检测各组细胞在四种微球支架上的增殖情况(图3),各组支架上的细胞均从第1天到第7天不断增殖。第1天各组间无明显差异,第3天0.1% COLⅠ组和0.5% COLⅠ组的细胞数量明显高于其他两组(P<0.001); 第5天胶原修饰的各组均高于对照组,且胶原浓度越低细胞数量越高(0.1% COLⅠ组P<0.001,0.5% COLⅠ组P<0.001,2.0% COLⅠ组P=0.039);2.0% COLⅠ组细胞在第7天增长缓慢,与第5天相比细胞无明显增殖(P=0.667),且细胞数量低于对照组(P<0.001),0.5% COLⅠ组与对照组无差异(P=0.998)。
1:0.1% COLⅠ组;2:0.5% COLⅠ组;3:2.0% COLⅠ组;4:对照组;*:与0.1% COLⅠ组相比,P<0.05;#:与0.5% COLⅠ组相比,P<0.05;&:与2.0% COLⅠ组相比,P<0.05
图2四组微球吸水率
Fig.2Water absorption rate of microspheres of four groups
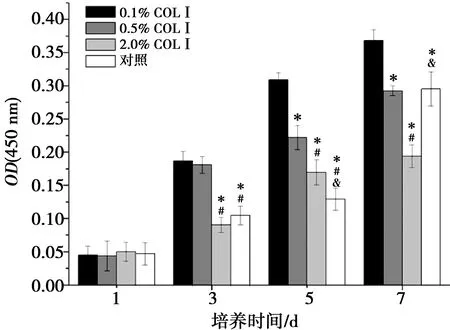
*:与0.1% COLⅠ组相比,P<0.05;#:与0.5% COLⅠ组相比,P<0.05;&:与2.0% COLⅠ组相比,P<0.05
图3CCK-8法检测BMSCs细胞在四组微球上第1、3、5、7天的增殖活性
Fig.3Proliferation of BMSCs onmicrospheres of fourgroups measured by CCK-8assays after1,3,5and7days
2.4 细胞初期粘附
细胞粘附结果如图4所示,红色为鬼笔环肽(显示细胞骨架),蓝色为DAPI(显示细胞核)。在接种6 h后0.1% COLⅠ组和0.5% COLⅠ组可见较多细胞附着,细胞呈圆形,无明显伪足,2.0% COLⅠ组和对照组细胞附着较少;在12 h和24 h后可见各组细胞呈多边形,伪足伸展,互相连接,各组差异不明显。
2.5 ALP活性检测
BMSCs细胞在四组材料上培养3、7 d的ALP活性结果(ALP单位以U/g蛋白表示)如图5所示。
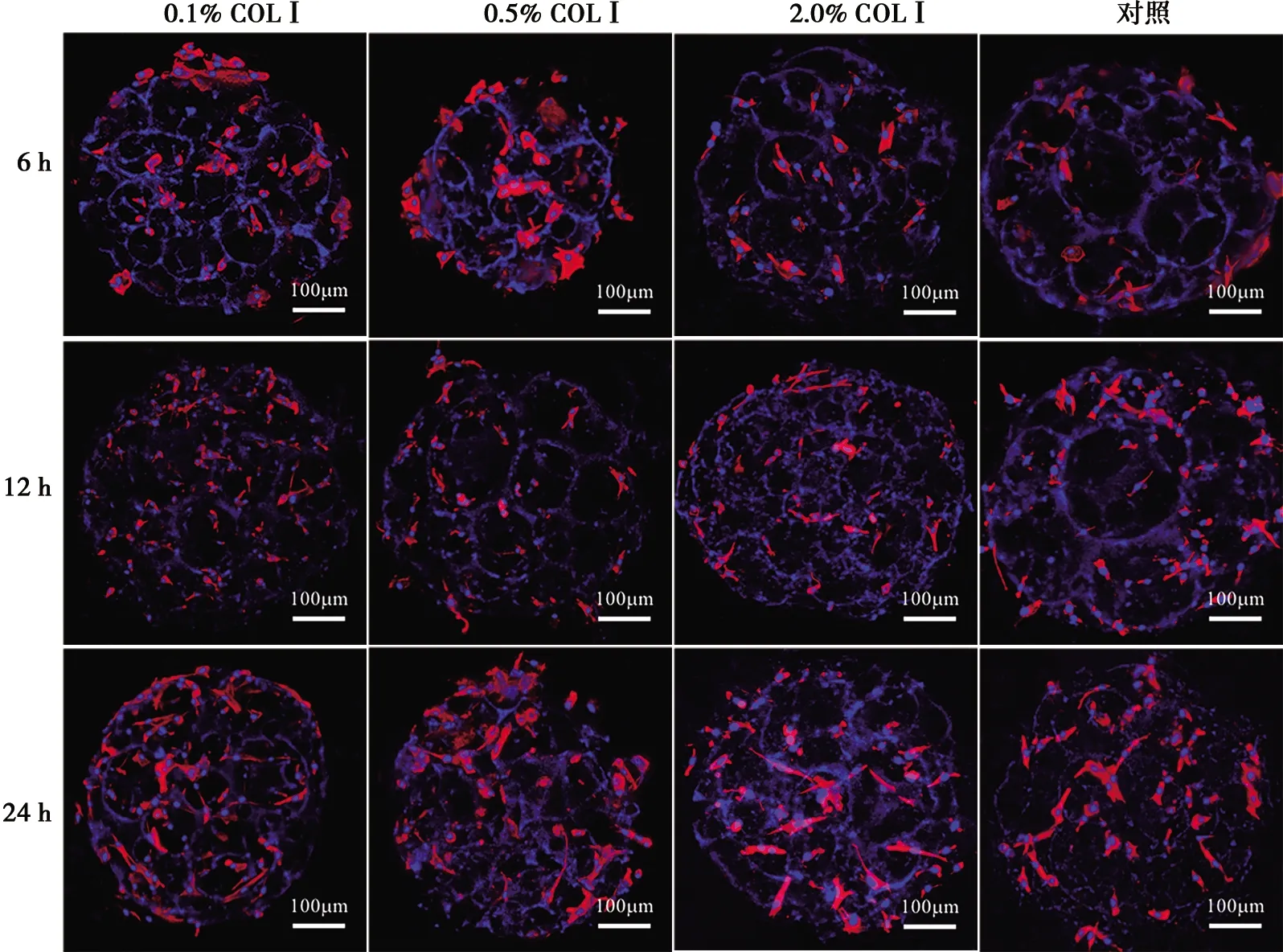
红色为鬼笔环肽(显示细胞骨架),蓝色为DAPI(显示细胞核)
图4BMSCs细胞接种于四组微球后6、12、24h激光共聚焦图(×100)
Fig.4CLSM images of BMSCs onmicrospheres of four groups after6,12and24hours (×100)
第7天所有组内ALP活性比第3天升高,0.1% COLⅠ组间P=0.026,0.5% COLⅠ组间P=0.015,2.0% COLⅠ组间P=0.009,对照组间P=0.044,0.1% COLⅠ组ALP活性均高于其他三组,0.1% COLⅠ组与0.5% COLⅠ组相比P=0.045,与2.0% COLⅠ组相比P=0.046,与对照组相比P=0.027,第3天其他三组之间无统计学差异,0.5% COLⅠ组与2.0% COLⅠ组相比P=0.109,0.5% COLⅠ组与对照组相比P=0.246,2.0% COLⅠ组与对照组相比P=0.999;第7天,0.5% COLⅠ组和2.0% COLⅠ组间无差异(P=0.999)但均高于对照组,0.5% COLⅠ组与对照组相比P=0.014,2.0% COLⅠ组与对照组相比P=0.057。
3 讨 论
组织工程的目的是开发合适的支架,模拟天然骨组织微环境,易于被再生功能良好的自体细胞定植从而修复骨缺损。支架必须具备的要求:形状与缺损部位相匹配;生物相容性好无炎症或免疫反应;生物可降解,便于新形成的组织取代支架;有空间容纳细胞迁移和养分交换及实现在宿主组织中血管增长可能[13]。而本研究中扫描电镜结果显示PCL微球含有疏松的孔隙结构(图1), 符合此要求。设计成这样的结构有很多优点,比如: 扩大了比表面积,与平面二维材料相比,材料上的细胞可利用更多的空间进行扩张,从而促进细胞的增殖[14];另外,支架材料的这样的结构设计通过保存组织体积、提供机械性能和传递生物因子,在组织再生中提供了细胞通道来引导细胞迁移和组织生长[15];表面积大的支架材料可以促进有效的蛋白质吸附、细胞附着、增殖和细胞外基质的产生[16]。然而,这样的有孔结构增加了PCL的疏水性[17]且单纯的PCL微球过于单一,无法满足支架的多重要求,近年来复合支架的出现与研究越来越受学者的关注。
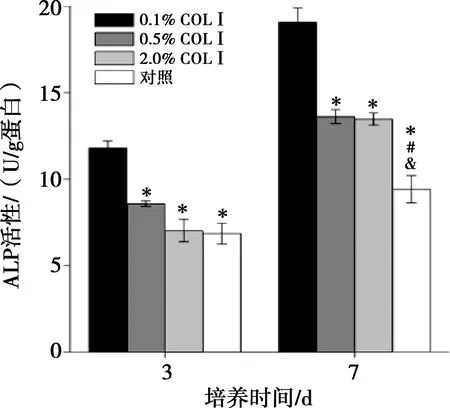
*与0.1% COLⅠ组相比,P<0.05;#与0.5% COLⅠ组相比,P<0.05;&与2.0% COLⅠ组相比,P<0.05
图5四组微球上BMSCs细胞成骨诱导3、7d的ALP活性检测结果
Fig.5ALP activity of BMSCs onmicrospheres of fourgroups after osteogenic induction of3and7days
因此我们在此基础上,进一步对其以不同浓度的胶原修饰,得到了具有不同结构和细胞学特性的微球。在胶原修饰后,扫描电镜结果显示胶原修饰组微球表面及孔隙中均有网状胶原纤维覆盖贯穿。吸水率实验显示随着胶原浓度的增高,吸水率也在升高。
而细胞增殖结果却没有随着胶原浓度的增加而增加,其中0.1% COLⅠ组效果最好,而高浓度效果却明显降低。可能原因如下:由于胶原的吸水膨胀性,高浓度胶原修饰过的支架孔隙率下降,比表面积降低,物质流通减少,过小的孔隙使细胞无法伸入生长[18-19]。因此,这也就可能导致了2.0% COLⅠ组中细胞增殖速率低于0.1% COLⅠ组。激光共聚焦结果也显示低浓度的胶原修饰后的微球有着良好的早期细胞粘附铺展特性。在接种后6 h,低浓度胶原修饰组就有较多的细胞粘附,可能也是此原因导致。
ALP结果进一步显示了低浓度胶原修饰的作用,ALP是早期成骨细胞分化标志,由细胞外基质矿化的细胞产生。本实验ALP活性定量结果显示0.1% COLⅠ组在第3、7天均高于其他组别。胶原是可以启动和促使矿化过程的[10]。根据Sisson等[20]的研究,成骨细胞的分化作用在小直径纤维支架(110 nm)上较在大直径纤维支架(600 nm)上更为明显。而本研究中扫描电镜结果显示低浓度胶原组具有较细的胶原纤维,这可能便是该组细胞有着较为活跃的成骨活性的原因。
综上,本研究发现0.1% COLⅠ表面修饰提高了细胞的粘附增殖及成骨分化能力,但其在体内成骨作用的影响还有待进一步研究。
