氮代谢参与植物逆境抵抗的作用机理研究进展
2020-05-26王新磊吕新芳
王新磊 吕新芳
摘 要: 近年来,植物所受到的诸如干旱、盐、高温、低氧、重金属胁迫和营养元素缺乏等环境胁迫越来越多,严重影响了植物的生长发育及作物的质量和产量。氮素是植物生长发育所需的必需营养元素,同时也是核酸、蛋白质和叶绿素的重要组成成分,其代谢过程与植物抵抗逆境的能力息息相关。氮代谢是指植物对氮素的吸收、同化和利用的全过程,是植物体内基础代谢途径之一。氮代谢主要从氮素吸收、同化及氨基酸代谢等方面参与植物的抗逆性,并通过调节离子吸收和转运、稳定细胞形态和蛋白质结构、维持激素平衡和细胞代谢水平、减少体内活性氧(reactive oxygen species,ROS)生成以及促进叶绿素合成等生理机制来影响植物抵抗非生物胁迫的能力。因此,提高植物在逆境下的氮代谢水平是减轻外界胁迫对其损伤的一种潜在途径。该文从氮素同化的基本途径出发,分别阐述了氮代谢在干旱胁迫、盐胁迫和高温胁迫等多个方面的逆境抵抗过程中的作用机理,为氮代谢参与植物抗逆性研究提供了有利参考。
关键词: 植物, 氮代谢, 盐胁迫, 干旱胁迫, 高温胁迫, 抗性机理
中图分类号: Q943 文献标识码: A
文章编号: 1000-3142(2020)04-0583-09
Abstract: In recent years, plants are facing more and more environmental stresses, such as drought, salt, high temperature, hypoxia, heavy metal stress and nutrient deficiency, which seriously affects the growth and development of plants, and the quality and yield of crops. As an essential nutrient for plant growth and development, nitrogen is also an important component of nucleic acids, proteins and chlorophyll. Its metabolic process is closely related to the ability of plants to resist adversity. Nitrogen metabolism refers to the whole process of absorption, assimilation and utilization of nitrogen in plants, which is one of the basic metabolic pathways in plants. Previous studies have shown that the nitrogen metabolism mainly participates in plant stress resistance from nitrogen absorption, nitrogen assimilation and amino acid metabolism. And it enhances the ability of plants to resist abiotic stress via regulating the absorption and transport of ions, stabilizing cell morphology and protein structure, maintaining hormone balance and cellular metabolism level, and mitigating excessive reactive oxygen species (ROS) formation. Therefore, improving the nitrogen metabolism of plants under adverse conditions is a promising approach to alleviate the damage caused by external stress. In this review, we highlight the pathway of nitrogen assimilation, and emphasize its potential roles in abiotic stress resistance from drought stress, salt stress and high temperature stress, and put forward some suggestions for future research on nitrogen metabolism involved in plant stress resistance.
Key words: plant, nitrogen metabolism, salt stress, drought stress, high temperature stress, resistant mechanism
隨着气候环境的不断变化,植物生长过程中所面临的各种胁迫(如干旱、盐碱、高温、重金属及营养元素缺乏等)会导致植物体内多种生理生化代谢发生改变,造成作物严重减产。因此,研究逆境胁迫对植物的作用机理,通过基因工程手段进行作物改良,培育抗逆新品种,已成为目前各国科学家研究的热点。
氮素是植物生长发育的必需营养元素,其代谢过程与植物的生长发育紧密相关。近年来,氮代谢参与植物抗逆境的研究逐渐被发掘,研究层次也由形态、生理水平逐步向分子水平过渡,且多集中在水稻(Oryza sativa)、小麦(Triticum aestivum)、玉米(Zea mays)、拟南芥(Arabidopsis thaliana)、烟草(Nicotiana tabacum)和大豆(Glycine max)等植物中。氮代谢和植物抵抗逆境的关系复杂,其主要从氮素吸收、同化及氨基酸代谢等方面参与植物的抗逆性,通过调节离子平衡、稳定细胞形态和蛋白质结构、维持激素平衡和细胞代谢水平、减少体内活性氧(reactive oxygen species, ROS)生成、促进叶绿素合成及维持光合作用正常进行等生理机制来影响植物抵抗非生物胁迫的能力。因此,深化认识氮代谢对于植物抵抗各种逆境的分子机理具有极其重要的指导意义。本文主要从盐胁迫、干旱胁迫和高温胁迫三个方面对氮代谢参与植物逆境抵抗的研究进行了综述,以期为氮代谢参与植物的抗逆性研究提供信息资料。
1 氮代谢概述
1.1 氮代谢概念
氮代谢是指植物对氮素吸收、同化和利用的全过程。它是植物体内最基本的生理过程之一,决定着作物的生长状态,并影响作物的质量和产量。氮代谢调节对于植物抵抗逆境具有重要的作用,它几乎涉及植物的所有生理过程。
1.2 氮素同化途径
氮素不仅是植物生长必需的营养元素,而且也是蛋白质、核酸、酶、叶绿素、维生素、植物激素和生物碱等多种化合物的重要组成部分(Robertson & Vitousek, 2009)。自然界中的氮素大部分以N2的形式存在于空气中,不能被植物直接吸收利用。植物所利用的氮素主要来自于土壤或水体中的可溶性有机氮化物(如尿素、氨基酸、多胺等)和无机氮化物,其中无机氮化物是植物主要的氮源,包括铵态氮和硝态氮。
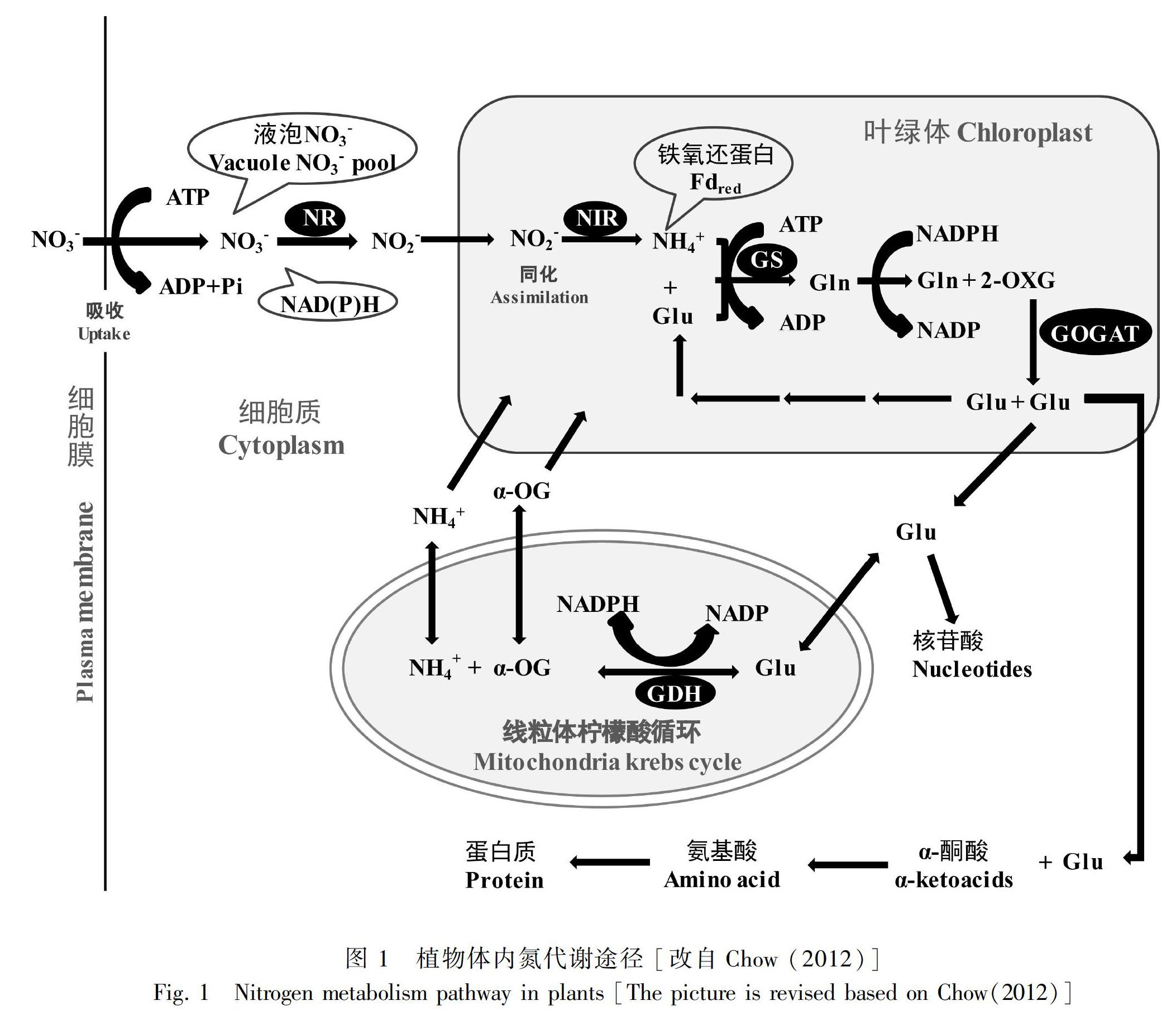
根据利用氮源种类的不同,植物体内的氮素同化可分为硝酸根(NO-3)同化和铵根(NH+4)同化,其基本过程如图1所示。
植物从土壤中吸收的NO-3在细胞质中经硝酸还原酶(nitrate reductase, NR)还原为NO-2,然后在叶绿体中经亚硝酸还原酶(nitrite reductase, NiR)还原为NH+4,这个过程被称为NO-3同化。NO-3同化产生的NO-2和NH+4对植物是有毒的,因此产生的NH+4会迅速进入NH+4同化途径。
NH+4同化途径有两条,其中之一是NH+4经GS/GOGAT途径转变为氨基酸的过程,超过95%的NH+4同化通过该途径进行。NH+4首先与谷氨酸(glutamate, Glu)在谷氨酰胺合成酶(glutamine synthetase, GS)的催化作用下合成谷氨酰胺(glutamine, Gln);然后Gln和α-酮戊二酸在谷氨酸合酶(glutamate synthase, GOGAT)的催化作用下形成两分子Glu (Lawlor, 2002)。其中,一分子Glu用于合成其他氨基酸和酰胺,形成可被植物直接利用的氮素化合物;另一分子则作为原料再次进入GS/GOGAT循环中(Chow, 2012)。第二条NH+4同化途径是直接由谷氨酸脱氢酶(glutamate dehydrogenase, GDH)催化NH+4和α-酮戊二酸(a-oxoglutarate, α-OG)缩合形成Glu。研究发现该途经是可逆的,在高等植物中总是朝着Glu降解的方向进行,且被认为在碳和氮代谢中发挥着不可或缺的作用(Fontaine et al., 2012; Masclaux-Daubresse et al., 2006; Glevarec et al., 2004)。由上可知,NR、NiR、GS、GOGAT和GDH是参与植物氮代谢过程的关键酶,其活性在一定程度上反映了植物的营养状况和氮素同化的水平。
2 氮代谢与植物逆境胁迫
2.1 氮代谢与盐胁迫
盐胁迫会影响植物体对离子的吸收和运输,导致细胞内渗透压发生改变,引发植物体内生理代谢的改变,如水分摄取减少、营养失衡、特定离子毒害、活性氧生成增加、激素平衡紊乱、酶失活、脂质过氧化、叶绿素合成减少和光系统破坏等。
随着盐浓度的增加,植物对Na+和Cl-的摄取增加,从而导致K+/Na+比值降低,植物体内Cl -的积累会刺激乙烯合成,促进叶片脱落,抑制植物生长。因此,减少植物中Cl-积累、提高K+/Na+比值是提高植物耐盐性的重要生理过程,也是植物抗盐胁迫的重要保护机制。De et al. (2016)和Singh et al. (2016)分别对高粱(Sorghum bicolor)和番茄(Solanum lycopersicum)的研究表明施加氮素可有效抑制植物对Na+的摄取,提高地上部分K+含量。Iqbal et al. (2015)对芥菜(Brassica juncea)的研究指出,盐胁迫下施加氮素可减少植物对Na+和Cl-摄取和积累。在多种植物中得到的这些一致结果说明,盐胁迫下施加氮素的确能减少植物中Cl-积累、提高K+/Na+比值。Esmaili et al.(2008)对盐胁迫下的高粱植株施加氮肥,铵态氮能显著减少植株对Na+吸收和在体内的积累,而硝态氮的作用效果不明显。Ashraf et al. (2018)对这种现象的解释是NH+4和Na+竞争根部质膜的离子吸收位点,NH+4浓度升高,根部對Na+的吸收减少。Sperandio et al.(2011)对氮饥饿处理的水稻施加氮素,发现水稻质膜H+-ATPase的活性增加。随着根质膜微囊H+-ATPase活性增大,形成的质子跨膜梯度促进K+进入细胞质,并激活质膜的Na+/H+交换门,选择性减少K+外流和加速Na+排放(Zhang et al., 2017)。此外,Na+在植物叶片内的空间分布受氮素影响,施加氮素使Na+被区隔在叶片质外体和叶片边缘,避免中心部位遭受Na+毒害,而且硝态氮的影响效果高于铵态氮(Gao et al., 2016)。由上可知,氮素可调节植物对离子选择性吸收和运输的原因:一方面是NO-3和NH+4分别具有对Cl-和Na+的拮抗作用,直接抑制Cl-和Na+的吸收;另一方面是氮素影响其他基因的表达和酶的活性,调节离子进出的通道。因此,氮素施加可改变植物对离子的选择性吸收和转运,以维持盐胁迫下植物体本身生理代谢的动态平衡。
在盐胁迫下,植物会由于细胞内水势升高造成吸水困难,而渗透调节是植物在盐胁迫下维持水分状态的主要调节机制。植物通过积累无机离子和合成有机渗透调节物质来调节渗透势,包括脯氨酸、酰胺、甜菜碱、蛋白质和多胺等多种有机物(Mansour, 2000),而氮素是合成有机渗透调节物质的重要元素,它们在提高植物农艺性状和生理性能中起关键作用。研究证实,脯氨酸能显著提高植物的抗逆性(Averina et al., 2014),其作为分子伴侣可以稳定生物膜的完整性和蛋白质结构,作为渗透调节物质调节渗透势,作为抗氧化剂清除体内ROS,作为生长发育的信号诱发植物生长发育过程。研究发现这些含氮化合物除了作为渗透调节物质外,还能显著提高植物抗氧化作用、光合速率(Khoshbakht et al., 2018)及氮代谢水平。
氮代谢过程关键酶在植物响应盐胁迫中发挥了重要作用。杨洪兵(2013)研究了耐盐品种和敏感品种的荞麦(Fagopyrum esculentum)在盐胁迫下NR和NiR的活性变化,结果表明耐盐品种NR和NiR活性下降幅度相对较小。Ozawa & Kawahigashi(2006)发现水稻NiR基因的过表达能改善植株的生长状态,增强愈伤组织的再生能力。近期,Lü et al. (2018)研究了鳗草(Zostera marina)在NaCl胁迫下的转录组,发现在NaCl处理后植物体内硝酸盐同化关键酶NR和NiR基因表达显著上调。综上分析,NO-3同化过程可能与植物的耐盐性相关,但其在不同物种中发挥的抗逆作用是有差异的。此外,NR是植物体内合成NO的主要酶源之一,直接影响到NO的产生,NO是生物体内维持细胞稳态的主要信号分子,它能诱导H+-ATPase基因的表达,增加胞内K+/Na+比值,减轻植物在胁迫下的氧化应激反应,从而提高植物的抗逆性(Del Castello et al., 2019)。
GS和GOGAT是NH+4同化过程的关键酶,不仅在解除NH+4离子毒害方面发挥重要作用,而且还与脯氨酸等胁迫保护分子的合成密切相关(Brugiere et al., 1999)。GDH被视为一种应激反应酶(Skopelitis et al.,2006),在Glu合成中起到补充作用。当植物处于逆境时,GS和GOGAT的活性被抑制,NO-3同化和蛋白质降解产生的NH+4积累引起铵中毒,此时GDH酶活性增加,在诱导胁迫保护分子合成(Terce-Laforgue et al., 2015)及解除或缓解铵中毒方面发挥了独特作用(Lasa et al., 2002)。目前的研究中,不同物种中关于盐胁迫下NH+4同化关键酶GS和GOGAT酶活性变化的结果有显著差异。在桑树(Morus alba)中上述两种酶的活性在盐胁迫下均提高,而在番茄中酶活却降低,一致的是GDH酶活均随盐浓度的提高而提高(Singh et al., 2016; Surabhi et al., 2008),可能這些植物在盐胁迫下主要是通过GDH进行铵同化过程。随着分子技术的发展,基于分子水平的研究占据主流,Liu et al. (2016)研究了番茄GS、GOGAT、GDH基因及其在逆境下的表达,发现GS、GOGAT、GDH基因均以基因家族的形式存在,在番茄中发现了6个GS基因、2个GOGAT基因和5个GDH基因,这些基因分别由至少一种胁迫诱导表达。James et al.(2018)通过生理实验证明,GS1和GS2基因的共过表达能显著提高水稻植株在逆境胁迫下的农艺性状和生理指标。由上可知,GS过表达增强植物光呼吸的能力,消耗多余NADPH,过氧化物合成减少,降低植物氧化损伤。GDH作为铵同化的后补队员,缓解了逆境胁迫引起的铵中毒。更重要的是,GS、GOGAT、GDH基因家族不同成员之间存在明显的分工,它们分别参与植物对不同胁迫的响应过程。总之,氮代谢关键酶对植物抵抗盐胁迫具有重要的作用,但不同酶发挥作用的机制有所不同,且不同物种之间调控机制也不尽相同,这暗示着氮代谢对植物盐胁迫的调控机制是极其复杂和有物种特异性的。
综上所述,氮代谢主要通过调节离子吸收、含氮化合物含量及氮代谢关键酶活性的变化影响植物耐盐性,它们协调配合共同发挥作用。值得注意的是,在不同植物中具体调节机制存在差异。
2.2 氮代谢与干旱胁迫
干旱胁迫对植物造成的损伤类似于盐胁迫,都会影响植物生长及光合作用、酶系统和抗氧化系统的稳态。不同的是,盐胁迫偏重于渗透胁迫和离子毒害,而干旱胁迫更偏重于光合系统损伤。因此,防止细胞脱水,保持细胞水分平衡,维持细胞内正常代谢过程,对提高植物耐旱性极其重要。
研究证实,施加氮素可有效缓解干旱胁迫对植物的损伤。在多种植物如桢楠(Phoebe zhennan)(王曦等,2018)、小麦(王秀波,2018)中已经得到证实,氮素与干旱胁迫存在明显的交互效应,即低至中等干旱胁迫下,中量施氮缓解了干旱胁迫对植物的损伤,而重度干旱胁迫下,施氮反而加剧了干旱胁迫对植物的损伤。这种交互作用表明氮素在植物干旱胁迫耐受性方面的调节取决于胁迫程度和施加氮素的水平,适当的施氮有助于植物抵御胁迫,利于植株正常生长。但是,熊炳霖(2016)在对玉米的研究中发现,干旱胁迫下施氮反而增加了作物对干旱胁迫的敏感性,与小麦、桢楠中的结果有所不同,这可能是由于氮素在干旱耐受中的作用因植物种类不同而不同。
植物氮代谢与碳代谢紧密相关,植物吸收的氮素大部分用于光合作用,氮素水平与光合速率呈显著正相关,且氮代谢产物谷氨酸是合成叶绿素的前体,因此通过施加氮素改善光合作用,进而提高植物耐旱性成了潜在的研究目标。Zhong et al. (2018, 2017)通过生理实验证明,较高含量氮素提升了水稻光合作用对干旱胁迫的适应性,表现为光合速率增加、叶片内抗氧化酶活性增加、硝酸盐含量降低、脯氨酸含量上升等。Xiong et al. (2015)研究了水稻叶片光合作用的异质性与氮含量的关系,发现叶片氮含量与气孔导度呈正相关。Yi et al. (2014)发现氮代谢可以消耗过多的ATP和NADPH,耗散过量捕获的光能。因此,氮代谢一方面通过参与气孔运动的调节,缓解气孔关闭对光合作用的限制;另一方面消耗多余的能量,减轻干旱胁迫引起的光合作用的光抑制。此外,胁迫下氮代谢关键酶NR、GS和GOGAT活性的增加,促进硝酸盐和铵的同化,合成作为渗透物质的脯氨酸和其他含氮化合物,维持水分平衡。
综上所述,氮素与干旱胁迫存在明显的交互效应,适量施氮可以有效改善干旱胁迫下植物的光合作用及其他生理功能。此外,氮代谢关键酶的活性和含氮化合物的积累对植物耐旱性也有重要作用。
2.3 氮代谢和高温胁迫
由于溫室效应对植物的影响越来越明显,植物在生长过程中耐高温的能力显得尤为重要。高温胁迫不仅影响开花植物的花药温度感应并诱导减数分裂Ⅱ末期纺锤体定向错误,绒毡层细胞内的粗面内质网的形态结构出现缺陷,造成小孢子营养不良(张在宝等,2019)。同时,也会改变植物体活性氧 (ROS) 稳态和激素的代谢水平,并干扰热激蛋白的一系列信号调控等网络。
有关氮代谢对植物抗高温的研究甚少,有学者在研究高温胁迫和氮代谢的关系时发现,在小麦(Zahedi et al., 2004)、大麦(Hordeum vulgare)(Passarella et al., 2008)和玉米(Ordonez et al., 2015)中,氮素的施加加剧了高温胁迫对植株的损伤程度,从而导致产量降低。但是,由于先前的研究对环境条件的控制不严谨,所以在Ordonez的实验设计中,最高温度超过40 ℃,这在自然条件下很难达到。因此,有研究者对Ordonez的实验进行改进,发现适量施加氮肥可以缓解高温胁迫对玉米产量的损失,但温度过高时施加氮肥则加剧高温对植物的损伤,特别是在玉米籽粒灌浆后期,施加氮素显著降低了叶片的电导率和丙二醛含量,提高了光合速率和产量(Yan et al., 2017)。这说明氮代谢和高温胁迫之间存在着一定的交互效应,氮肥的施加促进了植株对氮素的吸收和蔗糖合成相关酶的活性。
高温胁迫对植物造成的损伤机理类似于旱、盐胁迫,因此氮代谢在耐旱、盐胁迫中的作用(如氮代谢关键酶及含氮化合物在离子毒害、渗透调节、抗氧化和光合系统中的调节作用等)在耐高温中同样有效。
2.4 氮代谢与其他胁迫
其他的一些非生物胁迫如镉胁迫、淹水胁迫和营养胁迫等都会影响植物的生长发育,如改变体内激素平衡、过氧化损伤、光合作用下降、物质合成受阻、植物养分供应不足、代谢酶活性改变、细胞膜完整性和蛋白质结构破坏等。
Yu et al.(2014)研究证实,土壤中适量施加硝态氮能显著提高植株的农艺性状和根系活性。低氧胁迫下,NR活性增高,NiR活性降低,导致植物体内亚硝酸盐积累,而低氧胁迫下硝酸盐对植物的有益作用可能是通过微量亚硝酸盐发挥作用的,因为它与细胞内pH的调节、NO信号级联反应和NAD(P)+的再生密切相关(Limami et al., 2014)。此外,NiR有助于大肠杆菌在无氧条件下的发酵氨化作用,使葡萄糖趋向于生成性价比更高的甲酸盐和乙酸盐,减少乙醇的合成(Wang et al., 2018)。在大豆中发现,添加亚硝酸盐后大豆根部在低氧环境下乙醇含量下降。因此,认为NiR在植物缺氧时也发挥同样作用(Oliveira et al., 2013)。由上可知,NiR通过调节亚硝酸盐积累影响了葡萄糖的分解方向,使能量达到更高效的利用,在耐受低氧胁迫中发挥重要作用。
在非生物胁迫中,含氮化合物在抗逆境中的作用不可或缺。如亚精胺可以有效缓解低温胁迫对甜瓜(Cumumis melo)幼苗的损伤,提高超氧化物歧化酶、过氧化物酶和过氧化氢酶的活性,减少O-2、丙二醛(MDA)和H2O2的含量,降低质膜透性(张永平等,2017)。NRT1.1作为生长素和硝酸盐的双重转运载体,它可以根据土壤中硝酸盐的浓度调节生长素的分布,进而调节侧根的生长,提高植物对环境中不同营养水平的适应(Krouk et al., 2010);此外,NRT1.1还是一种双亲和转运蛋白,作为硝酸盐信号感受器,调节植物体内低水平和高水平的硝酸盐初级响应水平(Ho et al., 2009)。目前,关于NH+4转运蛋白在植物抗逆境中的作用未见报道。因此,氮素的分配机制能根据当前植物面临的环境胁迫调节含氮化合物的合成,这对于提高植物的抗逆性具有调节作用。胁迫蛋白在抗逆境中的作用也日渐被重视,其在感受胁迫信号、启动各种非生物胁迫响应中起到了极其重要的作用。
3 总结与展望
综上所述,氮代谢对不同植物生长的调节作用存在很大差异,主要取决于根部氮素形态、浓度以及植物种类(Ashraf et al., 2018)。氮代谢参与植物逆境抵抗的过程包括氮素的吸收、硝酸盐同化、铵同化和氨基酸代谢。生理机制主要涉及到调节离子的吸收、转运和分布,调节酶的活性,维持激素平衡和细胞代谢,稳定细胞形态和蛋白质结构,清除体内ROS和优化氮素分配机制等来提高植物抵抗非生物胁迫的能力。这已在多种陆生植物如小麦、水稻、玉米、桑树、大豆中得到证明,但在水生植物中的研究尚未见报道。
目前,氮素对植物形态、生理和分子水平的胁迫响应机制已取得重大进步,而氮代谢对胁迫的响应机制研究却还在初级阶段,研究内容多停留在对现象的描述。含氮化合物(特别是脯氨酸)在植物抗逆境中的生理作用已普遍被认同,而针对氮代谢参与植物抗逆境的研究却比较零散,且多局限于氮素吸收层面,对于氮素同化过程参与植物逆境抵抗的研究也仅限于酶活改变,有关其信号转导、基因表达调控和蛋白质互作的研究未见报道。
氮代谢与植物抗逆性的关系复杂,涉及多个基因和酶的参与,由多条途径共同完成。针对当前存在的问题,对未来的研究提出如下建议,即进一步挖掘新的抗逆基因,探寻基因的表达模式并筛选下游基因;利用当代蛋白质组学、代谢组学及基因工程发展的优势,研究植物抗逆相关的转录因子调节和信号感受、传导和适应机理。此外,氮代谢在植物不同生命周期的抗逆机制还存在差异,应对种子萌发期、幼苗期及生殖期的抗逆性进行全面的研究,综合分析植物的胁迫响应机制。
总之,基于氮代谢在植物抗逆境中的作用比较复杂,只有从整体上把握氮代谢对植物抗逆境的作用机理才具有指导意义和实用价值,这对于利用分子遗传育种手段提高作物氮素利用效率、提升作物品质和抗胁迫能力具有重要意义。
参考文献:
ASHRAF M, SHAHZAD SM, IMTIAZ M, et al., 2018. Nitrogen nutrition and adaptation of glycophytes to saline environment: A review [J]. Arch Agron Soil Sci, 64(9): 1181-1206.
AVERINA NG, BEYZAEI Z, SHCHERBAKOV RA, et al., 2014. Role of nitrogen metabolism in the development of salt tolerance in barley plants [J]. Russ J Plant Physiol-engltr, 61(1): 97-104.
BRUGIERE N, LIMAMI A, LELANDAIS MY, et al., 1999. Glutmine synthetase in the phloem plays a major role in controlling praline production [J]. Plant Cell, 11(10): 1995-2011.
CHOW F, 2012. Nitrate Assimilation: The role of in vitro nitrate reductase assay as nutritional predictor [M]//Applied Photosynthesis. Rijeka: InTech, 105-120.
DE SOUZA MIRANDA R, GOMES-FILHO E, PRISCO JT, et al., 2016. Ammonium improves tolerance to salinity stress in Sorghum bicolor plants [J]. Plant Growth Regul, 78(1): 121-131.
DEL CASTELLO F, NEJAMKIN A, CASSIA R, et al., 2019. The era of nitric oxide in plant biology: Twenty years tying up loose ends [J]. Nitric Oxide, 85: 17-27.
ESMAILI E, KAPOURCHAL SA, MALAKOUTI MJ, et al., 2008. Iteractive effect of salinity and two nitrogen fertilizers on growth and composition of sorghum [J]. Plant Soil Environ, 54 (12): 537-546.
FONTAINE J, TERCé-LAFORGUE T, ARMENGAUD P, et al., 2012. Characterization of a NADH-Dependent glutamate dehydrogenase mutant of Arabidopsis demonstrates the key role of this enzyme in root carbon and nitrogen metabolism [J]. Plant Cell, 24(10): 4044-4065.
GAO L, LIU M, WANG M, et al., 2016. Enhanced salt tolerance under nitrate nutrition is associated with apoplast Na+ content in canola (Brassica napus L.) and rice (Oryza sativa L.) Plants [J]. Plant Cell Physiol, 57(11): 2323-2333.
GLEVAREC G, BOUTON S, JASPARD E, et al., 2004. Respective roles of the glutamine synthetase/glutamate synthase cycle and glutamate dehydrogenase in ammonium and amino acid metabolism during germination and post-germinative growth in the model legume Medicago truncatula [J]. Planta, 219(2): 286-297.
HO CH, LIN SH, HU HC, et al., 2009. CHL1 functions as a nitrate sensor in plants [J]. Cell, 138(6): 1184-1194.
IQBAL N, UMAR S, KHAN NA, 2015. Nitrogen availability regulates proline and ethylene production and alleviates salinity stress in mustard (Brassica juncea) [J]. J Plant Physiol, 178: 84-91.
JAMES D, BORPHUKAN B, FARTYAL D, et al., 2018. Concurrent overexpression of OsGS1;1 and OsGS2 Genes in transgenic rice (Oryza sativa L.): Impact on tolerance to abiotic stresses [J]. Front Plant Sci, 9: 786-804.
KHOSHBAKHT D, ASGHARI MR, HAGHIGHI M, 2018. Influence of foliar application of polyamines on growth, gas-exchange characteristics, and chlorophyll fluorescence in Bakraii citrus under saline conditions [J]. Photosynthetica, 56(2): 731-742.
KROUK G, LACOMBE B, BIELACH A, et al., 2010. Nitrate-regulated auxin transport by NRT1.1 defines a mechanism for nutrient sensing in plants [J]. Dev Cell, 18(6): 927-937.
LASA B, FRECHILLA S, APARICIO-TEJO PM, et al., 2002. Role of glutamate dehydrogenase and phosphoenolpyruvate carboxylase activity in ammonium nutrition tolerance in roots [J]. Plant Physiol Biochem, 40(11): 969-976.
LAWLOR DW, 2002. Carbon and nitrogen assimilation in relation to yield: Mechanisms are the key to understanding production systems [J]. J Exp Bot, 53(370): 773-787.
LIMAMI AM, DIAB H, LOTHIER J, 2014. Nitrogen metabolism in plants under low oxygen stress [J]. Planta, 239(3): 531-541.
LIU L, WANG J, HAN Z, et al., 2016. Molecular analyses of tomato GS, GOGAT and GDH gene families and their response to abiotic stresses [J]. Acta Physiol Plant, 38(9): 229-242.
L X, YU P, DENG W, et al., 2018. Transcriptomic analysis reveals the molecular adaptation to NaCl stress in Zostera marina L. [J]. Plant Physiol Biochem, 130: 61-68.
MANSOUR M, 2000. Nitrogen containing compounds and adaptation of plants to salinity stress [J]. Biol Plant, 43(4): 491-500.
MASCLAUX-DAUBRESSE C, REISDORF-CREN M, PAGEAU K, et al., 2006. Glutamine synthetase-glutamate synthase pathway and glutamate dehydrogenase play distinct roles in the sink-source nitrogen cycle in tobacco [J]. Plant Physiol, 140(2): 444-456.
OLIVEIRA HC, SALGADO I, SODEK L, 2013. Involvement of nitrite in the nitrate-mediated modulation of fermentative metabolism and nitric oxide production of soybean roots during hypoxia [J]. Planta, 237(1): 255-264.
ORDONEZ RA, SAVIN R, MARIANO COSSANI C, et al., 2015. Yield response to heat stress as affected by nitrogen availability in maize [J]. Field Crop Res, 183: 184-203.
OZAWA K, KAWAHIGASHI H, 2006. Positional cloning of the nitrite reductase gene associated with good growth and regeneration ability of calli and establishment of a new selection system for Agrobacterium-mediated transformation in rice (Oryza sativa L.) [J]. Plant Sci, 170(2): 384-393.
PASSARELLA VS, SAVIN R, SLAFER GA, 2008. Are temperature effects on weight and quality of barley grains modified by resource availability? [J]. Aust J Agric Res, 59(6): 510-516.
ROBERTSON GP, VITOUSEK PM, 2009. Nitrogen in agriculture: Balancing the cost of an essential resource [M]//Annual review of environment and resources. Palo Alto: Annual Reviews, 34(34): 97-125.
SINGH VP, SINGH M, PRASAD SM, 2016. Responses of photosynthesis, nitrogen and proline metabolism to salinity stress in Solanum lycopersicum under different levels of nitrogen supplementation [J]. Plant Physiol Biochem, 109: 72-83.
SKOPELITIS DS, PARANYCHIANAKIS NV, PASCHALIDIS KA, et al., 2006. Abiotic stress generates ROS that signal expression of anionic glutamate dehydrogenases to form glutamate for proline synthesis in tobacco and grapevine [J]. Plant Cell, 18(10): 2767-2781.
SPERANDIO MVL, SANTOS LA, BUCHER CA, et al., 2011. Isoforms of plasma membrane H+-ATPase in rice root and shoot are differentially induced by starvation and resupply of NO-3 or NH+4 [J]. Plant Sci, 180(2): 251-258.
SURABHI G, REDDY AM, KUMARI GJ, et al., 2008. Modulations in key enzymes of nitrogen metabolism in two high yielding genotypes of mulberry (Morus alba L.) with differential sensitivity to salt stress [J]. Environ Exp Bot, 64(2): 171-179.
TERCE-LAFORGUE T, CLEMENT G, MARCHI L, et al., 2015. Resolving the role of plant NAD-Glutamate dehydrogenase: III. Overexpressing individually or simultaneously the two enzyme subunits under salt stress induces changes in the leaf metabolic profile and increases plant biomass production [J]. Plant Cell Physiol, 56(10): 1918-1929.
WANG X, HU HL, HU TX, et al., 2018. Effects of drought stress on the osmotic adjustment and active oxygen metabolism of Phoebe zhennan seedlings and its alleviation by nitrogen application [J]. Chin J Appl Ecol, 42(2): 240-251. [王曦, 胡紅玲, 胡庭兴, 等, 2018. 干旱胁迫对桢楠幼树渗透调节与活性氧代谢的影响及施氮的缓解效应 [J]. 植物生态学报, 42(2): 240-251.]
WANG X, TAMIEV D, ALAGURAJAN J, et al., 2018. The role of the NADH-dependent nitrite reductase, Nir, from Escherichia coli in fermentative ammonification [J]. Arch Microbiol, https://doi.org/10.1007/s00203-018-1590-3.
WANG XB, 2018. Effects of nitrogen on drought tolerance in different genotypes of wheat at seedling stage under drought stress [D]. Yangling: Research Center of Soil and Water Conservation and Ecological Environment, Chinese Academy of Sciences and Ministry of Education. [王秀波, 2018. 干旱下氮素营养对不同穗型小麦苗期耐旱性的影响机制 [D]. 杨凌:中国科学院(教育部水土保持与生态环境研究中心).]
XIONG BS, 2016. Effects of nitrogen on leaf senescence of maize (Zea mays L.)and carbon/nitrogen balance under drought stress [D]. Yangling: Research Center of Soil and Water Conservation and Ecological Environment, Chinese Academy of Sciences and Ministry of Education. [熊炳霖, 2016. 干旱胁迫下氮素对玉米叶片衰老和叶片碳氮平衡的影响 [D]. 杨凌:中国科学院(教育部水土保持与生态环境研究中心).]
XIONG D, YU T, LIU X, et al., 2015. Heterogeneity of photosynthesis within leaves is associated with alteration of leaf structural features and leaf N content per leaf area in rice [J]. Funct Plant Biol, 42(7): 687-696.
YAN P, CHEN Y, DADOUMA A, et al., 2017. Effect of nitrogen regimes on narrowing the magnitude of maize yield penalty caused by high temperature stress in North China Plain [J]. Plant Soil Environ, 63(3): 131-138.
YANG HB, 2013. Effects of osmotic and salt stress on nitrate reductase and nitrite reductase activities of buckwheat [J]. Crops, (3): 53-55. [杨洪兵, 2013. 渗透胁迫和盐胁迫对荞麦硝酸还原酶及亚硝酸还原酶活性的影响 [J]. 作物杂志,(3):53-55.]
YI X, ZHANG Y, YAO H, et al., 2014. Alternative electron sinks are crucial for conferring photoprotection in field-grown cotton under water deficit during flowering and boll setting stages [J]. Funct Plant Biol, 41(7): 737-747.
YU C, XIE Y, HOU J, et al., 2014. Response of nitrate metabolism in seedlings of oilseed rape (Brassica napus L.) to low oxygen stress [J]. J Integr Agric, 13(11): 2416-2423.
ZAHEDI M, MCDONALD G, JENNER CF, 2004. Nitrogen supply to the grain modifies the effects of temperature on starch and protein accumulation during grain filling in wheat [J]. Aust J Agric Res, 55(5): 551-564.
ZHANG Y, WANG Y, SA G, et al., 2017. Populus euphratica J3 mediates root K+/Na+ homeostasis by activating plasma membrane H+-ATPase in transgenic Arabidopsis under NaCl salinity [J]. Plant Cell Tiss Organ Cult, 131(1): 75-88.
ZHANG YP, XU S, YANG SJ, et al., 2017. Effect of exogenous spermidine on the growth and antioxidant system of melon seedlings under low temperature stress [J]. Plant Physiol J, 53(6): 1087-1096. [張永平, 许爽, 杨少军, 等, 2017. 外源亚精胺对低温胁迫下甜瓜幼苗生长和抗氧化系统的影响 [J]. 植物生理学报, 53(6):1087-1096.]
ZHANG ZB, HU MH, WEN J, et al., 2019. The effects of heat stress on anther development and signal transduction networks [J]. J Biol, 36(1): 92-95. [张在宝,胡梦辉,闻洁,等, 2019. 高温胁迫对花药发育的影响及信号传导网络 [J]. 生物学杂志, 36(1): 92-95.]
ZHONG C, CAO X, BAI Z, et al., 2018. Nitrogen metabolism correlates with the acclimation of photosynthesis to short-term water stress in rice (Oryza sativa L.) [J]. Plant Physiol Biochem, 125: 52-62.
ZHONG C, CAO X, HU J, et al., 2017. Nitrogen metabolism in adaptation of photosynthesis to water stress in rice grown under different nitrogen levels [J]. Front Plant Sci, 8: 1079-1093.
(责任编辑 蒋巧媛)
