杭白芷根中分泌道发生方式、分布及其挥发油积累过程研究
2020-05-26李博园王娟高静陈旋勐陈莹
李博园 王娟 高静 陈旋勐 陈莹

摘 要: 为探明杭白芷(Angelica dahurica var. formosana)根中分泌道发生方式、分布及其揮发油转运积累特征,该研究利用光镜及透射电子显微镜技术观察分泌道发生过程及挥发油转运特征,结合组织化学定位确定挥发油的主要积累部位。结果表明:杭白芷根中分泌道由中柱鞘细胞最先发生,次生结构中分泌道主要分布在韧皮部和皮层中;挥发油的合成不仅与分泌细胞中质体及细胞质有关,而且还与周围细胞关系密切;分泌细胞内高尔基体和内质网丰富,可能先通过形成小泡参与转运,再经由细胞壁向腔道内转移;相邻分泌细胞靠近角隅处的细胞壁分泌活动活跃,腔道内积累大量电子致密物质;成熟分泌道中分泌细胞及其腔道内积累大量油滴,因此挥发油主要积累场所为分泌细胞及其腔道。该研究明确了杭白芷根中分泌道的发生方式、分布及其挥发油积累部位,揭示了分泌道发育过程中挥发油的转运积累特征,为进一步阐明分泌组织生长发育与有效成分积累关系提供了理论依据。
关键词: 杭白芷, 分泌道, 挥发油, 发生方式, 积累
中图分类号: Q945.12 文献标识码: A
文章编号: 1000-3142(2020)04-0471-11
Abstract: In order to explore the occurrence and distribution of secretory canals and the characteristics of transport and accumulation of essential oil in root of Angelica dahurica var. formosana, the occurrence process and transport characte-ristics of essential oil were observed by light microscope and transmission electron microscope. And the accumulation sites of the essential oil were also discussed with histochemical analysis. The results were as follows: The secretory canals in the root of A. dahurica var. formosana was first to occur in pericycle, and the secretory canals in the secondary structure were mainly distributed in phloem and cortex; The biosynthesis of essential oil is not only related to plasmid and cytoplasm of secretory cells, but also may be closely related to surrounding cells; There were abundant golgi apparatus and endoplasmic reticulum in secretory cells, which may participate in transport through the formation of vesicles, and then transfer to the lumen through the cell wall; The secretory activity of secretory cells was active near the corner of the adjacent secretory cell wall, then the electron dense material was accumulated into the lumen; At the mature stage of secretory canals, a large of number oil droplets in secretory cells and lumen, so we believe that the main accumulation sites of essential oil are secretory cells and lumen. This study clarified the occurrence, distribution and essential oil accumulation position of the secretory canals in the root of A. dahurica var. formosana, and revealed the characteristics of transport and accumulation of essential oil during the development of the secretory canals. This study provides a detailed theoretical information for further elucidating the relationship between the growth and development of secretory tissue and the accumulation of effective components.
Key words: Angelica dahurica var. formosana, secretory canal, essential oil, occurrence, accumulation
中药白芷为伞形科(Umbelliferae)植物白芷(Angelica dahurica)或杭白芷(Angelica dahurica var. formosana)的干燥根,始载于《神农本草经》,《中华人民共和国药典》2015版一部收载(国家药典委员会,2015)。中药白芷气芳香,味辛、微苦,归胃、大肠、肺经,具有解表散寒、祛风止痛、宣通鼻窍、燥湿止带、消肿排脓等功效(何开家和张涵庆,2008;朱艺欣等,2014)。关于白芷化学成分及药理作用(周爱德等,2010;马俊等,2018)等方面已经有了较多的报道,其根中化学成分主要包含香豆素类、挥发油类以及黄酮类等,其中挥发油类化学成分具有抑制黑色素、抗氧化、镇痛、抗过敏、抗惊厥、抗痉挛等药理作用,是白芷主要药效物质基础之一(聂红等,2002)。
目前,有关药用植物生长发育与有效成分积累关系已有较多研究。研究表明中国肉桂植物体内油细胞的结构发育过程影响精油的积累,油细胞的分布密度和发育过程对精油有显著影响(Li et al., 2013, 2016);对分泌囊发育过程研究也表明,挥发油合成积累与其裂溶生型发生方式关系密切(Liang et al., 2006;Liu et al., 2012;Zheng et al., 2014)。傘形科植物大多具有分泌道(Fahn,2010;宋丽敏等,2016),之前的研究表明北柴胡分泌道挥发油主要是以胞吐被排入分泌道的腔道并积累(Cai et al., 2008),杭白芷根中挥发油主要积累部位为裂生型分泌道腔道,挥发油合成与分泌细胞内质体和细胞质关系密切,分泌道主要分布在皮层和次生韧皮部中(兰志琼等,2012;陈莹等,2015)。然而,杭白芷根中裂生型分泌道究竟如何发生,其发育过程中挥发油如何转运并积累,分泌细胞与周围细胞的关系如何,目前尚不清楚。因此,本研究通过组织化学定位结合显微、超微技术对不同发育时期杭白芷根中分泌道发生的显微、超微特征及挥发油变化进行细致的观察,旨在揭示分泌道发生及其发育过程中挥发油的转运积累特征,为进一步了解分泌道与挥发油转运积累关系奠定基础。
1 材料与方法
1.1 植物材料
2018年3月—9月采集陕西中医药大学药用植物园不同发育时期的杭白芷根作为实验材料,经陕西中医药大学标本馆王继涛高级实验师鉴定为杭白芷(Angelica dahurica var. formosana)。
1.2 方法
1.2.1 冰冻切片法 取新鲜杭白芷主根,Leica CM 1860冰冻切片机切片,厚度为40~60 μm,待组织化学染色使用。
1.2.2 石蜡切片法 将不同发育时期杭白芷根分割成0.5~1 cm的小段,70%FAA固定3~5 d,梯度酒精脱水,石蜡包埋,Leica RM 2335切片机切片,厚度10~12 μm,番红固绿染色,中性树胶封片,Leica DMBL显微镜观察并拍照。
1.2.3 半薄切片 将不同发育时期杭白芷根切成2~3 mm的小块,首先用2.5%的戊二醛固定液(pH=7.0的磷酸缓冲液配制)预固定24 h(4 ℃),然后用磷酸缓冲液漂洗3 次,每次20 min,0.5%的锇酸(pH=7.0的磷酸缓冲液配制)固定2 h,再用磷酸缓冲液漂洗3次,每次20 min,梯度酒精脱水(30%、50%、70%各一次,90%两次,100%三次,每次20 min),环氧丙烷过渡,Epon 812包埋剂包埋,60 ℃烘箱过夜,最后用Leica EM UC7 超薄切片机切片,切片厚度为1~2 μm,甲苯胺蓝染色后,Leica ICC50 W显微镜观察并拍照。
1.2.4 透射电子显微镜 上述材料经Leica EM UC7 超薄切片机切片,厚度为60~80 nm,经醋酸双氧铀和柠檬酸铅双重染色,日立透射电子显微镜 H-7650观察并拍照。
1.2.5 组织化学染色 挥发油显色反应:取冰冻组织切片,苏丹Ⅲ染色封片,Leica DMBL显微镜观察拍照,取半薄切片,用苏丹黑B饱和溶液染色封片,Leica DMBL显微镜观察拍照;淀粉显色反应:取石蜡切片和冰冻组织切片,分别用碘液染色封片,Leica DMBL显微镜观察拍照。
1.2.6 模式示意图制作方法 使用ChemBioDraw制作分泌细胞、周围细胞以及腔道挥发油转运模式示意图。
2 结果与分析
2.1 杭白芷根中分泌道发生及分布特征
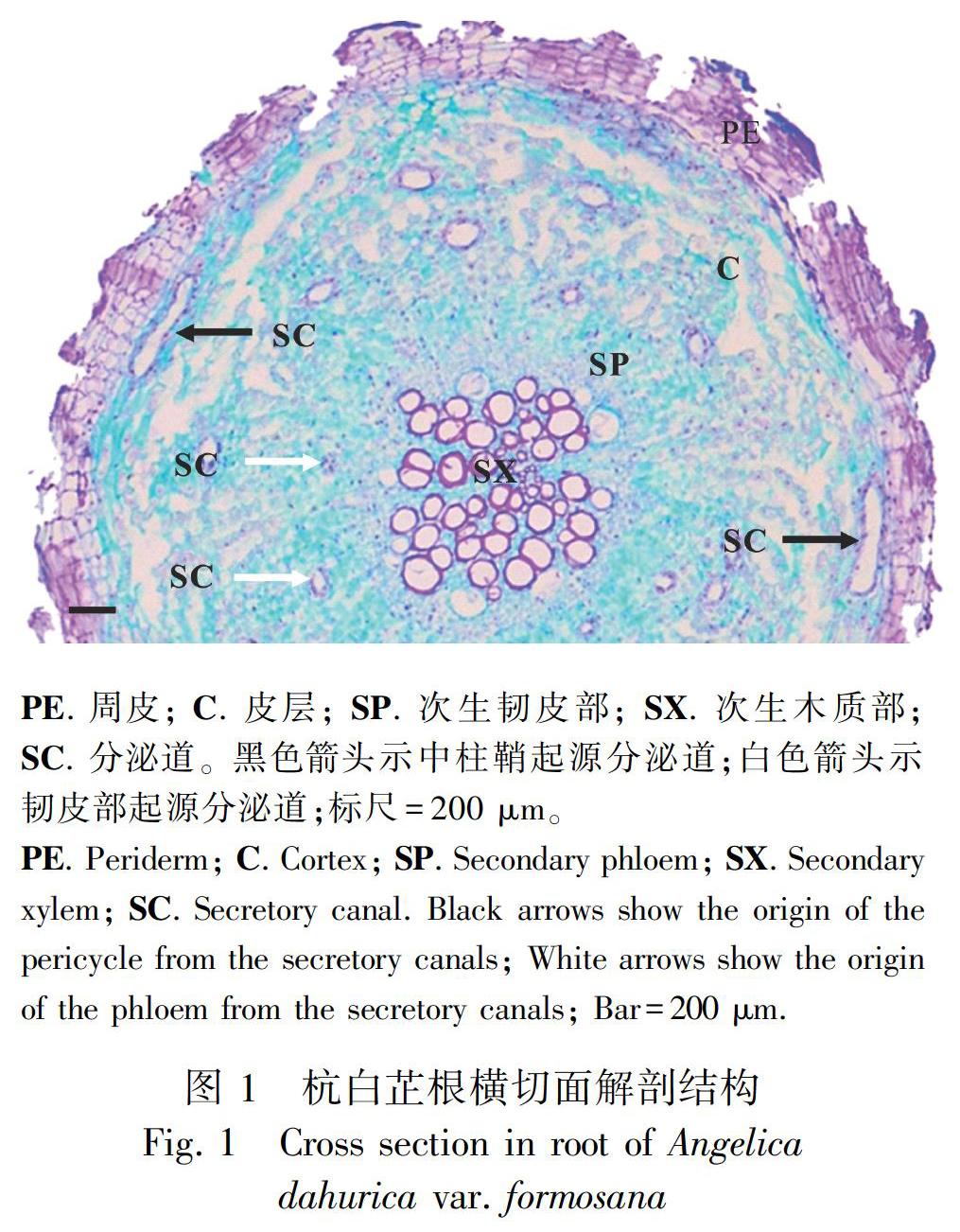
杭白芷根次生结构类似于多年生草本双子叶植物根的特点,由外向内依次包括周皮、皮层、次生韧皮部、次生木质部。根中分泌道由中柱鞘细胞最先发生,次生结构中分泌道主要分布在韧皮部和皮层中,属于次生分泌组织。成熟分泌道由5~12个分泌细胞围绕较大的腔道组成,按照分泌道的起源将分布在皮层中的分泌道称为中柱鞘起源分泌道,次生韧皮部中的分泌道称为韧皮部起源分泌道,如图1所示。
PE. 周皮; C. 皮层; SP. 次生韧皮部; SX. 次生木质部; SC. 分泌道。黑色箭头示中柱鞘起源分泌道;白色箭头示韧皮部起源分泌道;标尺=200 μm。
根中分泌道由中柱鞘细胞最先发生,在中柱鞘中出现1个原始细胞,原始细胞体积较小,形态完整规则(图版Ⅰ:1)。随后原始细胞与邻近的细胞之间出现小腔隙,由这3~4个细胞即分泌细胞围绕形成分泌道,此时分泌细胞体积增大,呈多边形(图版Ⅰ:2,3),分泌细胞周围的细胞内可见少量的淀粉粒。随着分泌细胞进一步分裂及邻近细胞插入,细胞数量增加,腔道也随之增大(图版Ⅰ:4),此时周围细胞内的淀粉粒数量也明显增加。之后,分泌细胞趋于扁平状,围绕着较大的椭圆形腔道(图版Ⅰ:5),周围细胞内充满大量淀粉粒,而分泌细胞内始终未见淀粉粒分布。随着根的次生生长不断进行,维管形成层的活动明显,在韧皮部细胞中,可见3~4个相邻细胞的细胞壁变形、分离,形成小腔隙(图版Ⅰ:6),之后,由4~5个分泌细胞围绕的腔隙进一步增大(图版Ⅰ:7),随后分泌细胞趋于扁平,腔道扩大(图版Ⅰ:8),同样,韧皮部分泌细胞周围的细胞内也具丰富的淀粉粒。1-9. 半薄切片; 1-5. 根中中柱鞘起源的分泌道发育; 6-8. 根中韧皮部起源的分泌道发育。1. 中柱鞘起源的原始细胞(黑色虚线圆圈); 2. 分泌道形成小的腔隙(黑色虚线圆圈); 3. 分泌道(黑色虚线圆圈)邻近细胞的插入(白色箭头); 4. 分泌道(黑色虚线圆圈)腔道增大,分泌细胞分裂(黑色箭头)及邻近细胞插入(白色箭头); 5. 皮层内成熟的分泌道(黑色箭头); 6. 次生韧皮部中早期分泌道(黑色虚线圆圈); 7. 分泌道腔道增大(黑色虚线圆圈); 8. 次生韧皮部中成熟的分泌道(黑色虚线圆圈); 9. 相邻分泌道之间联通形成大的分泌道(黑色箭头); 标尺=12 μm。
此时,在皮层和次生韧皮部中都存在邻近两个或多个分泌道彼此联通形成一个大的分泌道的现象(图版Ⅰ:9)。在成熟根的横切面上,分泌道呈多轮排列,中柱鞘起源的分泌道位于皮层,靠近周皮,呈间隔均匀的一圈排列,腔道较大,韧皮部起源的分泌道位于次生韧皮部,靠近中心,二到三圈排列,腔道较小(图1)。
2.2 杭白芷根中分泌道的组织化学定位
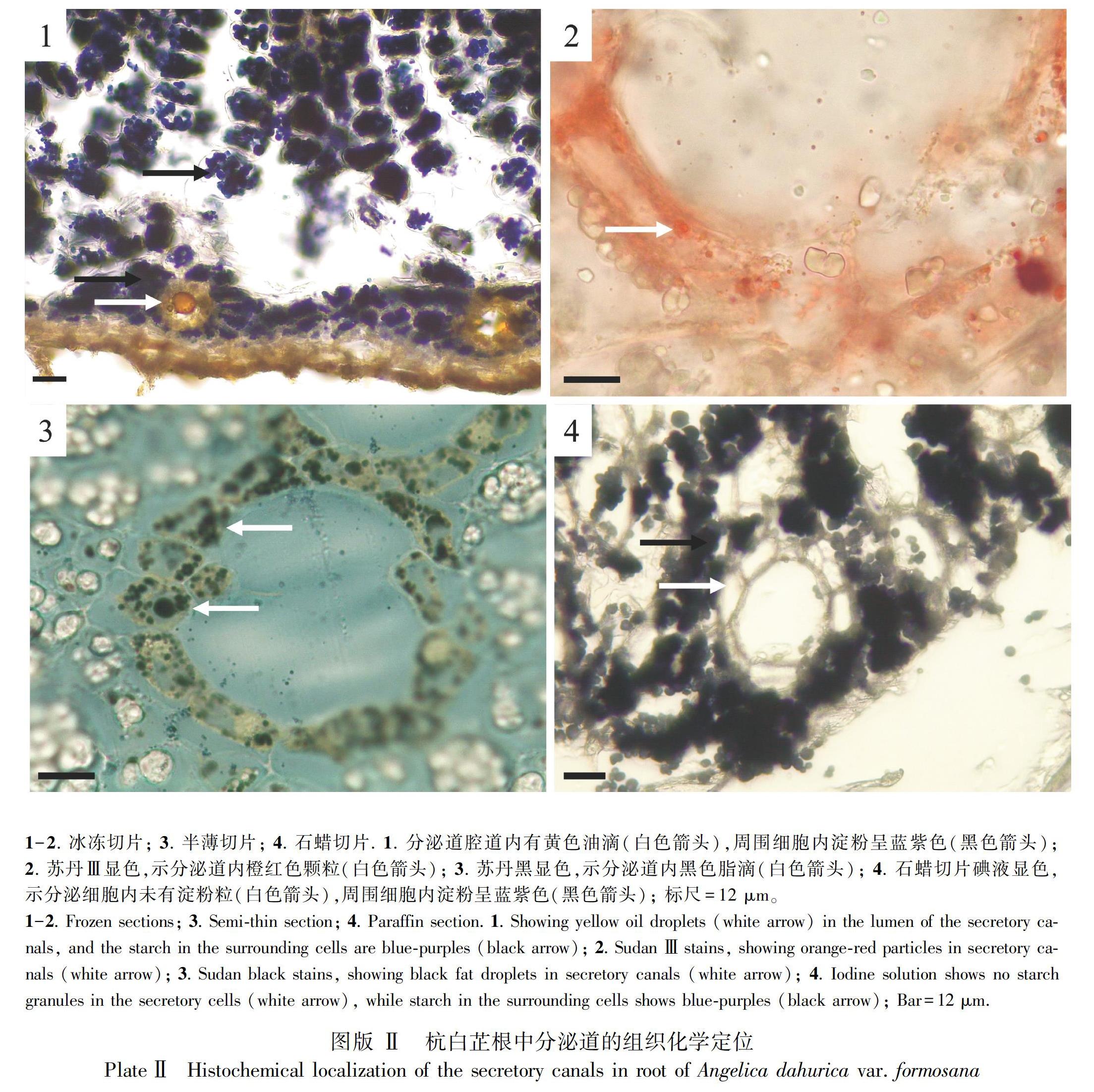
在新鲜材料冰冻切片中可见分泌道的分泌细胞和腔道内均有明显的黄色油状物质存在(图版Ⅱ:1);分泌细胞与苏丹Ⅲ反应被染成橙红色,在分泌细胞内可见较多的橙红色颗粒物(图版Ⅱ:2);同时运用苏丹黑B可进一步确定,老根中发育至成熟的分泌细胞内和腔道内可见大量的黑色脂滴(图版Ⅱ:3)。新鲜材料冰冻切片与石蜡切片通过碘液染色可以看出,分泌道的分泌细胞内不含蓝紫色物质,而周围细胞内具有大量的蓝紫色物质(图版Ⅱ:1,4)。
2.3 杭白芷根中分泌道发生过程中挥发油的变化特点
次生生长开始以后,在韧皮部中观察到分泌道原始细胞,其细胞形态规则,体积较小,细胞质浓厚(图版Ⅲ:1),质体中可见黑色嗜锇滴(图版Ⅲ:2)。之后相邻的原始细胞细胞壁之间逐渐分离形成小的腔道,随着分泌道的发育, 腔道不断增1. 分泌道原始细胞; 2. 分泌细胞内质体、灰色嗜锇物质以及质体内黑色嗜锇滴(黑色箭头); 3. 分泌道及其腔道; 4. 分泌细胞内灰色嗜锇物质(白色箭头); 5. 质体内黑色嗜锇滴(黑色箭头)及透明小泡(星号); 6. 质体内黑色嗜锇滴(黑色箭头); 7. 质体内灰色嗜锇物质; 8. 高尔基体、线粒体以及内质网,可见细胞壁膨松(三角形); 9. 分泌细胞间胞间连丝(黑色粗箭头),附近可见内质网及高尔基体。CW. 细胞壁; ER. 内质网; G. 高尔基体; OD. 嗜锇滴; P. 质体; L. 腔道; M. 线粒体; N. 细胞核; V. 液泡。下同。
大而变得明显,小液泡逐渐融合形成大液泡,分泌细胞体积增大(图版Ⅲ:3,4),细胞质内灰色的嗜锇物质数量显著增加,液泡内可见浅灰色嗜锇物质(图版Ⅲ:4),此时,质体数量也明显增加,形状大小不一,质体中黑色嗜锇滴数量较多(图版Ⅲ:5,6),还可见一些质体基质中充满灰色嗜锇物质(图版Ⅲ:7),在一些质体中可见透明或半透明的小泡(图版Ⅲ:5),质体以及灰色嗜锇物质周围可见内质网及高尔基体(图版Ⅲ:5,7,8)。相邻的分泌细胞间具胞间连丝,胞间连丝处可见高尔基体以及膨大的内质网短管(图版Ⅲ:9),质膜处可见小泡,这些小泡大多数包裹着电子致密物质,有的小泡与质膜融合,向细胞壁释放物质(图版Ⅳ:1),相邻分泌细胞靠近腔道角隅处的细胞壁膨松,电子致密物质较深,此时腔道近细胞壁周围有电子致密物质积累(图版Ⅳ:2)。
之后分泌道腔道进一步增大,分泌细胞体积也增大,分泌细胞内观察到大量的质体围绕细胞核形成明显的“质体环”(图版Ⅳ:3,4),质体内黑色嗜锇滴数量较多,透明小泡或半透明小泡体积增大、数量增加(图版Ⅳ:4),还有一些小泡分布在质体周围,质体基质电子密度降低,边缘模糊,出现局部降解的现象(图版Ⅳ:5),此时,液泡占据了细胞较大的体积,细胞质内灰色嗜锇物质数量减少,液泡内仍可见灰色嗜锇物质(图版Ⅳ:3,4),其他细胞器被大液泡挤到细胞壁附近(图版Ⅳ:3),另外还可见质膜附近有丰富的小泡分布,进一步与质膜融合释放物质,细胞壁更加膨松,腔道内有较多的电子致密物质积累(图版Ⅳ:6)。
在分泌道发育的后期,韧皮部中成熟的分泌道由一层扁平的分泌细胞围绕着大的椭圆形腔道构成。此时,液泡占据的细胞大部分的体积,细胞核畸形,细胞质电子密度深,仍具一些灰色嗜锇物质(图版Ⅴ:1,2),细胞质内还可见一些黑色嗜锇团块和线粒体(图版Ⅴ:3)。分泌细胞靠近腔道一侧的细胞壁变薄且较为光滑,且电子密度也较深,此时,腔道内具丰富的电子致密物质(图版Ⅴ:1,2)。
同时也观察了在整个发育过程中分泌细胞与周围薄壁组织细胞的关系。在发育早期,周围细胞内淀粉粒物质较少,与原始细胞间胞间连丝并不明显。随着分泌道腔道的形成和扩大,分泌细胞与周围细胞间可见明显的胞间连丝,在周围细胞内靠近胞间连丝处有淀粉粒,及嗜锇物质和质体的分布(图版Ⅴ:4),而分泌细胞内靠近胞间连丝的地方高尔基体明显,高尔基体周围有数量较多的小泡(图版Ⅴ:5),内质网沿细胞壁排列,还可见线粒体(图版Ⅴ:6),随着分泌道发育至成熟期,分泌细胞与周围细胞间并未观察到明显的胞间连丝。
根据以上结果,制作分泌细胞、周围细胞以及腔道挥发油转运示意图,挥发油或其前体物质可能通过与周围细胞间的胞间连丝转运至分泌细胞内(图2: A),分泌细胞内的挥发油物质通过相邻分泌细胞靠近角隅处细胞壁的分泌活动将物质转运到腔道内(图2:B)。
3 讨论
3.1 杭白芷根中分泌道的发生和功能
杭白芷根中的分泌道属于次生分泌道,由中柱鞘细胞和韧皮部细胞先后起源发生。而这两种起源的分泌道细胞发生特点有一些差异。在中柱鞘内发生的分泌道原始细胞在自身分化的过程中同时插入了周围已分化的薄壁细胞, 共同形成未来的分泌细胞,而韧皮部中的分泌道原始细胞团彼此之间相互分离,并未观察到周圍细胞的插入。由于皮层内(即中柱鞘起源的分泌道)的分泌道较先形成,且皮层细胞体积大,排列疏松,细胞间空隙较大,而韧皮部薄壁组织内其他细胞体积较小,排列也更为紧密,因此,最终可见皮层内分泌道直径较大于韧皮部分泌道。
在细胞、一些组织内产生并积累某些次生代谢物来抵御外界环境的现象被称为植物的化学防御,植物的分泌组织可作为重要的防御体系之一(Lincoln & Eduardo,2002;周亚福,2009;Harborne,2010)。大多数伞形科植物的根中都分布有分泌道(Fahn,2010;宋丽敏等,2016),由于根为地下部分,容易受到真菌及昆虫的侵害,而分泌道内积累的挥发油对于真菌有一定毒性,其特殊的气味也可以防止昆虫的侵袭(Corsi & Biasci,1998)。在杭白芷根中分泌道组化定位及超微结构观察可见,分泌细胞及其腔道都是挥发油的积累场所,皮层内的分泌道靠近周皮一圈分布且体积较大,同时,韧皮部分泌道在杭白芷根中呈轮状分布,这些分泌道可能联合周皮共同抵御外源微生物及昆虫的影响。
3.2 杭白芷根中挥发油的合成、积累特点以及转运方式
杭白芷根中分泌细胞内细胞器丰富,质体内可见较多的黑色嗜锇滴及灰色嗜锇物质,细胞质内分布有大量的灰色嗜锇物质,线粒体明显,表明分泌道内挥发油的合成主要与质体以及细胞质关系密切。之前大量研究也认为分泌细胞中质体和细胞质基质都参与了挥发油或其前体物质的合成,例如, 鹅掌楸油细胞发育中质体的变化最为明显,在质体中合成的嗜锇物质,随质体解体进入细胞质中(蔡霞等,2002)。而且,我们发现,在分泌道挥发油合成较为活跃的时期,分泌细胞与周围细胞间具较多的胞间连丝,周围细胞靠近胞间连丝的地方具淀粉粒、灰色嗜锇物质以及质体,分泌细胞内在胞间连丝附近具有膨大的内质网、高尔基体、小泡、线粒体和质体等,质体内可见黑色嗜锇滴。而当分泌道发育至成熟期,挥发油已经大量积累,此时分泌细胞与周围细胞间未观察到胞间连丝。在苦槛蓝的研究中表明挥发油主要储存于茎和叶中的分泌腔,周围的薄壁细胞也参与挥发油的合成,根薄壁细胞中挥发油类物质不明显(白玫等,2015)。因此,我们认为,杭白芷根中挥发油的合成不仅与分泌细胞内质体及细胞质有关,还与周围细胞关系密切,可能是通过胞间连丝这一途径将电子致密物质向分泌细胞内转移,再进一步在分泌细胞内进行合成和积累。同时,在杭白芷根中分泌细胞内还观察到质体内电子透明小泡逐渐增加,这些小泡可能是挥发油被转运以后留下的,这与北柴胡分泌道中的现象类似(Cai et al., 2008)。
前期研究表明杭白芷根中分泌道为裂生型,分泌道腔道是挥发油积累的主要场所(陈莹等,2015)。本研究通过组织化学定位及电镜观察发现,在分泌道发育成熟阶段,杭白芷分泌道腔道及分泌细胞中均有油类物质积累,因此其挥发油积累场所除了分泌道腔道外还应包括分泌细胞。杭白芷分泌道以裂生方式发生,发育过程中分泌细胞始终存在,最终可能作为油类物质的积累场所。
关于挥发油的转运方式一直以来存在不同的观点,例如,内质网参与了鳄梨果实油细胞中油类物质的转运和积累(Platt-Aloia et al., 1983),还有一些研究认为,植物细胞的分泌活动通过颗粒型分泌的形式进行脂类物质的转运等(Fahn & Shimony,1998;Fahn,2010)。在杭白芷根中分泌道的发育中,随着分泌细胞内质体、质体内黑色嗜锇滴以及灰色嗜锇物质数量增加,内质网数量也进一步增加,且大多数分布在质体和灰色的嗜锇物质周围,或沿着细胞壁排列,较短的内质网小管一些会膨胀成小泡。而刘惠纯等(1992)在白芷叶中分泌道的研究中认为内质网也参与了分泌物的合成,而我们在杭白芷根中分泌道的发育中未观察到内质网直接参与合成的证据,而发现其与发育后期分泌细胞内丰富的小泡关系密切,因此推测内质网更多地参与了挥发油的转运。同时,高尔基体数量也较为丰富,可见其两端膨大成小泡。之后,分泌细胞内出现大量小泡,一些包裹电子致密物质的小泡与质膜融合释放物质,此时,分泌细胞靠近腔道一侧及角隅处的细胞壁膨松,且在角隅处有电子致密度物质积累。成熟期分泌道细胞壁光滑,腔道内具有大量的电子致密物质。因此,杭白芷根中分泌道挥发油转运可能通过高尔基体和内质网形成小泡,包裹电子致密物质进一步与质膜融合,再通过相邻分泌细胞靠近角隅处细胞壁的分泌活动将物质转运到腔道内。这与腰果树分泌道中嗜锇物质的转运方式更为相似(吴继林等,2000)。
参考文献:
BAI M, ZHENG P, LI HY, et al., 2015. The relationship between structural characteristic and accumulation of medicinal component in vegetative organs of Myoporum bontioides [J]. J S Chin Agric Univ, 36(6): 104-110. [白玫, 郑萍, 李合英, 等, 2015. 苦檻蓝营养器官的结构特征与有效成分积累关系研究 [J]. 华南农业大学学报, 36(6):104-110.]
CAI X, HU ZH, HE Y, 2002. The relationship between ultrastructure changes and produce of the oil during the oil cell development in Liriodendron chinense [J]. Acta Bot Boreal-Occident Sin, 22(2): 327-332. [蔡霞, 胡正海, 何一, 2002. 鹅掌楸油细胞发育过程中超微结构的变化与挥发油产生的关系 [J]. 西北植物学报, 22(2):327-332.]
CAI X, ZHOU YF, HU ZH, 2008. Ultrastructure and secretion of secretory canals in vegetative organs of Bupleurum chinense DC. [J]. J Mol Cell Biol, 41(2): 96-106.
CHEN Y, HU ZH, HU BX, et al., 2015. Relationship between ultrastructure and secretion of secretory canals in root of Angelica dahurica [J]. Acta Bot Boreal-Occident Sin, 35(4): 716-722. [陈莹, 胡正海, 胡本祥, 等, 2015. 杭白芷根的分泌道超微结构与其挥发油分泌的关系 [J]. 西北植物学报, 35(4):716-722.]
Chinese Pharmacopoeia Commission, 2015. Chinese Pharmacopoeia (Part Ⅰ) [Z]. Beijing: China Medical Science Press: 105-106. [国家药典委员会, 2015. 中华人民共和国药典(一部) [Z]. 北京:中国医药科技出版社: 105-106.]
CORSI G, BIASCI D, 1998. Secretory structures and localization of alkaloids in Conium maculatum L. (Apiaceae) [J]. Ann Bot, 81(1): 157-162.
FAHN A, 2010. Secretory tissues in vascular plants [J]. New Phytol, 108(3): 229-257.
FAHN A, SHIMONY C, 1998. Ultrastructure and secretion of the secretory cells of two species of Fagonia L. (Zygophyllaceae) [J]. Ann Bot, 81(4): 557-565.
FENG CH, SUI CH, WU H, 2007. Synthesizing site and storing position of essential oil in Pogostemon cablin [J]. Chin Trad Herb Drugs, 38(1): 116-119. [冯承浩, 隋春花, 吴鸿, 2007. 广藿香挥发油的合成场所及储存部位研究 [J]. 中草药, 38(1):116-119.]
HE KJ, ZHANG HQ, 2008. Research advances in chemical constituents and pharmacology of Angelica dahurica [J]. Res Pract Chin Med, 22(3): 59-62. [何開家, 张涵庆, 2008. 白芷化学成分及其药理研究进展 [J]. 现代中药研究与实践, 22(3):59-62.]
HARBORNE JB, 2010. Introduction to ecological biochemistry [J]. Biochem Mol Biol Educ, 6(1): 24-24.
LAN ZQ, LU XM, CHEN JL, et al., 2012. The anatomical study on secretory tissue in root and stem of Angelica dahurica [J]. J Chengdu Univ Trad Chin Med, 35(4): 33-35. [兰志琼, 卢先明, 陈继兰, 等, 2012. 白芷根、茎分泌组织的解剖学研究 [J]. 成都中医药大学学报, 35(4):33-35. ]
LI YQ, KONG DX, LIN XM, et al., 2016. Quality evaluation for essential oil of Cinnamomum verum leaves at different growth stages based on GC-MS, FTIR and microscopy [J]. Food Anal Meth, 9: 202-212.
LI YQ, KONG DX, HUANG RS, et al., 2013. Variations in essential oil yields and compositions of Cinnamomum cassia leaves at different developmental stages [J]. Ind Crops Prod, 47: 92-101.
LIANG SJ, WU H, LUN X, et al., 2006. Secretory cavity development and its relationship with the accumulation of essential oil in fruits of Citrus medica L. var. sarcodactylis (Noot.) Swingle [J]. Jintegr Plant Biol, 48(5): 573-583.
LIU PW, LIANG SJ, YAO N, et al., 2012. Programmed cell death of secretory cavity cells in fruits of Citrus grandis cv. tomentosa is associated with activation of caspase 3-like protease [J]. Trees-Struct Funct, 26(6): 1821-1835.
LINCOLN T, EDUARDO Z, 2002. Plant Physiology [M]. 3rd ed. Los Angeles: Sinauer Associates: 283-308.
MA J, CAO Y, CHEN L, et al., 2018. Determination of four coumarins in Angelica dahurica with different grades by UPLC and QAMS [J]. J Chin Med Mat, 41(10): 2372-2376. [马俊, 曹赟, 陈玲, 等, 2018. 基于UPLC及一测多评法测定不同等级白芷药材中4种香豆素类成分 [J]. 中药材, 41(10):2372-2376.]
NIE H, SHEN YJ, WU JM, et al., 2002. Studies on analgesic and sendative effects and physical dependence of essential oil of radix Angelica dahuricae [J]. Trad Chin Drug Res Clin Pharmacol, 13(4): 221-223. [聂红, 沈映君, 吴俊梅, 等, 2002. 白芷挥发油镇痛、镇静作用和身体依赖性研究 [J]. 中药新药与临床药理, 13(4):221-223.]
PLATT-ALOIA KA, OROSS JW, THOMSON WW, 1983. Ultrastructural study of the development of oil cells in the mesocarp of Avocado fruit [J]. Bot Gaz, 144(1): 49-55.
SONG LM, HAN BX, LIANG WX, et al., 2016. Structures of different vegetative organs of Peucedanum praeruptorum dunn and the distribution law of secretory canals in different organs [J]. Acta Bot Boreal-Occident Sin, 36(4): 62-65. [宋丽敏, 韩邦兴, 梁文星, 等, 2016. 白花前胡营养器官结构及其分泌道分布规律的研究 [J]. 西北植物学报, 36(4):62-65.]
WU JL, HAO BZ, TIAN WM, et al., 2000. Ultrastructure of secretory ducts in Anacardium occidentale L [J]. Chin J Trop Crop, 20(1):31-35. [吳继林, 郝秉中, 田维敏, 等, 2000. 腰果树分泌道超微结构的研究 [J]. 热带作物学报, 20(1):31-35.]
ZHENG P, BAI M, CHEN Y, et al., 2014. Programmed cell death of secretory cavity cells of citrus fruits is associated with Ca2+ accumulation in the nucleus [J]. Trees-Struct Funct, 28: 1137-1144.
ZHOU AD, LI Q, LEI HM, et al., 2010. Study on chemical constituents of Angelica dahurica [J]. Chin Trad Herb Drugs, 41(7): 1081-1083. [周爱德, 李强, 雷海民, 等, 2010. 白芷化学成分的研究 [J]. 中草药, 41(7):1081-1083.]
ZHOU YF, 2008. Studies on the comparision of structures and their accumulation of chemical components and the development of secretory canals in six medicinal plants of Bupleurum L. [D]. Xian: Northwest University: 1-95. [周亚福, 2008. 柴胡属种药用植物结构与化学成分积累的比较和分泌道形态发生的研究 [D]. 西安: 西北大学:1-95.]
ZHU YX, LI BL, MA HS, et al., 2014. Research progress of Angelica dahurica for extracting effective components, pharmacological action and clinical application [J]. Chin Med Her, 11(31): 159-162. [朱艺欣, 李宝莉, 马宏胜, 等, 2014. 白芷的有效成分提取、药理作用及临床应用研究进展 [J]. 中国医药导报, 11(31):159-162.]
(责任编辑 周翠鸣)
