高通量测序应用于PCOS患者卵泡液外泌体lncRNA表达谱分析
2020-05-25刘琳王静怡王欣王丽萍张晓梅吕芳
刘琳,王静怡,王欣,王丽萍,张晓梅,吕芳*
(1.扬州大学临床医学院,扬州 225001;2.江苏省苏北人民医院妇产科生殖医学中心,扬州 225001;3.大连医科大学,大连 116044)
多囊卵巢综合征(PCOS)是一种常见的生殖内分泌疾病,影响5%~10%的育龄期妇女[1]。PCOS有遗传倾向性,但发病机制仍不清楚。卵泡发育异常被认为是PCOS的共同特征,约占无排卵性不孕的75%[2]。雌性卵母细胞早在胚胎期就已形成[3-4],而卵泡液是卵母细胞生长过程中直接接触的内部环境。PCOS患者卵泡液中的糖蛋白、乙酸盐、谷氨酰胺和丙氨酸表达异常,会影响卵母细胞的发育[5]。
外泌体是直径为30~100 nm的纳米级脂质包涵体结构,包裹转运多种物质如miRNA和lncRNA(long non-coding RNA)等[6],主要通过细胞间信号转导起作用[7]。体内几乎每种细胞都可以分泌外泌体,这些外泌体会在血液[8]、唾液[9]、卵泡液[10]和人乳[11]等体液中释放,并最终被吞噬。外泌体是细胞间通讯的重要媒介[12-13],可保护信号不被降解[14],并且其所携带的蛋白质和RNA含量可反映原细胞的状态[15]。
长链非编码RNA(lncRNA)是一类长度超过200个核苷酸的转录物,不编码蛋白质,参与细胞分化、发育和遗传调控,包括表观遗传学、转录和转录后调控,在新陈代谢中起着重要作用[16-17]。目前lncRNA在PCOS发病机理中的作用仍知之甚少,本研究通过分离纯化卵泡液外泌体,提取外泌体中RNA进行lncRNAs测序,确定PCOS患者卵泡液外泌体的全基因组lncRNA表达谱,为lncRNA用作生物标志物或潜在的应用奠定基础。
资料与方法
一、研究对象
收集2018年1~12月于苏北人民医院生殖中心就诊的不孕患者卵泡液,患者年龄≤35岁。根据患者不孕原因分为PCOS组和对照组。PCOS组纳入标准:(1)患者均符合鹿特丹诊断标准诊断;(2)稀发排卵或无排卵;(3)B超显示卵巢多囊样改变。对照组的纳入标准:(1)卵巢阴道超声检查正常;(2)性激素水平正常;(3)双侧窦卵泡计数6~10个;(4)月经周期正常(26~32 d);(5)不孕仅由输卵管因素引起。
排除标准:(1)由其他疾病引起的不孕症如原发性下丘脑闭经、原发性卵巢功能衰竭、催乳素紊乱和其他下丘脑垂体卵巢轴器官的器质性和功能性疾病;(2)内分泌疾病如库欣综合征、高泌乳素血症、肢端肥大症、先天性肾上腺增生、甲状腺疾病和雄激素分泌性肿瘤;(3)生殖系统疾病如子宫内膜异位症、卵巢手术或放疗和化疗史;(4)以及其他遗传性疾病如特发性毛发和药物引起的雄激素过多症等。
本研究共收集56例患者卵泡液。其中PCOS组28例;对照组28例。比较两组患者的临床资料,并且每组随机挑选3例患者的卵泡液外泌体送至和元公司进行lncRNA测序分析。
二、试剂和仪器
TB GreenTMPremix Ex TaqTMII(RR820A,TAKARA,日本);PrimeScriptRT试剂盒(RR037A,TAKARA,日本);Amicon Ultra-15离心过滤器(30 kDa,UFC903096,Millipore,德国);NanoSight分析系统(Particle Metrix,德国);MiRNeasy Mini Kit(Cat.217004,QIAGEN,德国);NanoDrop ND-2000(Thermo Scientific,美国);荧光定量PCR仪(7900HT,ABIPRISM,美国)。
三、实验方法
两组患者均采用GnRH激动剂长方案进行促排卵并收集卵泡液。随机从PCOS组和对照组各取3例患者的卵泡液(分别命名为PCOS组1~3号和对照组1~3号)进行如下研究。
1.促排卵和卵泡液外泌体的分离与鉴定:收集的卵泡液在4℃按500g5 min、3 000g25 min、10 000 g 60 min顺序离心,收集上清液并在超高速离心机中于4℃以110 000g离心2次,每次70 min。为了鉴定分离的外泌体,透射电子显微镜(TEM)观察外泌体形态,Western Blot检测外泌体标记分子CD9的表达以及NanoSight分析(NTA)测量外泌体浓度粒径。
2.外泌体RNA提取、分离和测序:使用QIAGEN miRNeasy Mini Kit试剂盒从外泌体中提取总RNA,并测试其完整性,检测其浓度,送至和元生物技术有限责任公司并进行高通量测序分析。
3.卵泡液外泌体RNA生物信息学分析:Cluster软件将相似表达的基因聚集在一起,形成热图,利用Top Go软件提供GO富集分析,分析靶基因的细胞成分、分子功能和生物学过程。同时,利用KOBAS(http:∥kobas.cbi.pku.edu.cn)软件对差异基因显著富集的信号通路进行功能注释,了解与差异表达基因相关的信号通路。
4.RT-qPCR验证:选取差异表达的DNA甲基转移酶(DNMT1)、DNA甲基转移酶2(DNMT2,也称为tRNA天冬氨酸甲基转移酶1,TRDMT1)、DNA甲基转移酶3A(DNMT3A)、DNA甲基转移酶3B(DNMT3B)、H19以及血清和糖皮质激素诱导的激酶1(SGK1),从PrimerBank(https:∥pga.mgh.harvard.edu/primerbank/)搜索要检测基因的引物序列,各基因引物序列见表1,实时定量PCR(RT-qPCR)进行验证。RT-qPCR实时定量PCR反应体系(20 μl):10 μl TB Green Premix Ex TaqII(Tli RNaseH Plus)(2×),0.4 μl 上游引物(10 μmol/L),0.4 μl 下游引物(10 μmol/L),1.0 μl cDNA模板和ddH2O,每组重复3次。

表1 引物序列
四、统计分析
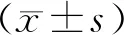
结 果
一、两组患者的基本临床资料
两组患者间年龄、总孕酮、雌激素(E2)、FSH、获卵数、可移植胚胎数、空腹血糖和催乳素(PRL)均无显著差异(P>0.05)。体重指数(BMI)、LH和窦卵泡数均存在显著差异(P<0.05)(表2)。
表2 两组患者的基本临床资料比较[(-±s),%]
注:与对照组比较,*P<0.05
二、卵泡液中分离的外泌体
TEM结果显示外泌体是具有典型的双层膜结构的圆形囊泡(图1A)。NTA结果显示所获外泌体颗粒的浓度为4.9×106个/ml,外泌体峰直径为127 nm(图1B)。同时Western Blot结果显示,所获得的卵泡液外泌体中检测到外泌体标记分子CD9蛋白条带(图1C)。以上结果证实卵泡液外泌体提取成功。
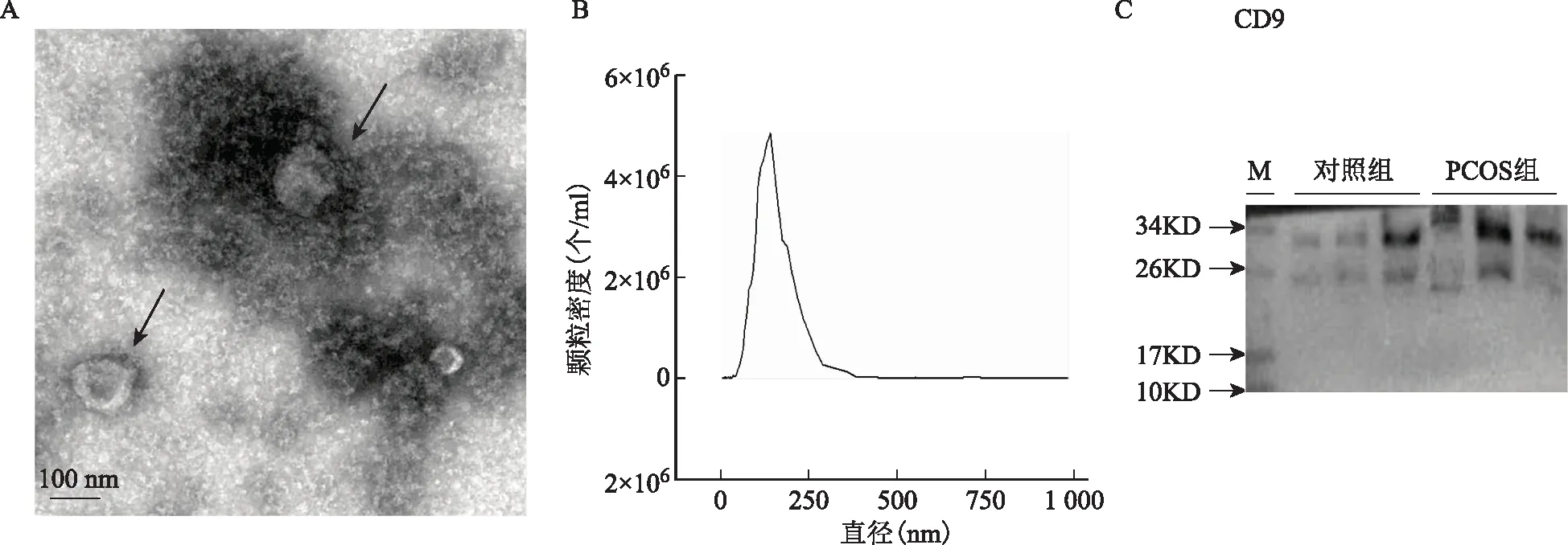
A:电镜图(箭头所指为外泌体);B:外泌体粒径图;C:Western Blot检测图1 外泌体的分离和鉴定结果
三、卵泡液中外泌体RNA定量及完整性
利用NanoDrop ND-2000进行RNA定量,外泌体RNA的A260/280比值在1.1~1.6之间(表3)。进一步经过Agilent Bioanalyzer 2100(Agilent Technologies)检测RNA完整性,RNA质检毛细管电泳图可见明显的RNA峰图(图2),表明RNA完整性合格。RNA完整值(RNA integrity number,RIN)作为检测RNA完整性的一个指标,表明本项研究外泌体RNA质检合格,符合进一步建库测序的要求。
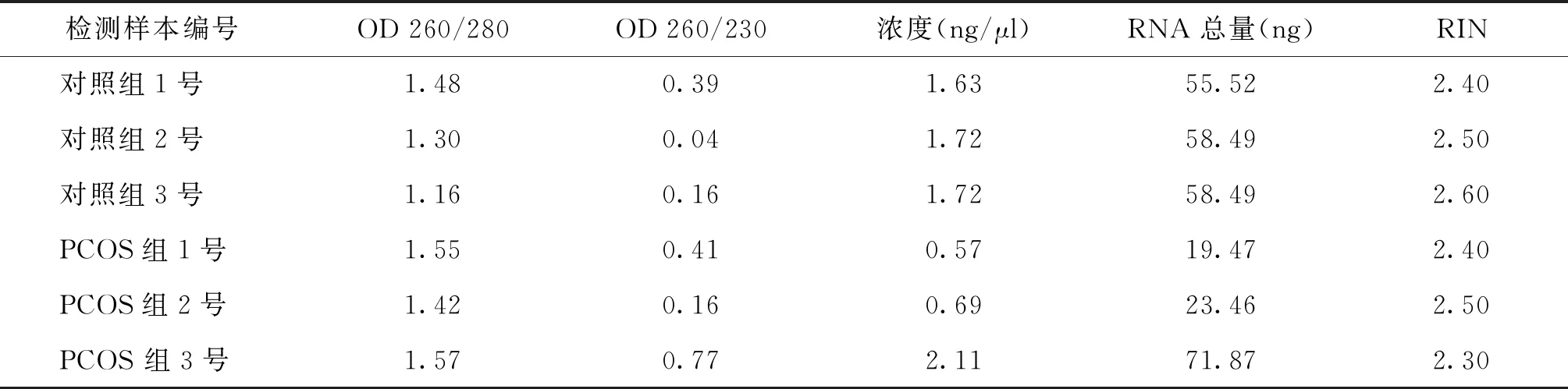
表3 外泌体RNA定量结果
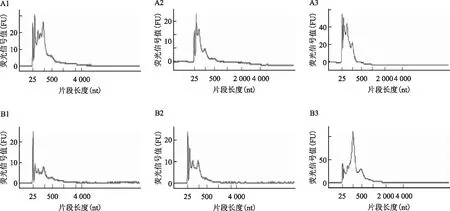
A1~A3:为对照组1~3号;B1~B3:为PCOS组1~3号图2 外泌体RNA完整性质检结果
四、差异lncRNA火山图结果
两组中差异表达lncRNA的火山图,筛查阈值默认设置为P≤0.05。差异表达的lncRNA用红点(表达上调),蓝点(表达下调)和灰点(无显著性差异)标记,PCOS患者卵泡液外泌体中lncRNA的共有1 866个基因差异表达,其中1 253个基因上调,613个基因下调(图3)。
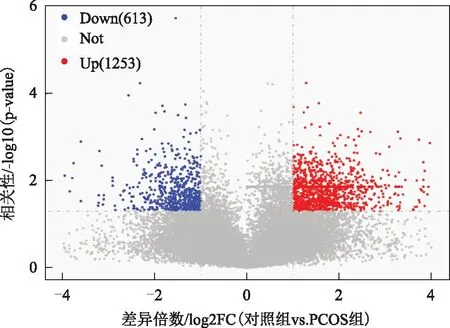
图3 差异表达的lncRNA火山图
五、lncRNA的聚类分析
使用Cuffdiff软件计算lncRNA转录本表达的FPKM(每百万片段外显子每千碱基的片段数),同一生物学过程中,PCOS患者卵泡液的外泌体中差异表达了3 204个lncRNA转录本(图4)。
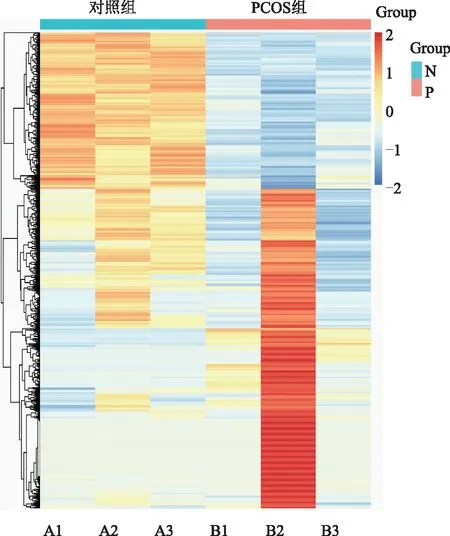
A1~A3:为对照组1~3号;B1~B3:为PCOS组1~3号。 橙色表示上调,蓝色表示下调图4 lncRNA差异聚类分析
六、GO和KEGG信号通路分析
GO富集分析结果显示,差异lncRNA在生物学过程方面主要富集于组织细胞成分或生物发生、组织细胞成分;细胞组分方面主要富集于细胞内;分子功能方面主要富集于如黏附、蛋白质结合等(图5)。KEGG通路结果显示,差异lncRNA在卵母细胞减数分裂、胰岛素信号通路、胰岛素抵抗、胰岛素分泌、Ⅰ型糖尿病、Ⅱ型糖尿病、雌激素信号等通路富集(图6)。
七、RT-qPCR验证差异基因的表达水平
差异表达的DNMT1、DNMT2、DNMT3A、DNMT3B、H19和SGK1 RT-qPCR验证结果显示,在PCOS患者卵泡液外泌体中DNMT1、DNMT2、DNMT3A和H19的表达水平显著下降(P<0.05),而SGK1表达显著增加(P<0.05)(图7)。RT-qPCR验证结果与测序数据结果一致。
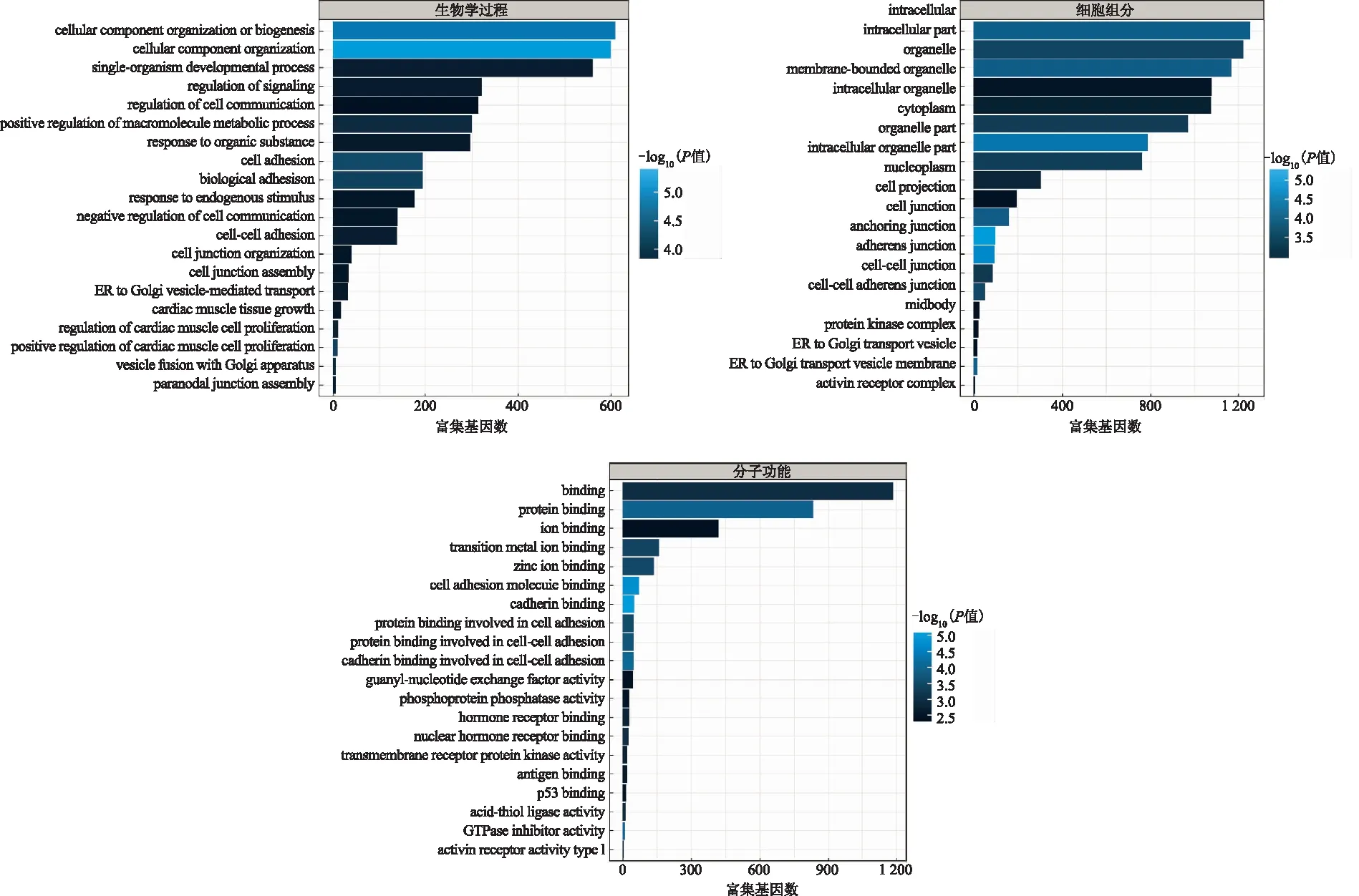
图5 GO富集图
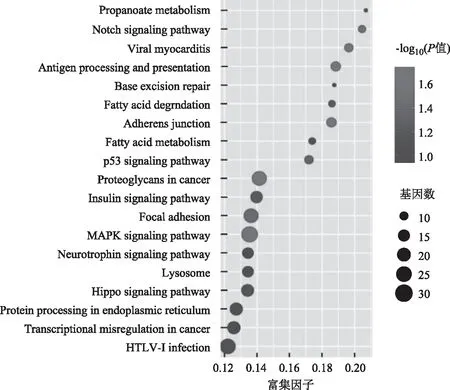
图6 KEGG信号通路
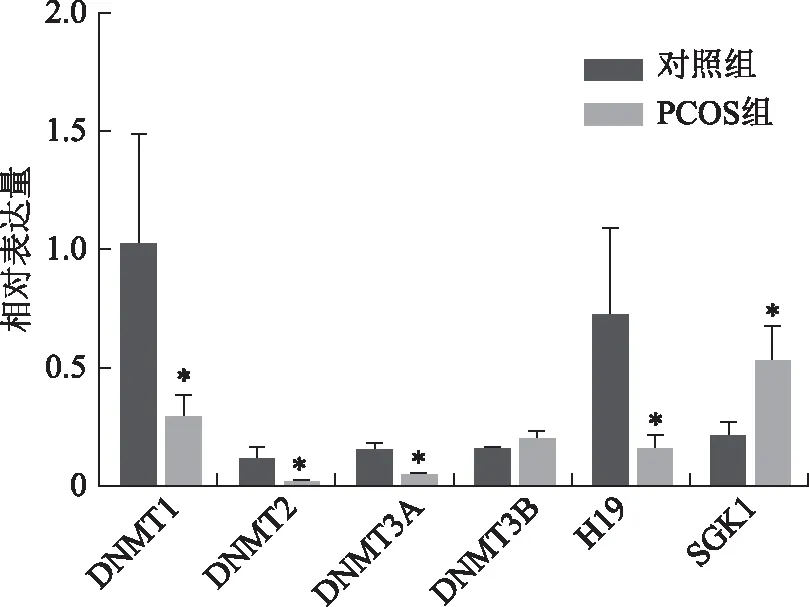
注:与对照组比较,*P<0.05图7 差异基因的RT-qPCR验证结果
讨 论
PCOS常表现为家族遗传性终身性疾病,与月经失调、无排卵性不育[18]、高雄激素血症[19]、血脂异常[20]和胰岛素抵抗[21]有关。在本研究中,我们挑选PCOS患者卵泡液外泌体中,差异表达的6个lncRNA(DNMT1、DNMT2、DNMT3A、DNMT3B、H19和SGK1),并通过RT-qPCR验证与测序结果一致。差异表达lncRNA的GO和KEGG信号通路分析表明,它们在卵母细胞减数分裂以及胰岛素信号通路、胰岛素抵抗中起着重要作用。这些潜在的功能和途径可能与PCOS的发病机理有关。外泌体可通过体液到达远端的器官,然后通过释放携带的因子影响器官的新陈代谢[22]。外泌体内的RNA可以在细胞之间穿梭,并通过细胞间通讯影响受体细胞[23]。研究表明,特定的lncRNA参与了各种疾病的发展,如糖尿病[24]、生殖系统肿瘤[25]和克氏综合征[26]。Zhang等[27]发现lncRNA CD36-005与PCOS的发病有关。Liu等[28]发现PCOS患者颗粒细胞中lncRNA表达的失调可能在颗粒细胞增殖和类固醇生成中起重要作用,并证明了lncRNA HCG26在PCOS患者中表达上调,并且与窦卵泡的数量有关。
DNA甲基化是关闭某些基因活性的表观遗传机制之一,导致基因表达和基因组稳定性发生变化。Jia等[29]发现卵泡液中同型半胱氨酸水平Hcy的增加与DNMT1表达的上调和mtDNA的高甲基化有关。这些代谢和表观遗传变化可能导致线粒体功能受损,最终导致来自PCOS母羊的卵母细胞质量下降。尽管我们的研究结果与之相反,这也许是由于物种不同,但这些研究都表明DNMT1在PCOS中起调节作用。另外,有研究证明DNMT1在卵母细胞的产生和胚胎的存活中起着重要的作用[30]。患有PCOS的女性卵泡中的雄激素过多会降低DNMT并改变表观遗传表达,PCOS患者颗粒细胞中DNMT1和DNMT3A的表达低于正常组[31],我们的研究结果与之一致。
DNMT2被认为与许多过程的调控有关,但其生物学效应和潜在的分子机制仍不清楚。Zhang等[32]发现,精子中非编码小RNA介导的DNMT2的敲除可以中断父方代谢疾病向后代的传播。哺乳动物DNA甲基化的建立和维持取决于DNMT3A和DNMT3B,它们负责在配子发生和早期胚胎发生过程中修饰DNA甲基化[33-34]。尽管甲基化模式随发育阶段和细胞类型而异,但DNMT3B对于在胚胎发生过程中介导从头甲基化是必需的。
本研究结果表明PCOS患者的卵泡液外泌体中确实存在差异表达的lncRNA,但是关于lncRNA在卵泡液外泌体中的表达及其作用途径的研究仍然很有限。鉴于本研究的样本量较少的局限性,今后有必要扩大样本量进行更深入的研究,以阐明这些差异表达lncRNA的分子机制。
