自体卵巢组织冷冻在女性肿瘤患者生育力保存中的应用
2020-05-25马聪邹慧娟王建业吴欢胡晶晶王影吴荣周平许孝凤
马聪,邹慧娟,王建业,吴欢,胡晶晶,王影,吴荣,周平,许孝凤*
(1. 安徽医科大学第一附属医院妇产科,合肥 230032;2. 国家卫生健康委配子及生殖道异常研究重点实验室,合肥 230032;3. 出生人口健康教育部重点实验室,合肥 230032;4.生殖健康与遗传安徽省重点实验室,合肥 230032;5.安徽省生命资源保存与人工器官工程技术研究中心(安徽医科大学),合肥 230032)
肿瘤是危害人类健康的主要公共卫生问题,也是中国居民死亡的第二大原因。随着癌症筛查网络的逐渐完善以及早期诊断技术、治疗水平的提高,1991年至2016年全球癌症死亡率下降了27%[1]。癌症管理的改善和存活时间的延长,使肿瘤患者对保存生育能力的需求不断提高[2]。
在每年新确诊的女性肿瘤患者中,大约有5%为育龄期女性。50%~80%的患者会因放疗、化疗导致卵巢功能不全,出现围绝经期症状。严重者会出现卵巢组织的纤维化,卵泡数的减少甚至消失,引起卵巢功能衰竭,丧失生育能力[3]。肿瘤治疗技术的提高延长了患者的生命,而生育力保存技术的发展则改善了患者的生活质量。
生育力保存方案与患者年龄、癌症类型、治疗方式、生育伴侣、可用于生育保存的时间和卵巢代谢等因素有关。女性肿瘤患者的生育力保存多采用低温冷冻保存的方法,主要技术有3种:胚胎冷冻,卵母细胞冷冻和卵巢组织冷冻[4]。目前,胚胎冷冻和成熟卵母细胞冷冻是美国生殖医学学会认可的保存生育能力的方法[5]。
胚胎冷冻在国内外各大生殖中心的应用较为普遍,其获得的效果令人鼓舞,但并不适于青春期前或者没有配偶的女性。卵母细胞冷冻技术对恶性肿瘤患者来说有时间的局限性,促排卵获取成熟的卵母细胞是长周期过程,而肿瘤患者有可能在促排卵过程中延误了治疗肿瘤的最佳时机。而且胚胎冷冻和卵母细胞冷冻技术都不能完全恢复女性生殖内分泌功能,对提高患者生活质量效果有限,导致患者会过早出现围绝经期症状。安徽医科大学第一附属医院于2016年在省内率先开展生育力保存,目前生育力保存库中已有14例患者。本研究对库中14例患者的卵母细胞、胚胎及卵巢组织冷冻情况进行总结分析,探讨不同生育力保存方法的适应症。
一、资料和方法
1.研究对象:本研究回顾性分析2017年12月至2019年9月,在安徽医科大学第一附属医院生殖中心生育力保存库进行生育力保存14例患者的资料。根据患者婚育情况及个人意愿,制定相应方案,并签署相关知情同意书。
2.卵巢组织获取及处理:适应证为年龄≤40岁、放化疗术前,卵巢储备功能正常,且有意愿进行生育力保存的女性肿瘤患者。完善相关检查,排除手术禁忌,不予促排卵等处理,行腹腔镜下双侧卵巢楔形切除术。将获取的卵巢组织放入4℃生理盐水培养皿中,立即转运至胚胎培养室。Ova Rinse液(KITAZATO,日本)洗净组织后,并在含Ova Rinse液的培养皿中用直头剪刀沿卵巢组织赤道面剪开,用弯头剪头及镊子小心分离皮质、髓质,分离出的皮质厚度大约为1 mm,用手术刀将皮质切成0.5 cm×0.5 cm至1 cm×1 cm大小。
3.卵巢组织平衡及冻存:本培养室采用日本KITAZATO公司卵巢组织平衡试剂盒(Ova Cryo Kit Type M VT301S),含有Cryo1(20 ml)、Cryo2(20 ml)和Cryo3(20 ml)。将平衡液提前复温至室温(25℃~27℃),并倒入分别贴有Cryo1、Cryo2、Cryo3标签的相应培养皿(直径 60 mm)中;将切好的卵巢皮质用无菌纱布拭干表面液体,浸入Cryo1液中静置5 min;用镊子将卵巢皮质从Cryo1中取出,在培养皿边缘沥净表面液体,再浸入Cryo2液中静置5 min;同上操作,将卵巢皮质浸入Cryo3液中静置15 min。多块卵巢皮质可同时进行以上操作;将沉入皿底的卵巢皮质取出,拭干后平贴于针刺式载体表面(KITAZATO,日本),并使其表面积最大化;将载杆快速放入液氮中,缓慢摇动除去表面空气,观察组织变为玻璃化样。登记患者信息,记录冻存管数及位置。
4.卵母细胞收集:在分离卵巢皮质、髓质的过程中,未成熟的卵母细胞会掉落至Ova Rinse液中。将Ova Rinse液经100 μm细胞筛过滤,在解剖显微镜下寻找卵丘复合物(oocyte-cumulus complex,OCCs)。将收集到的卵丘复合物置入取卵冲洗液中充分洗涤,移入卵母细胞体外成熟(in vitro maturation,IVM)培养皿。分别体外培养 24 h、48 h后观察,按卵母细胞第一极体排出情况收集成熟卵母细胞。
5.卵母细胞冷冻:适应证为未婚、年龄≤40岁、放化疗术前、卵巢储备功能正常且有意愿进行生育力保存患者。将经过IVM培养成熟的第2次减数分裂中期(MII)的卵母细胞进行玻璃化冷冻,冷冻试剂采用日本KITAZATO公司标准化试剂盒(VT101)。记录冻存枚数及冻存位置。
6.胚胎冷冻:适应证为已婚、年龄≤40岁、放化疗术前、卵巢储备功能正常,且有意愿进行生育力保存患者。将收集到未成熟卵母细胞经IVM技术于体外成熟后,采用卵胞浆内单精子注射(ICSI)方式授精。将受精正常的胚胎放入Cleavage培养液中(Cook,美国),于培养箱中培养至第3天(卵裂期)或第5~6 天(囊胚期),采用日本KITAZATO公司标准化试剂盒(VT101),进行卵裂期和囊胚期胚胎玻璃化冷冻。记录冻存胚胎数及冻存位置。
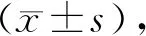
二、结果
1.患者基本信息:14例患者以乳腺癌、卵巢交界性肿瘤为主要病种。乳腺癌患者占比57.1%(8/14),平均年龄为(26.88±1.89)岁;卵巢交界性肿瘤占比28.7%(4/14),平均年龄为(27.75±2.06)岁;结肠癌、子宫内膜癌各1例,各占比7.1%(1/14)(表1)。
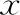
表1 患者基本信息[(-±s),%]
2.患者生育力保存方案的选择:本生殖中心生育力保存库于2016年建立。截止至2019年9月,已有14例女性肿瘤患者进行生育力保存,平均年龄为(27.35±1.52)岁,其中已婚7人、未婚7人。对于已婚患者,本中心推荐卵巢组织玻璃化冷冻+胚胎冷冻方案,71.4%(5/7)的患者采用本方案进行生育力保存,其余3例因未获卵或个人意愿,仅进行了卵巢组织玻璃化冷冻;对于未婚患者,本中心推荐卵巢组织玻璃化冷冻+卵母细胞冷冻方案,28.7%(2/7)的患者采用本方案进行生育力保存,其余5例因未获卵或个人意愿,仅进行了卵巢组织玻璃化冷冻(表2)。
7例患者于体外获取未成熟卵母细胞,平均获卵(10.57±5.97)枚,经体外成熟(IVM)技术于体外培养,IVM平均成熟率为54.05%(40/74),并根据患者的个人情况进行卵母细胞冷冻或胚胎冷冻。其中,2例患者进行了卵母细胞冷冻,平均冻卵7枚;5例患者进行了胚胎冷冻,平均冻胚(3.2±1.92)枚(表3)。
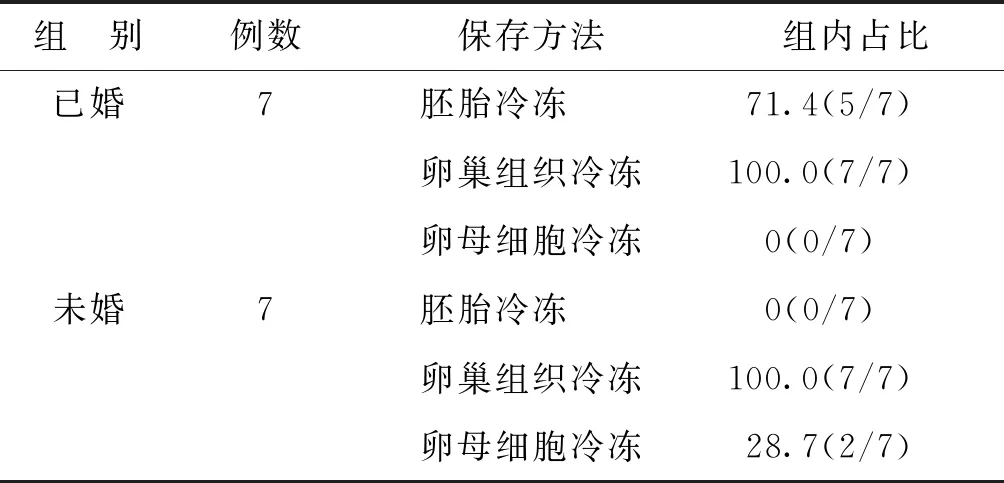
表2 生育力保存方案的选择(%)
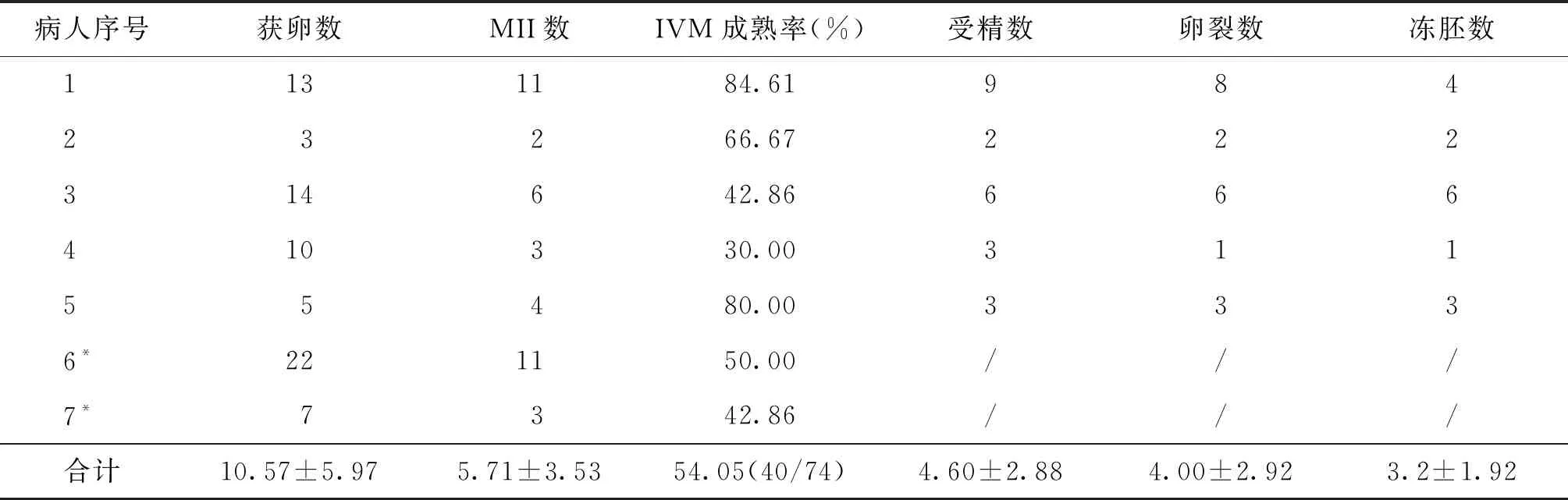
表3 经IVM成熟卵母细胞及胚胎统计
注:*因未婚无受精卵
讨 论
人类在胎儿期大约有295 000个原始卵泡,这些构成了人类卵巢的原始卵泡池,随着不断排卵及卵泡闭锁,卵泡池在绝经期枯竭。肿瘤放、化治疗的生殖毒性使卵泡池过度减少,造成卵巢早衰,引起更年期提前[6]。一般认为,电离辐射产生的自由基可破坏DNA分子,如碱基改变、DNA合成抑制或分解增强,引起染色体畸变;破坏蛋白质和酶分子结构,引起细胞凋亡。卵巢损伤的严重程度不仅与照射剂量的大小有关,还取决于细胞群中受损细胞的数量或百分率。化疗药物对生殖细胞的毒性机制仍不清楚。化疗药物不一定直接导致原始卵泡凋亡,大部分化疗药物产生的活性代谢产物会与DNA形成交联,从而抑制DNA的合成和功能,引起细胞凋亡[7],如:高风险化疗药物——环磷酰胺(烷化剂)可引起DNA链内或链间发生交联,干扰细胞分裂;中等风险化疗药物——顺铂主要通过形成DNA链内或链间加合物,干扰细胞的转录和复制[8]。
“生育忧虑”的概念于2005年第一次提出,主要用于年轻的癌症幸存者。“生育忧虑”是指患者在接受癌症治疗时,由于生殖功能的受损带来关于性问题、生育问题的忧虑[9]。有报告提出,生育能力的丧失可能比癌症本身更痛苦[10]。在一项针对癌症患者的调查中,超过一半的人表示生孩子是他们生命中“最重要的事”,62%的人“最关心”癌症治疗对他们生育能力的影响。此外,癌症治疗后生育孩子,是对患者康复最有力的帮助[11]。
生育力保存技术的发展,给年轻癌症幸存者带来生育的希望。卵巢组织冷冻、卵母细胞冷冻及胚胎冷冻是我中心常用的几种方法。卵巢组织冷冻技术可以把含有大量原始卵泡的卵巢皮质通过玻璃化冷冻保存,是不想接受控制性超促排卵的成年癌症患者保留生育能力的重要选择,也是青春期前癌症患者保留生育能力的唯一选择[12]。与其他保存方法不同,卵巢组织冷冻不仅保存了原始卵泡,还可以通过解冻移植恢复内分泌功能。许多专家认为,现在已有足够的证据支持,卵巢组织冷冻保存是一种有效的生育力保存技术,是一种可行的治疗方法,而不是仅仅作为一种实验方法[13]。
胚胎冷冻技术经过30多年的不断发展,已成为最成熟的辅助生殖技术,是公认的保存生育力的最佳方法[14]。冷冻胚胎移植的相关研究表明,单纯冷冻移植组的着床率和持续妊娠率显著高于新鲜移植组[15]。然而,胚胎的形成需要精子,所以许多年轻的单身女性无法进行胚胎冷冻。此外,胚胎冷冻、保存可能受到其他各种伦理、宗教和社会原因的限制[16]。
卵母细胞冷冻已被证明是一种有效的辅助生殖技术[17],为未婚女性提供更多选择,避免伦理问题的发生。世界上多个生殖中心已经报道,在IVF周期中获得的新鲜卵母细胞和玻璃化冷冻的卵母细胞之间具有相似的妊娠率[18]。美国生殖医学学会(ASRM)和美国临床肿瘤学学会(ASCO)已经认可卵母细胞冷冻保存作为“患有癌症和其他疾病需进行高生殖毒性治疗的妇女的生育能力保存策略”[19]。我中心采用卵巢皮质离体取出的未成熟卵母细胞,经未成熟卵母细胞体外成熟(IVM)技术培养至MII期再进行冷冻。卵母细胞复苏后透明带硬化的问题,可由ICSI技术解决。该方案可用于无充分时间进行促排卵或者雌激素敏感性疾病(如乳腺癌)的患者。多数专家认为大约40%~80%的未成熟卵母细胞可以成功完成IVM和受精,但未成熟卵母细胞的成熟率仍低于常规获取的卵母细胞,故将该生育力保存方案放在次优选项[20]。此外,IVM技术的活产率相对常规技术较低[21],但已有经此方法成功生育的报道[22]。IVM和卵巢组织冷冻保存的结合能为需要紧急保存生育力的年轻患者提供两种互补的技术。
理想的生育力保存方法是使患者免受肿瘤治疗带来的毒性作用。长期以来,促性腺激素释放激素类似物(GnRH-A)被认为是保护卵巢的潜在药物,在放化疗前保护卵巢免受生殖毒性[23]。其作用机制有两种假说:一种是通过抑制下丘脑-垂体-卵巢轴(HPO轴)使大部分卵泡处于静止状态,减少化疗药物的毒性作用;另一种假说是限制卵巢的血流,减少化疗药物进入卵巢的途径[8]。GnRH-A能否保护卵巢仍具争议性。2018年ASCO指南提出,在已证实的生育能力保留方法(胚胎、卵母细胞或卵巢组织冷冻)不可行的情况下,GnRH-A可用于乳腺癌患者减少化疗引起的毒性作用。而对于其他类型的肿瘤患者,仍不能使用GnRH-A代替已证实的生育能力保留方法[24]。
各种指导方针建议,在开始癌症治疗之前,应当讨论生育力保存的问题,但这方面缺乏实践。患者的经济情况、癌症分型、生存优先及对生育后代的健康担忧均会影响患者的决定[25]。此外,肿瘤医生和生殖内分泌医生之间的缺乏合作是另一方面原因。肿瘤医生有责任与患者讨论预期癌症治疗的生殖风险,生殖内分泌医生应详细与患者讨论适当的生育保存技术。理想情况下,育龄期的肿瘤患者都应得到规范化的转诊[26],得到规范化生育力保存治疗。
