基于宏基因组分析桑葚酵素的微生物多样性
2020-05-24邸鹏月卢海强谷新晰田洪涛
邸鹏月 彭 宇 李 晨,2 卢海强,2 谷新晰,2 田洪涛,2,3*
(1 河北农业大学食品科技学院 河北保定071001 2 河北省农产品加工工程技术研究中心 河北保定071001 3 国家北方山区农业工程技术研究中心 河北保定071001)
桑葚被称为“21 世纪最佳保健果品”,富含多种营养成分和丰富的黄酮类及多酚物质,具有提高人体免疫力,清除体内有害自由基及促进糖类脂肪蛋白代谢等重要作用[1-2]。2017年中国生物发酵产业协会发布的《食用植物酵素》标准中定义:食用植物酵素(Edible plant Source Jiaosu)以植物为原料,经微生物发酵制得的含有特定生物活性成分(多糖类、寡糖类、蛋白质及多肽、氨基酸类、维生素类等)、可食用的酵素产品[3]。研究表明该类产品具有延缓衰老,抑菌消炎,清洁血液,提高机体免疫能力及解毒抗癌多种功效[4]。研制开发桑葚酵素具有广阔前景。
我国现有的食用酵素大多延续传统发酵方法——自然发酵工艺制成,此类制作方法不仅受限于发酵季节,而且发酵周期冗长,发酵菌种更是繁多混杂,造成发酵环境的不稳定性,同时发酵产品的安全质量也难以控制。实现食用酵素生产由自然发酵到接种发酵的技术飞跃,势在必行。探究自然发酵食用酵素微生物多样性与菌群变化规律,是筛选食用酵素,接种发酵优良优势微生物菌种的基础课题与首要任务。目前,对自然发酵食用酵素微生物多样性与菌群变化规律的研究,大多采用分离纯化法、PCR-DGGE 法等。随着分子生物学的飞速发展,宏基因组学被用于分析自然发酵过程中微生物群落动态变化规律。宏基因组学是专门研究直接从样品中提取基因组DNA 后进行测序分析,能够准确揭示微生物群落多样性、种群结构、进化关系、功能活性及环境之间的相互协作关系,极大地促进和扩展了微生物学的研究范围。例如,王海英[5]采用高通量测序分析技术对自然发酵方式制备的番木瓜酵素微生物的群落组成及多样性进行测序分析,为有效调控发酵过程中微生物菌群提供了方向。然而,利用宏基因组学研究桑椹酵素自然发酵微生物多样性及菌群变化规律,鲜有报道。
本研究以不同时期自然发酵的桑葚酵素为样本,采用宏基因组学技术探究样品中微生物的多样性及群落动态变化,对进一步筛选桑葚酵素自然发酵优势微生物菌种,研制高效发酵剂,实现人工控制发酵桑葚酵素系列新产品,提高桑葚酵素产品生产效率与质量安全水平提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料 新鲜成熟桑葚,河北省石家庄市灵寿县海燕农牧公司提供;白砂糖、娃哈哈纯净水、玻璃罐,购自百乐超市。
1.1.2 培养基 乳酸菌选择培养基[6]、醋酸菌选择培养基[7]、酵母菌选择培养基[8]。
1.1.3 主要试剂及设备 试剂:牛肉浸膏、酵母浸粉、蛋白胨、葡萄糖、吐温、琼脂等,溶菌酶、琼脂糖凝胶DNA 回收试剂盒、DNA mark,万科公司;PCR引物,华大基因合成。所有试剂均为分析纯级。
设备:FLC-3 超净台,哈尔滨市东联公司;SPX-150B-Z 型生化培养箱,上海博迅实业有限公司;XSZ-G 型显微镜,重庆光电仪器有限公司;TGL16M 型离心机,长沙市易达科贸公司。
1.2 试验方法
1.2.1 样品制备 摘除桑葚中的枝叶和杂物,用无菌水冲洗桑葚表面,在超净工作台中晾干,按桑葚∶白砂糖质量比1∶1 混匀,放入灭菌的发酵玻璃罐中,置于暗处,室温发酵66 d[9]。
1.2.2 样品采集 在超净工作台中取桑葚酵素发酵前期(18 d)、中期(42 d)、后期(60 d)的样品45 mL 于已灭菌的离心管中,用于宏基因组研究。
1.2.3 样品测序流程 基因组DNA 抽提→PCR扩增及产物纯化→荧光定量→Illumina PE 文库制备→Illumina 高通量测序。
1.2.4 数据分析 本试验数据通过上海美吉生物医药科技有限公司多样性测序及分析平台完成。利用Trimmomatic 对原始数据进行筛选,用flash软件拼接完成。将通过OTU 聚类得到的代表序列采用Usearch 选出相似性在97%以上的序列,制得OTU 表格。
运用贝叶斯算法将97%相似水平的OTU 代表物种进行物种组成统计分析。通过绘制稀释性曲线、Shannon-Wiener 曲线及各微生物动态变化指数分析各样品细菌和真菌多样性及群落丰度变化[10]。
2 结果与分析
2.1 桑葚酵素样品的高通量测序数据
对原始数据进行筛选得出优化序列,以保证分析结果的质量。在去除嵌合体序列后进行OTU聚类分析,对OTU 的代表序列作分类学分析。桑葚酵素不同时期样品的高通量测序结果见图1、图2、表1。
桑葚酵素样品在97%的相似水平下经序列优化统计,表1、图1可见获得细菌的序列数在30 000~43 000 范围,序列长度大部分分布在441~460 bp,OUT 数在40~80 范围。表1、图2可见获得真菌的序列数在37 000~42 000 范围,序列长度主要分布在381~400 bp 和401~420 bp 范围,OUT 数在10~20 范围。以上表明随着发酵的进行,细菌的序列数和OUT 数逐渐增加,真菌序列数和OUT 数则减少;细菌的多样性随发酵的进行而增加,真菌的多样性则逐渐降低,整个发酵过程中细菌的多样性明显优于真菌。
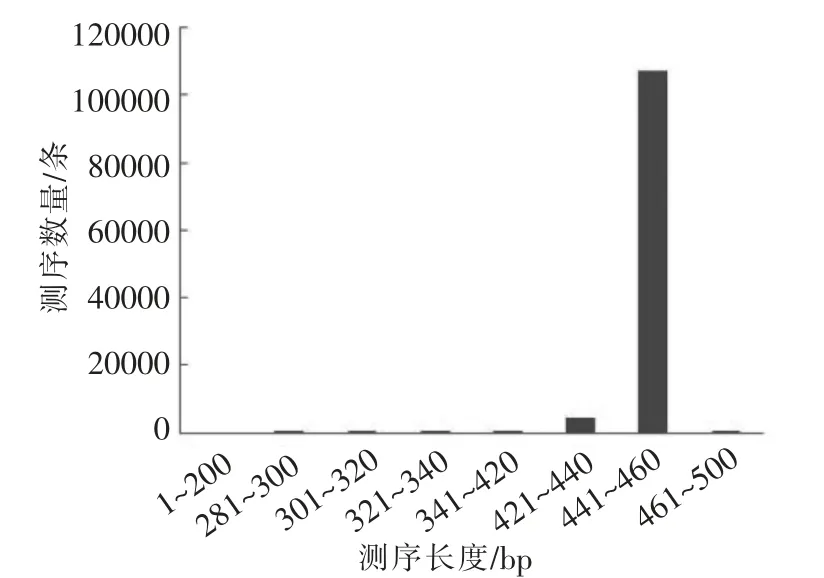
图1 优化后的细菌序列长度分布图Fig.1 The length distribution of the optimized bacterial sequence

图2 优化后的真菌序列长度分布图Fig.2 The length distribution chart of the optimized fungi sequence
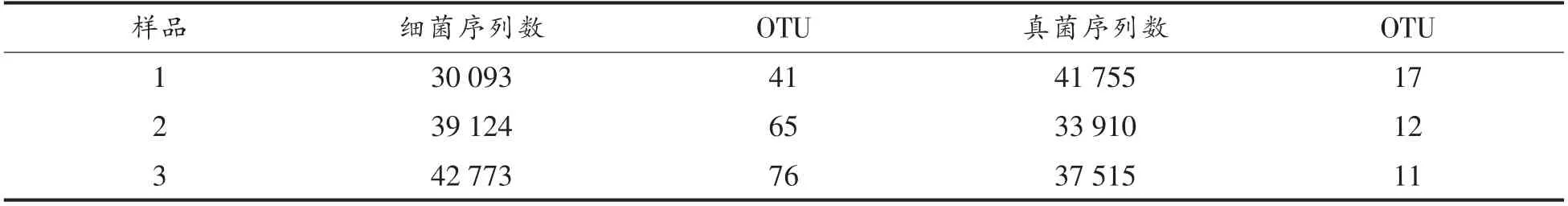
表1 3 个样品的高通量测序数据Table1 High-throughput sequencing data of 3 samples
2.2 稀释性曲线
稀释性曲线是从样本中随机抽取一定数量的个体,统计这些个体所代表的物种数目,并以个体数与物种数来构建曲线[11]。稀释曲线不仅可以反映不同样本中物种丰富度,也可以说明测序数据的合理性。当曲线趋向平坦时,说明测序数据量合理,更多的数据量只会产生少量新的OTU,反之表明继续测序还可能产生较多新的OTU。通过作稀释性曲线可得出样品的测序深度情况。桑葚酵素不同时期样品的稀释曲线见图3、图4。
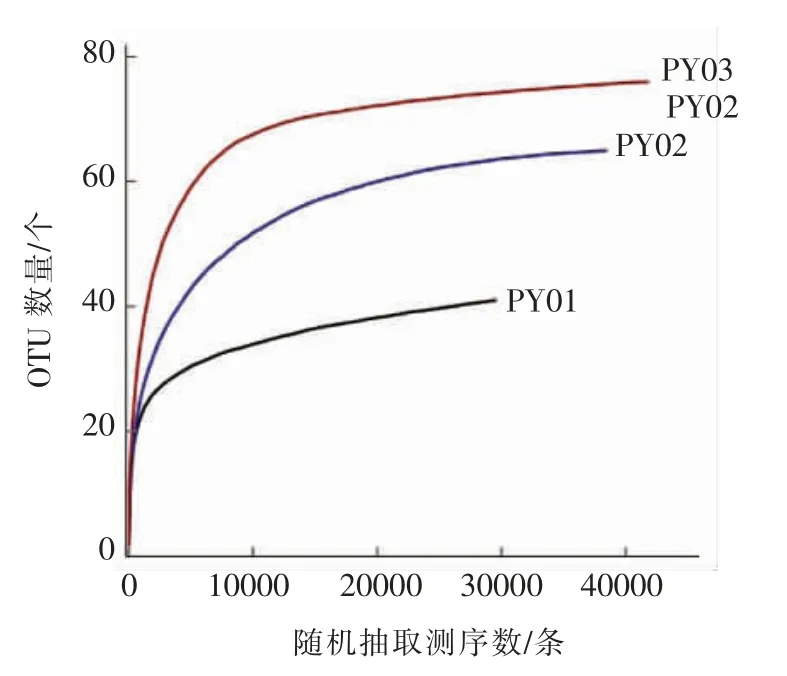
图3 3 个样品中细菌的稀释曲线Fig.3 The dilution curve of bacteria in 3 samples
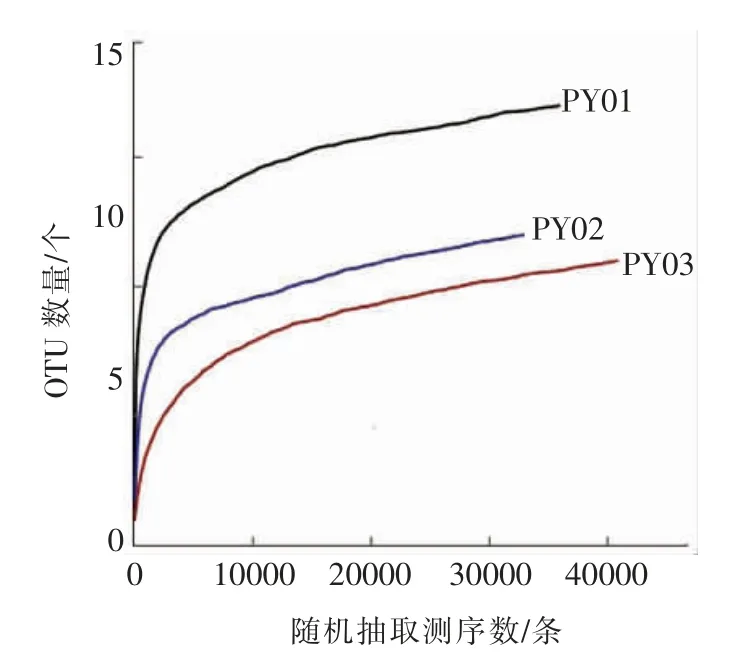
图4 3 个样品中真菌的稀释曲线Fig.4 The dilution curve of fungi in 3 samples
在使用97%相似度的OUT 水平上,随着3 个样品测序深度的增加,图3和图4显示细菌和真菌OUT 的数量增加并呈现倒“J”型曲线,斜率先快速增加后逐渐减小,最终趋于平缓,即细菌和真菌含有的OTU 组数先迅速增加,然后趋于平缓,最终保持稳定,表明在此测序深度能较准确反映桑葚酵素前、中、后3 个时期样品中微生物的丰富度和多样性。
2.3 Shannon-Wiener 曲线
反映样本中微生物多样性的指数,利用各样本的测序量在不同测序深度时的微生物多样性指数构建曲线,以此反映各样本在不同测序数量时的微生物多样性[12]。曲线越平缓,说明测序数量越多,越能有效反映样本中大多数微生物信息。桑葚酵素不同时期样品的Shannon-Wiener 试验结果见图5、图6。
Shannon 指数计算公式:

式中,Sobs——实际测量出的OUT 数目;ni——含有i 条序列的OUT 数目;N——所有的序列数。
由图5、图6可看出,在97%相似度水平上,起初曲线直线上升是由于3 个样品对细菌和真菌的测序条数远不足覆盖样品所致。随着3 个样品测序量的增加,数值增大,直至平缓,表明测序接近饱和,增加序列无法发现更多OUT,可以分别反映桑葚酵素前、中、后期样本中绝大部分的微生物信息。
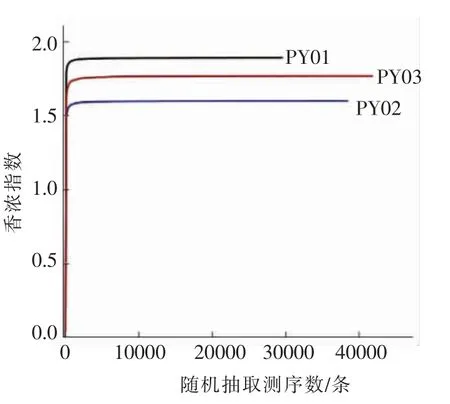
图5 3 个样品中细菌的Shannon-Wiener 曲线Fig.5 The Shannon-wiener curve of bacteria in 3 samples
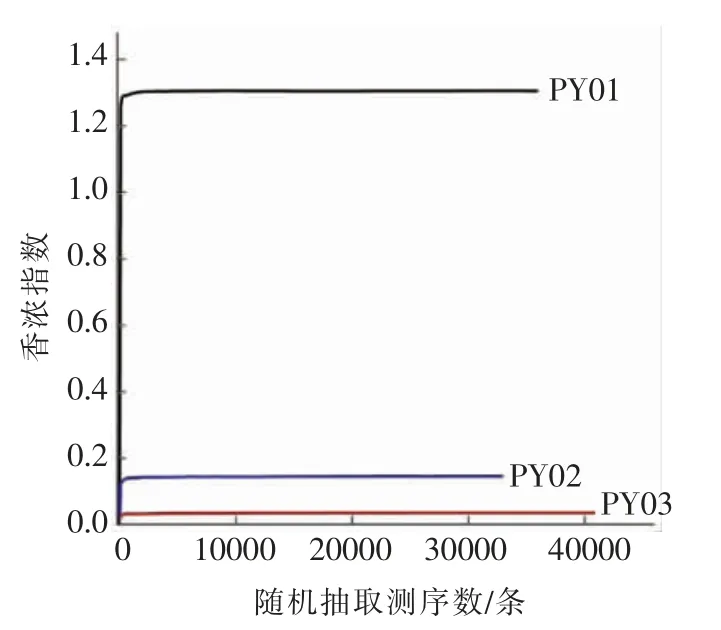
图6 3 个样品中真菌的Shannon-Wiener 曲线Fig.6 The Shannon-wiener curve of fungi in 3 samples
2.4 桑葚酵素发酵不同时期样品的微生物多样性分析
在OTU 聚类结果中,对单样品进行Alpha 多样性分析,可估算环境群落物种的丰度和多样性。分别用chao,ace 和simpson,shannon 表示菌群丰度指数和菌群多样性指数。统计结果见表2和表3。shannon 和simpson 可估计微生物多样性,shannon 值越大,群落多样性越高,而simpson 值越大,群落多样性越低[13]。

表2 细菌多样性指数Table2 Bacterial diversity indices
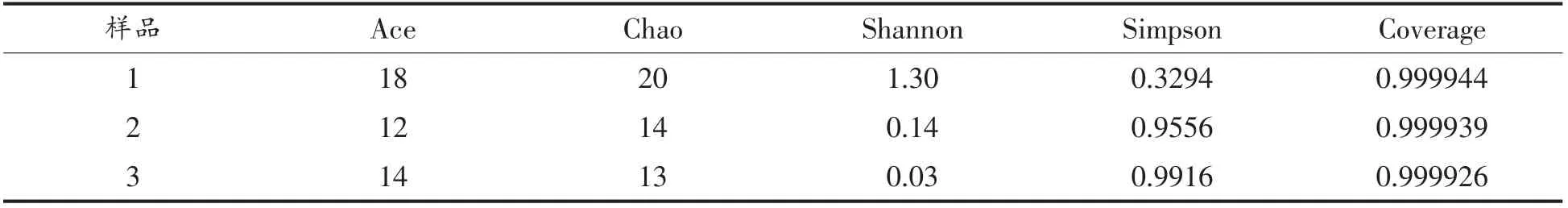
表3 真菌多样性指数Table3 Fungi diversity index
Coverage 表示各样本文库的覆盖率,Coverage值越高,样本中序列被测出的可能性越大。由表2看出,桑葚酵素前、中、后期样品中,细菌丰度指数Chao 值和Ace 值逐渐增加,样品中OTU 数目也随之增加,表明随者发酵的进行,桑葚酵素中细菌的物种总数增加,整个发酵环境适合细菌的生长于繁殖。Shannon 值先降低后增加,Simpon 值先上升后降低,表明随着桑葚酵素发酵的进行,细菌多样性在发酵前期最高,之后降低再升高,呈波动状态,推测受发酵环境pH 值的影响,发酵前期乳酸菌快速繁殖,产酸量增加,pH 值减小,抑制一些细菌的生长,导致细菌多样性降低。随后,发酵过程中微生物利用氨基酸或水解蛋白质,导致pH 值小幅上升并趋于平稳。
由表3真菌多样性指数可看出桑葚酵素不同时期样品中,Chao 值逐渐降低,表明真菌物种总数在发酵过程中逐渐减少。Ace 值表明,OTU 数目先降低后有小幅增加,可能是受pH 值波动的影响。Shannon 值不断减少,而Simpson 值不断增加,表明真菌多样性随着桑葚酵素发酵的进行逐渐降低。综合来看,细菌丰度指数Chao 值、Ace 值和多样性指数Shannon 值均比真菌高,Simpon 值比真菌低,也说明桑葚酵素发酵各时期细菌多样性比真菌多样性复杂。
2.5 桑葚酵素发酵过程中微生物群落结构及动态变化
采用统计学方法分析单个样品及多个样品在不同分类水平上的群落变化情况。本试验在属的水平上分析桑葚酵素不同时期样品微生物群落结构及动态变化,结果见图7、图8。
由图7可知,在属水平上,桑葚酵素发酵过程中细菌主要有乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)、片球菌属(Pediococcus)和明串珠菌属(Leuconostoc)等。桑葚酵素前、中、后期3 个样品中乳杆菌属所占比例最大,趋势为先降低后升高,占比分别为80.19%,90.02%,85.72%,由此可判断乳杆菌属在发酵过程中为优势菌。其次,魏斯氏菌(前、中、后期占比分别为6.37%,2.01%,2.45%)和明串珠菌(前、中、后期占比分别为2.69%,0.81%,1.79%)所占比例先减少后有小幅度增加,而片球菌属所占比例逐渐减少(前、中、后期占比分别为3.81%,1.47%,0.84%)。以上数据表明魏斯氏菌属、片球菌属和明串珠菌属主要作用于发酵前期,随着发酵的进行,环境pH 逐渐降低抑制其生长,其含量大幅减少,后期有小幅上升,可能是因pH 值波动所致。此外,呈现增长趋势的菌属有乳球菌属(前、中、后期占比分别为0.44%,0.62%,1.33%)和葡萄糖酸杆菌属(Gluconobacter)(前、中、后期占比分别为0.19%,0.18%,0.52%),醋酸杆菌属(Acetobacter)(分别为0.46%,0.33%,0.36%)在整个发酵时期稍有降低,较稳定存在。此外,还有一些致病菌以及一些尚未分类明确的细菌,它们所占的比例小,随着发酵的进行,生长环境处于劣势,其中致病菌大部分呈逐渐消亡的趋势。在发酵前期乳杆菌属最多,明串珠菌属经异型乳酸发酵,代谢产物除乳酸外还有乙醇、乙酸、甘露醇等,这些物质与有机酸结合,对形成酵素特有风味起决定性作用[14]。发酵过程中发酵液pH 值下降使得对酸敏感的明串珠菌属繁殖受到阻碍甚至凋亡,而片球菌属、魏斯氏菌属细菌耐酸性强,逐渐取代明串珠菌属成为优势菌属。在乳杆菌属细菌发酵作用下,发酵环境酸度增加,产生的细菌素等可有利于一些杂菌的生存。乳杆菌通过同型发酵对酸性环境有较强的耐受力,存在于整个发酵过程。至于其它的菌,如醋酸杆菌稳定存在;葡萄糖酸杆菌自发富集,在发酵后期增加到0.52%;醋酸菌大量繁殖,可利用由酵母菌代谢生成的乙醇转化为乙酸,作为一种基础分为物质,对产品风味形成有一定的作用。鉴于醋酸菌在醋酸发酵阶段具有重要的功能,推测桑葚酵素发酵过程中很可能存在醋酸发酵阶段。
由图8可知,在属水平上,桑葚酵素发酵过程中真菌主要为未分类酵母(Saccharomycetales)、汉逊酵母(Hanseniaspora)。汉逊酵母(前、中、后期占比分别为41.4%,0.53%,0.08%)在发酵前期最多,中、后期急剧下降,表明汉逊酵母在桑葚酵素发酵前期是优势真菌并发挥重要作用。除此之外,还有少量覆膜酵母(Galactomyces)(前、中、后期分别为0.14%,0,0)、分子孢子菌属(Cladosporium)(前、中、后期分别为3.55%,0.08%,0.01%)和旋孢腔菌属(Cochliobolus)(前、中、后期分别为1.31%,0.33%,0.01%)等病原菌,随着发酵的进行,它们逐渐减少或死亡。同样,在发酵前期有酵母菌目和酵母科中尚未明确的种类在发酵前期占较高,随着发酵的进行,它们逐渐减少甚至消亡。在发酵中、后期出现大量未知的真菌且发酵终止时还有。发酵过程中,酵母作为兼性厌氧菌可利用的糖转化为酒精和二氧化碳。微生物发酵过程是一个复杂的过程,菌株种类多,许多病原菌可能受环境中高糖、酸度增加或者乙醇等有机物的影响而逐渐死亡。本试验中桑葚酵素在高糖、高渗的环境,相对于很多微生物来说,本身环境恶劣,而酵母易分离于高糖环境中,在发酵初期酵母属是真菌的优势菌群,之后随着环境的变化或不同微生物间的相互作用,有未知真菌占有很大的比例。本试验结果也反映出被人类探索出来的菌株资源有限,仍有丰富的资源及新的物种等待人们的探索和发现。
由以上数据统计发现:桑葚酵素发酵过程中微生物很丰富。根据细菌和真菌种类及数量的变化,可以推测桑葚酵素发酵过程中分为不同的阶段。发酵前期酵母菌启动发酵,分解环境中的可利用的糖产生乙醇和二氧化碳,产生的乙醇由醋酸菌利用生成醋酸,而乳酸菌发酵始终贯穿于整个发酵时期。不同发酵阶段发生着复杂的生化反应及微生物间的相互作用,也因此赋予桑葚酵素独特的风味和口感。

图7 3 个样品在属的水平上细菌组成Fig.7 The bacterial composition of 3 samples at the genus level
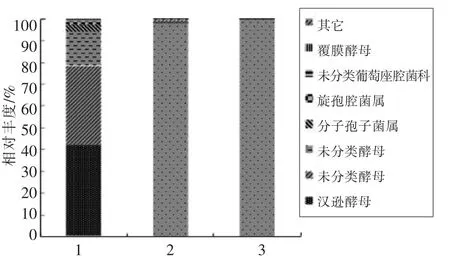
图8 3 个样品在属的水平上真菌组成Fig.8 The fungi composition of 3 samples at genus level
3 结论
通过分析生物多样性指数获得桑葚酵素发酵过程中细菌较真菌丰富。桑葚酵素发酵过程中的优势细菌是乳杆菌。优势真菌变化较大,在发酵前期是酵母,同时存在大量未知真菌。
4 讨论
宏基因组学研究的对象是特定环境中的总DNA,对认识和利用95%以上的未培养微生物提供了一条新的途径。通过高通量测定微生物基因组上的16S rRNA 基因进行生物多样性分析,能够提供更大的信息量,便于研究环境中物种的组成多样性,然而多样性分析对全面研究环境中的基因功能还有欠缺[15]。新一代高通量低成本测序技术的广泛应用使多样性的研究更加便利。
基于现今市场对食用植物酵素质量安全性的迫切需要和宏基因组学测序技术的先进性,本文利用宏基因组学方法对桑葚酵素不同发酵时期样品进行微生物多样性分析,得出细菌生物多样性大于真菌生物多样性。在属水平对微生物的多样性进行分析,主要的优势菌群为乳杆菌属和酵母属。随着发酵的进行,乳杆菌属占比最高并稳定存在,魏斯氏菌和明串珠菌先减少后有小幅增加;片球菌逐渐减少;汉逊酵母在发酵前期最多,之后急剧下降。综合来看这些菌属都在发酵前期发挥重要作用,其中乳杆菌能够利用桑葚发酵液中的糖进行发酵产生乳酸,说明在桑葚酵素风味形成中乳酸菌可能起重要作用。随着发酵进行,葡萄糖酸杆菌自发富集,因存在醋酸菌,故将前期酵母发酵产生的酒精转化为乙酸,产生基础风味物质。桑葚酵素发酵过程中不同发酵阶段的菌种演替、其它菌株的相互作用机理及某些菌株在发酵过程中的作用还有待深入研究。
