转基因大米TT51-1品系精准定量检测方法的比较研究
2020-05-24邓婷婷黄文胜葛毅强
邓婷婷 黄文胜 葛毅强 陈 颖*
(1 中国检验检疫科学研究院 北京100176 2 中国农业大学食品科学与营养工程学院 北京100083 3 科技部中国农村技术开发中心 北京100045)
目前世界各国出于经济、卫生、环保等各种目的,纷纷对转基因生物及其产品加强管理和检测。包括中国在内的50 多个国家和地区相继颁布并实行了“转基因标识制度”,对转基因生物及其加工产品进行标识和管理。近年来,随着各国有关转基因生物(Genetically Modified Organism,GMO)标签法的建立和不断完善,对食品中的GMO 含量下限有所规定。很多国家不但要求对转基因食品进行定性检测,还要对食品中的GMO 含量进行定量检测,以便标识,其标识的阈值一般在0.9%~5%之间[1-4]。而建立转基因产品的检测技术尤其是精准定量检测技术是实施转基因产品标识的技术前提。转基因成分的精准定量技术将随着全世界标识制度的完善和发展日趋重要。
我国转基因水稻研究处于国际领先水平,由我国自主研发的转基因抗虫水稻Bt 汕优63 品系是采用基因枪法将人工合成的Bt 基因cry1Ac/cry1Ab 导入受体水稻明恢63 基因组中经多代选育出来的,经抗虫试验,其防虫效果在95%以上[5-6]。2009年,转基因抗虫水稻Bt 汕优63(TT51-1)虽获得农业部颁发的湖北省安全生产证书[7],但尚未实现商业化种植,因此在大米及其制品的日常检测和出入境检测监管中,该品系是我国重点关注的对象之一,需要建立转基因大米及其制品的转基因成分精准检测方法。转基因大米种类及其遗传修饰的多样性使得其检测变得越来越困难,其定量检测的要求也越来越高。随着国内外检测分析水平的提高,转基因大米及其制品的检测方法也将从最初定性分析逐渐转为精准定量分析。作为具有商业化前景的转基因大米品系TT51-1,目前的定量分析仍采用实时荧光PCR法,该方法需要根据标准样品绘制的标准曲线来推测样品中的转基因含量,标准品、样品的核酸提取质量以及PCR 扩增效率等均会对定量结果产生影响,很难达到较高的精确度,尤其是转基因成分含量低于1%水平时[6,8-9],难以满足国际最低标识阈值0.1%[1]的检测需求。
数字PCR(digital polymerase chain reaction,dPCR)是在实时荧光PCR 基础上发展起来的微量DNA分子定量技术。1999年由Vogelstein 和Kinzler 首次提出数字PCR 的概念[10]。如今的数字PCR 技术借助微流体平台将样本分成大量(数百,数千甚至数百万个)微反应室,每个微反应室单独进行PCR 扩增后,再判定各个终产物的阴阳性。根据泊松分布原理来计算初始模板浓度[11]。由于数字PCR 不需要校准物,能准确测量低拷贝的DNA 分子,使得它成为有效的核酸精准定量工具,在医药、环境等领域广泛应用,如识别基因拷贝数的变异,低拷贝数核酸分子的检测,DNA 质量分析或检查单细胞水平的基因表达等[12-19]。目前有报道将数字PCR 技术用于转基因作物精准定量检测中[20]。Corbisier 等[21]最先将数字PCR 方法应用在转基因成分的定量中,该研究将转基因玉米Mon810 的数字PCR 定量结果与实时荧光定量结果相比较,定量结果较为一致。Burns 等[13]采用已验证的实时荧光PCR 反应体系,评估数字PCR技术的绝对检测限和定量限,也阐述了采用梯度预实验的方式可使数字PCR 更精确地测量拷贝数。Fu 等[22]利用数字PCR 对MON810 等多品系转基因作物的CaMV35s 启动子和NOS 终止子进行定量分析,结果表明其定量检测限为0.1%。Dobnik 等[23]利用微滴式数字PCR 方法分别建立两个多重定量方法,可对12 个品系的转基因玉米进行含量测定,其检出限、重复性和真实性均符合国际标准中GMO 定量要求。其它研究也证明数字PCR可定量分析玉米、大豆、油菜及烟草等作物中的转基因成分,这些研究结果均表明数字PCR 定量方法灵敏度高,准确度高于实时荧光PCR 方法[24-28]。
本研究以转基因抗虫大米(Oryza sativa L.)TT51-1 品系为研究对象,建立基于大米内标准基因SPS 和TT51-1 品系特异性基因的转基因大米TT51-1 数字PCR 定量检测方法,并应用于转基因大米及米制品检测中,以期为相关部门提供技术支持。
1 材料与方法
1.1 材料与试剂
转基因大米LL62 标准样品、转基因大豆Roundup Ready 标准样品、转基因玉米Bt11 标准样品,欧盟联合研究中心标准物质与测量研究所及美国油脂化学家协会;TT51-1、KF6、M12、克螟稻等转基因大米样品、野生型大米明恢63(非转基因)及其它实验样品均由本实验室保存。
2×微滴式数字PCR 预混液、微滴生成槽、微滴生成油等,美国Bio-Rad 公司;2×Taq PCR MasterMix,美国ABI 公司;食品基因组提取试剂盒NucleoSpinRFood,美国MN 公司。
1.2 仪器与设备
微滴式数字PCR 仪QX200 系统,美国Bio-Rad 公司;实时荧光PCR 仪7500,美国ABI 公司;Qubit 核酸蛋白分析仪,美国Thermo Scientific公司;样品研磨机,德国IKA 公司;离心机,美国Beckman Coulter 公司。
1.3 方法
1.3.1 基因组DNA 提取 分别将各种样品材料研磨至60 目粒度,按照食品基因组提取试剂盒NucleoSpinRFood 说明书进行DNA 提取并利用Qubit 核酸蛋白分析仪测定浓度。
1.3.2 引物和探针的设计及合成 为筛选适用于转基因大米TT51-1 数字PCR 定量的引物探针,根据大米蔗糖磷酸合成酶基因(sucrose phosphate synthase,SPS)和转基因大米TT51-1 品系外源插入片段与大米基因组3’端交界处的序列,设计3对SPS 基因引物探针和2 对TT51-1 品系特异性基因的引物探针,由英潍捷基(上海)贸易有限公司进行合成和标记(表1)。
1.3.3 扩增体系和反应参数 数字PCR 扩增体系:2×微滴式数字PCR 预混液10 μL,SPS 及TT51-1 基因正、反向引物各1 μL(终浓度0.32 μmol/L),SPS 基因探针0.5 μL(终浓度0.12 μmol/L),TT51-1 基因探针0.5 μL(终浓度0.2 μmol/L),DNA 模板5μL。
数字PCR 反应参数:按上述体系配制好的数字PCR 反应混合液,加入微滴生成槽的加样孔中,在其另一侧加入微滴生成油后放入QX 200TM微滴生成器中,由仪器按固定程序生成微滴。将生成的微滴移至PCR 扩增板中进行加膜密封后放入普通PCR 仪,扩增程序:95 ℃,5 min,1 个循环;95 ℃,15 s,60 ℃,1 min,60 个循环;98 ℃10 min,1 个循环;12 ℃保存。将扩增产物放入微滴读取仪中进行荧光检测和阴阳性微滴数的读取,采用Quantasoft 分析软件(美国Bio-Rad 公司)自动计算数字PCR 反应体系中的SPS 和TT51-1 转化体特异性基因的含量(copies/μL),再根据二者的比值计算得到样品中TT51-1 转基因成分含量(%)。

表1 SPS 和TT51-1 基因引物探针序列表Table1 The sequence of primers and probes of SPS and TT51-1
实时荧光PCR 扩增体系:2×Taq PCR 预混液10 μL,SPS 或TT51-1 基因正、反向引物各1μL(终浓度0.4 μmol/L),SPS 或TT51-1 基因探针0.5 μL(终浓度0.2 μmol/L),DNA 模板5 μL,利用ddH2O 补至20 μL。
实时荧光PCR 反应参数:95 ℃,10 min;95℃,10 s,60 ℃,45 s,45 个循环。
1.3.4 引物探针有效性和特异性 以转基因大米TT51-1 品系为扩增模板,非转基因大米明恢63和ddH2O 为对照,对SPS 基因的3 组引物探针和TT51-1 品系特异性基因的两组引物探针进行有效性扩增。分别选取SPS 和TT51-1 品系特异性基因扩增效率最高的引物探针组后,以非转基因大米明恢63、转基因大米TT51-1、KF6、KMD、LL62品系常见作物大豆、玉米、小麦、高粱、油菜为模板,ddH2O 为空白对照,对SPS-F2/R2/P2 引物探针组的特异性进行分析。以100% TT51-1 转基因大米、1% TT51-1 转基因大米、非转基因大米明恢63、转基因克螟稻、KF6、M12、LL62、转基因大豆Roundup Ready、转基因玉米Bt11 为模板,ddH2O 为空白对照,对TT51-F2/R2/P2 引物探针组的特异性进行分析。
1.3.5 TT51-1 转基因大米定量的绝对灵敏度和相对灵敏度 将转基因大米TT51-1 DNA 溶液测定浓度进行2 倍梯度稀释,直至内、外源基因含量均为2 copies/μL,即分别稀释至3 pg 及1 pg(大米单个基因组质量约为0.5 pg)。共稀释4 个梯度,每个梯度4 个重复试验,进行内源基因SPS 和外源基因TT51-1 的双重数字PCR 检测。根据内、外源基因的定量值(数字PCR 测得的基因含量)和理论值(根据Qubit 核酸蛋白分析仪测得的DNA 浓度计算出的基因含量)绘制相关性曲线。
利用上述试验建立的双重数字PCR 定量体系,对非转基因大米及质量分数分别为0.1%,1%,10%的转基因大米TT51-1 样品的内、外源基因分别进行定量检测(3 次重复),根据仪器通过泊松分布原理计算出的内、外源基因含量(copies/μL),获得各样品的实际含量。
1.3.6 TT51-1 转基因大米数字PCR 定量方法的精密度和重复性 针对质量分数低至0.1%,1%的TT51-1 转基因大米样品开展转基因成分定量,每个样品重复3 次,共设置6 个平行。根据内、外源基因拷贝数计算其SD、RSD 及相对偏差。
1.3.7 TT51-1 转基因大米实时荧光PCR 方法定量结果 根据TT51-1 转基因成分质量分数为100%,10%,5%,0.5%及0.1%的标准样品制作内、外源基因的标准曲线,对质量分数0.1%,1%,10%的转基因大米TT51-1 样品DNA 进行实时荧光PCR 扩增并定量分析,与数字PCR 定量结果进行比较。
1.3.8 方法验证 在相同的测试环境和验证方法下,基于芯片式数字PCR 平台,两位试验操作人员做两组平行试验。每个样品设3 次重复,对质量分数为0.1%,0.5%,1%,5%的标准样品进行芯片式数字PCR 定量研究。针对扩增微反应体系的分布情况,内、外源基因的定量拷贝数等逐一进行分析。
2 结果与分析
2.1 引物探针的有效性和特异性分析
所有SPS 和TT51-1 基因引物探针组的实时荧光PCR 扩增结果表明,SPS 基因的3 组引物探针和TT51-1 品系特异性基因的两组引物探针均能有效扩增出各自对应的靶基因,SPS 基因F2/R2/P2 引物探针组和TT51-1 基因RB-F2/R2/P2引物探针组信号最强(图1)。
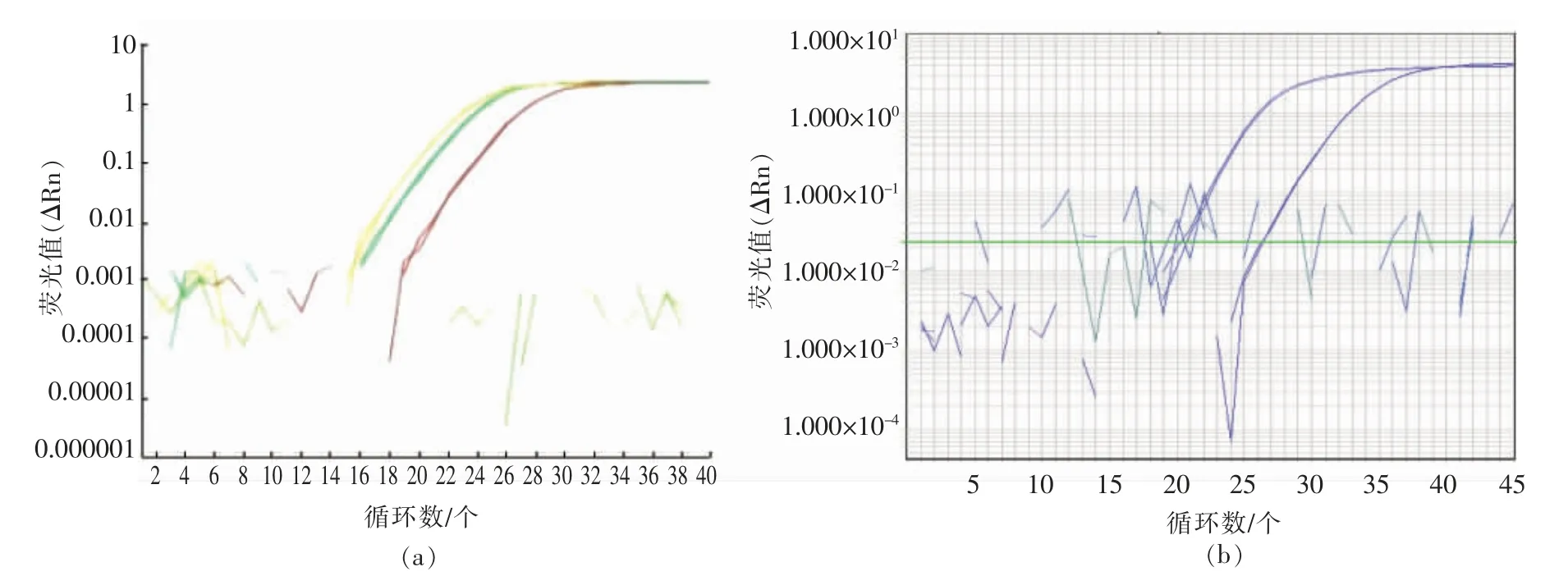
图1 SPS 及TT51-1 品系特异性基因各组引物探针筛选图Fig.1 The effectiveness of the primers and probes of SPS and TT51-1 event-specific genes
为保证后续数字PCR 反应能到达最大效率,选取SPS-F2/R2/P2 和TT51-F2/R2/P2 两组引物探针,对其特异性进行验证。SPS-F2/R2/P2 引物探针组仅能扩增出大米成分,对其它禾本科植物玉米、小麦及大豆、玉米等作物均无扩增。TT51-F2/R2/P2 引物探针组仅能扩增出TT51-1 转基因成分,其它转基因大米克螟稻、KF6、M12、LL62,转基因大豆Roundup Ready、转基因玉米Bt11、阴性对照(非转基因大米明恢63)和空白对照(ddH2O)均无扩增(图2),即SPS-F2/R2/P2 和TT51-F2/R2/P2 引物探针组只能分别扩增大米和转基因大米TT51-1 成分,其特异性均较好。
2.2 TT51-1 转基因大米品系定量绝对灵敏度
在所有稀释梯度中,SPS 和TT51-1 基因定量体系的相对标准偏差(relative standard deviation,RSD)分别在0.63%~2.62%和0.96%~3.62%之间,所有稀释梯度的RSD 值均远小于25%,符合目前最严格的国际标准和欧盟定量方法要求[30-31]。其内、外源基因稀释梯度曲线的R2分别为0.9998和0.9995,远高于实时荧光PCR 定量要求的中0.98[31],该体系所检测的浓度梯度均具有很好的线性关系(图3a)。由于TT51-1 是母本非转基因水稻和父本转基因水稻华恢1 号纯合子杂交产生的杂合子(F1 代),其米粒(胚乳)中含有2 倍的母本基因组和1 倍的父本基因组,因此SPS/TT51-1 基因之比的理论值应为0.33。而实际结果中,SPS/TT51-1 基因拷贝数的比值在0.31~0.36 之间,其相对误差在6%~9%之间(图3b),即大米基因组在2~2 000 copies/μL 范围时,定量的结果与理论值相符,该检测体系能够对含量低至2 copies/μL 的转基因大米TT51-1 进行准确定量。
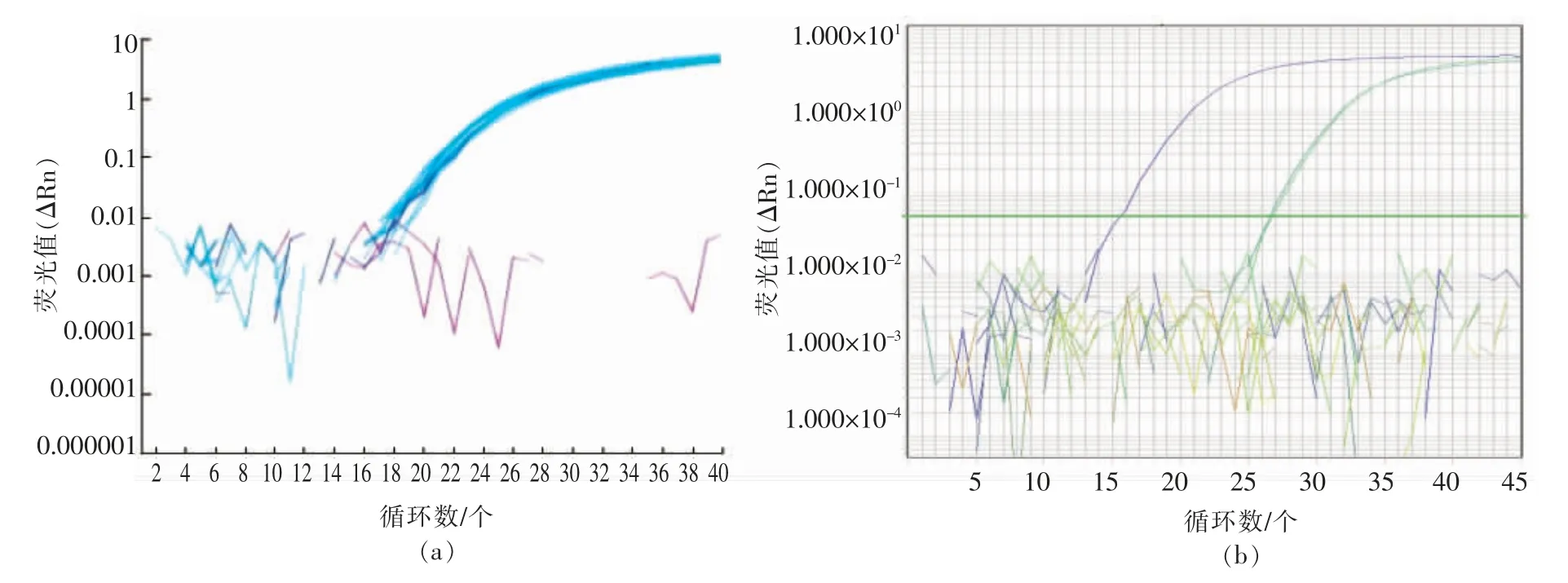
图2 SPS-F2/R2/P2 及TT51-F2/R2/P2 引物探针组特异性扩增图Fig.2 The specificity of primers and probes of SPS-F2/R2/P2 and TT51-F2/R2/P2
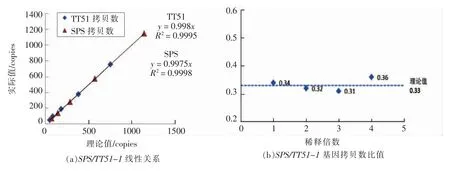
图3 TT51-1 转基因大米品系定量检测线性关系及其绝对定量灵敏度Fig.3 Linear relationship and absolute sensitivity of quantitative detection of GM rice event TT51-1
2.3 TT51-1 转基因大米数字PCR 定量方法的精密度和重复性
为了测试方法的精密度,对质量分数为0.1%和1%的样品进行数字PCR 扩增。含量为0.1%的6 个TT51 大米平行样品的定量结果分别为(0.098%±0.0073)%,(0.102±0.0093)%,(0.110±0.006)5%,(0.102±0.0027)%,(0.091 ±0.0043)%,(0.108±0.0034)%,所有样品的3 次重复RSD 在7.30%~18.63%之间,与理论含量值的偏差在-8.77%~9.62%之间。含量为1%的6 个TT51大米平行样品的定量结果分别为(1.111±0.034)%,(0.957 ± 0.051)%,(1.143 ± 0.016)%,(0.922 ±0.012)%,(1.090±0.047)%,(0.987±0.054)%,所有样品的3 次重复RSD 在3.66%~7.98%之间,与理论含量值的偏差在-7.84%~14.28%之间。两种低含量的TT51 大米样品的相对偏差和RSD 值均远小于常规定量要求的25%,表明该方法即使在对低含量的样品进行重复定量时,其精密度和稳定性均较为理想。在样品配制时,只要保证混合均匀,即使GM 成分含量较低,也能利用数字PCR方法进行准确定量(图4)。

图4 TT51-1 样品6 次重复定量结果Fig.4 Quantitative results of 6 replicates of GM rice TT51-1
2.4 转基因大米TT51-1 数字PCR 与实时荧光PCR 方法定量结果比较
分别以数字PCR 与实时荧光PCR 方法对质量分数为0.1%和1%、10%的转基因大米TT51-1样品进行定量。数字PCR 定量结果中各样品TT51-1 含量分别为(0.122±0.0043)%,(0.996±0.0303)%和(9.954 ± 0.1067)%,其与实际值的偏差分别为-1.31%,-2.95%,21.26%。各样品多次重复试验中,1%,10%样品的RSD 值均小于5%,0.1% RSD 值也符合要求,表明本研究建立的微滴式数字PCR 定量方法对转基因大米TT51-1 的定量灵敏度达0.1%(质量分数),其定量准确性和精密度符合国际通用要求(表2)。
实时荧光PCR 定量分析中,当内、外源基因PCR 扩增效率分别为97.16%和102.35%,内、外源基因的标准曲线R2都在0.99 以上,且各样品内、外源基因的3 次重复RSD 值在1.08%~18.32%之间时,各质量分数定量值分别为(0.130±0.0022)%,(1.255±0.0229)%,(9.917±0.1630)%,其与实际值的偏差分别达到-0.83%,25.45%,29.77%(表2)。
实时荧光PCR 方法绘制的两条标准曲线相关性及内、外源基因的PCR 扩增效率符合要求,当目标样品含量为10%时,定量结果较为准确,而当样品含量低至1%时,定量结果出现偏差。数字PCR 即使针对含量为0.1%的样品,其偏差也不超过国际转基因定量方法要求的25%。就定量分析来说,数字PCR 的定量准确性及灵敏度要好于实时荧光PCR。
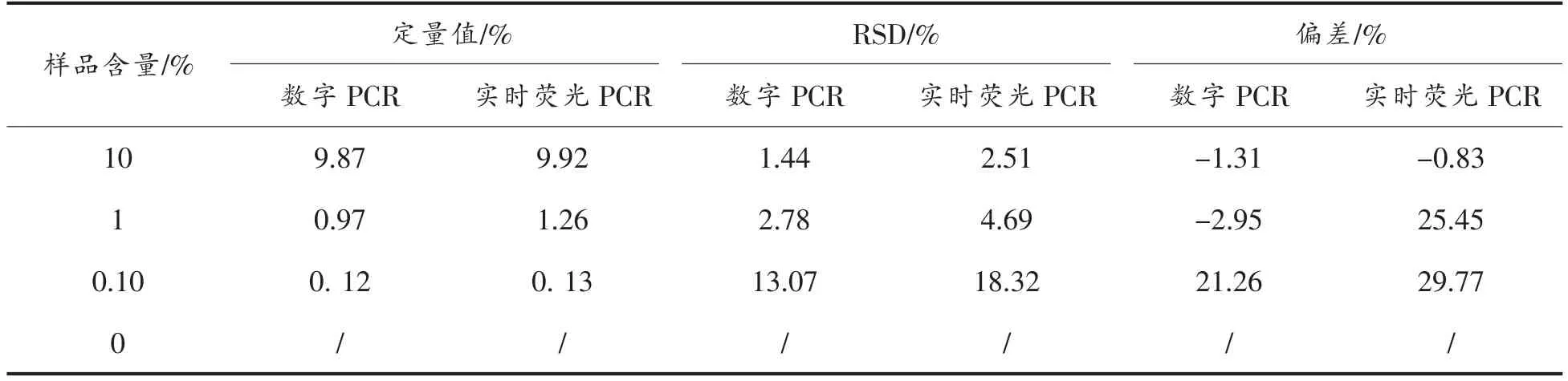
表2 不同含量TT51-1 大米样品数字PCR 定量结果Table2 Quantitative results of different samples of GM rice event TT51-1 by digital PCR
2.5 方法验证
为验证本研究建立的微滴式数字PCR 定量方法的准确性和精密度,在相同的测试环境和验证方法下,基于芯片式数字PCR 平台,两位试验人员做两组平行试验,每个样品设3 次重复,对质量分数为0.1%,0.5%,1%,5%的标准样品进行芯片式数字PCR 定量检测。经优化,Quantstudio 3D芯片式数字PCR 平台上的内、外源基因空白对照均未出现非特异信号时,所有含量的TT51-1 样品在芯片式数字PCR 平台上所产生的阴性点和阳性点分离较好,无中间模糊区(图5),所有重复样品的系统精确性均在10%以内(Quantstudio 3D系统自动计算,数据未列出)。
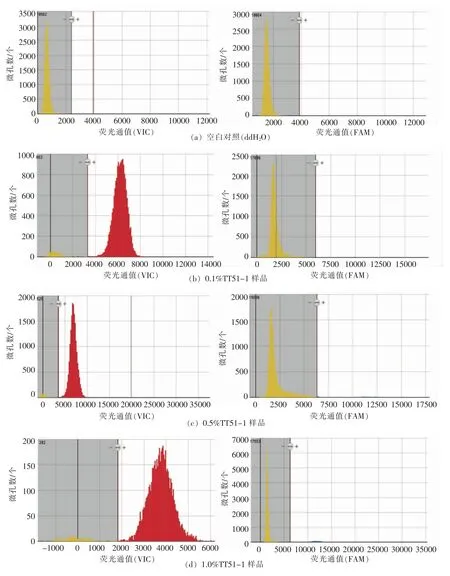

图5 不同含量TT51-1 样品在芯片式数字PCR 平台的定量结果Fig.5 Quantitative results of different contents of GM rice event TT51-1 by chip-based digital PCR
经计算,质量分数为1%和5%样品的定量结果与理论值的偏差都在5%内,3 次重复的RSD 值都远远小于极限值25%,表明本方法对这两组样品的定量精准。而质量分数为0.1%和0.5%的样品定量结果与理论值的偏差虽都大于10%,但小于极限值25%(表3),且重复性较好。本方法精准定量检测灵敏度达0.1%,定量方法精密度和准确性符合要求。
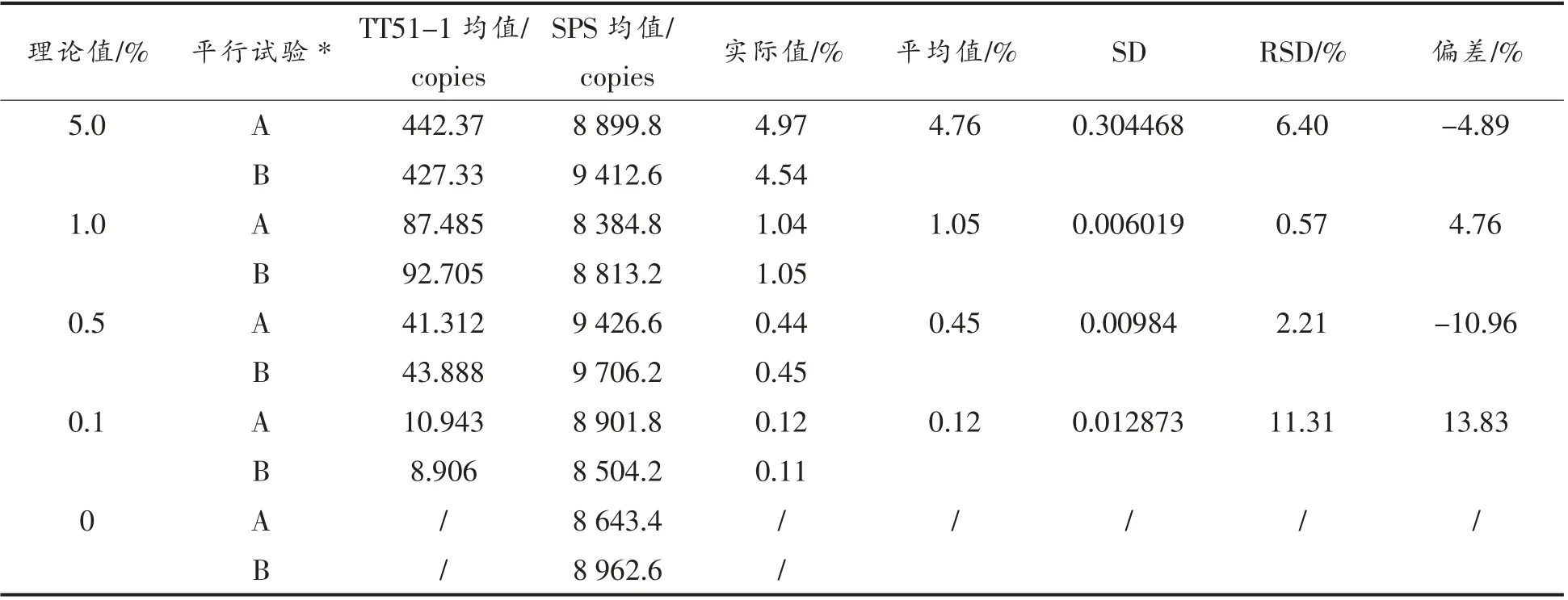
表3 转基因大米TT51-1 样品芯片式数字PCR 平台定量结果Table3 Quantitation of TT51-1 rice by chip-based digital PCR
3 结论与讨论
实时荧光PCR 在进行转基因产品定量时是根据已知浓度转基因标准品的含量及其扩增Ct值制作标准曲线后,将未知浓度的转基因样品扩增结果带入标准曲线进行含量计算。PCR 扩增效率、反应抑制物及标准品和样品之间的背景差异等因素都引入偏差,导致其定量结果往往与实际值相差较大[13,21]。而数字PCR 技术是通过绝对定量样品中的内参考基因和品系特异性基因的拷贝数,根据二者的比例直接计算出转基因含量,无需标准品和标准曲线,因此比实时荧光PCR 依靠标准曲线来确定转基因成分含量更加准确。数字PCR 因采用稀释后独立扩增的反应方式,故降低了DNA 溶液中酶活抑制物的浓度,与实时荧光PCR 相比提高了低含量样品的检测灵敏度。此外,数字PCR 采用扩增结束后直接计数的方法进行对靶标基因定量,其试验操作的条件较为宽松。本研究采用与实时荧光PCR 同样的引物探针和扩增参数,最终的定量结果却比实时荧光PCR 更加准确、灵敏,也证明了这一点。本研究建立的数字PCR 方法在转基因大米TT51-1 成分定量检测中具有比实时荧光PCR 更大的应用价值。
定量分析方法在实际检测中进行应用时,测量不确定度的分析具有重要的实际意义。之前的研究表明,基于实时荧光PCR 的转基因成分定量过程中,由于内、外源基因扩增效率不一致带来的不确定度以及采用低浓度标准品绘制标准曲线带来的不确定度是测量不确定度的主要来源,其次是批内重复的不确定度[32-33]。该方法定量的动态范围也受到极大地限制。而在数字PCR 中,由于无需标准曲线对样品进行定量,因此该部分不确定度可认定为0。Bhat 等[34]认为反应室的容量是不确定度的主要来源,评定其相对不确定度在6%以下。这项发现可以用于其它数字PCR 测量的置信水平研究。总之,与实时荧光PCR 方法相比,影响其不确定度的主要因素已经改变。尽可能保证抽制样的科学性和样品批内的重复性,则可以减小定量的偏差和不确定度。
