副干酪乳杆菌TD062对Ⅱ型糖尿病小鼠的降糖作用
2020-05-24姜毓君党芳芳潘瑞丽陈思涵林官根张雅硕满朝新
张 宇 姜毓君 党芳芳 潘瑞丽 陈思涵 林官根 张雅硕 满朝新 张 微
(东北农业大学食品学院 乳品科学教育部重点实验室 哈尔滨150030)
糖尿病是一种以高血糖为特征的代谢性疾病,根据世界卫生组织报道,Ⅱ型糖尿病患病人群约占总患病人数的90%以上,因胰岛素抵抗或胰岛素相对不足而造成高血糖,并往往伴有其他并发症[1]。研究表明,氧化应激导致胰岛细胞受损及外周胰岛素抵抗,是产生高血糖的重要原因[2]。氧化应激还可以激活相关信号通路,调控相关因子表达,调节糖代谢水平[3]。
目前常见的降血糖药有磺脲类药物、双胍类药物、胰岛素增敏剂和α-葡萄糖苷酶抑制剂等药物。这些药物在治疗疾病的同时也易引起一些副作用,如:头晕、头痛、腹痛、肠胀气和腹泻等不良反应[4]。近年来有研究表明益生菌具有一定的降糖功效。例如:孟晓等[5]研究表明植物乳杆菌SCS1 可以降低高血糖水平,并显著提高葡萄糖耐量。Yadav 等[6]证实嗜酸乳杆菌和干酪乳杆菌有效降低糖尿病大鼠的血脂水平。
本试验中采用的副干酪乳杆菌(Lactobacillus paracasei,L.paracasei)TD062 是由实验室工作人员分离自西藏地区的乳制品中。通过灌胃不同浓度的副干酪乳杆菌TD062,研究其对Ⅱ型糖尿病模型小鼠的体重、脏器指数、血糖水平、葡萄糖耐受性和抗氧化指标的影响。通过测定胰岛素信号通路中的相关基因表达水平,探究其降血糖机制,为副干酪乳杆菌应用于保健食品研发提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
副干酪乳杆菌TD062,从西藏地区发酵乳制品中筛选、分离、保存;3 周龄C57BL/6J 雄性小鼠及高脂高糖饲料,北京维通利华实验动物技术有限公司;链脲佐菌素(Streptozocin,STZ),美国Sigma 公司;MRS 培养基,青岛海博生物技术有限公司;肝糖原、超氧化物歧化酶(superoxide diamutase,SOD)、丙 二 醛(malonyldialdehyde,MDA)及谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒,南京建成生物工程研究所;动物组织总RNA 提取试剂盒,天根生化科技(北京)有限公司;PrimeScriptTMRT reagent Kit 和SYBRRPremix Ex TaqTMⅡ试剂盒,宝生物工程有限公司。
1.2 仪器与设备
血糖仪及试纸,艾科生物技术有限公司;ABI 7500 实时荧光定量PCR 仪,美国Applied Biosystems 公司;DHP-9272 型电热恒温培养箱,上海一恒科技有限公司。
1.3 试验方法
1.3.1 试验菌种制备 将保存于-80 ℃的副干酪乳杆菌TD062 按3%接种量接种至MRS 液体培养基中,37 ℃培养18 h,连续活化3 代后,在4 ℃条件下6 000×g 离心5 min,弃上清,将菌泥用灭菌的生理盐水洗涤两次,然后悬浮于pH 7.4 的0.01 mmol/L 生理盐水中,调整菌含量为109,108CFU/mL 和107CFU/mL,置于4 ℃保存备用。
1.3.2 高血糖模型小鼠诱导和分组 实验动物:选用40 只雄性C57BL/6J,鼠龄3 周左右,随机分为5 组(每组8 只):正常组(N)、模型组(DM)、高剂量组(H)、中剂量组(M)和低剂量组(L)。鼠房温度(22 ± 2)℃,湿度(55±5)%,12 h 昼夜交替,基础饲料适应性喂养1 周。从第2 周开始,DM、H、M和L 组喂养高脂高糖饲料。3 周后,DM、H、M 和L 组腹腔注射STZ 100 mg/kg,建立糖尿病模型,N组注射相同剂量的柠檬酸缓冲液作为对照。造模1 周后,测定小鼠随机血糖,以血糖值高于11.1 mmol/L 的为模型成功小鼠。以10 ml/kg 的剂量分别灌胃H、M 和L 组109,108CFU/mL 和107CFU/mL 副干酪乳杆菌TD062,N 组和DM 组灌胃相同剂量的生理盐水。
1.3.3 小鼠体重的测定 实验第1 周开始至结束期间每周测定小鼠体重。
1.3.4 小鼠血糖值及糖耐量测定 实验第1 周开始至结束期间每周测定小鼠血糖值。实验第13 周时,小鼠隔夜禁食不禁水12 h,以2 g/kg 的剂量灌胃葡萄糖溶液,分别测定0,15,、30,60,90 min 和120 min 时小鼠血糖值,计算葡萄糖曲线下面积(area under the curve,AUC)。
1.3.5 动物血液及组织采集和处理 实验结束时,5 组小鼠均隔夜禁食12 h,称重,眼球取血,将血液样品在4 ℃条件下3 000×g 离心10 min,收集血清置于-80 ℃保存备用。
对小鼠眼球取血后,断颈处死。解剖并迅速取出肝脏、脾脏和肾脏于冰冷的生理盐水中冲洗,用滤纸吸干后称重,按下列公式计算小鼠的脏器指数:
脏器指数=脏器质量(g)/体重(100 g)。
1.3.6 血清中糖尿病相关指标的测定 采用酶标仪测定小鼠血清中糖基化血红蛋白和胰岛素的含量,具体方法参见相应的试剂盒说明书。
1.3.7 肝脏中相关指标的测定 按照Sadi 等[7]的方法制备肝匀浆。肝脏组织与0.1 mmol/L 磷酸盐缓冲溶液按质量比1∶10 的比例混匀,用匀浆机进行匀浆,10 000×g 离心10 min,收集上清液,测定SOD、MDA、GSH-Px 和肝糖原的含量。
1.3.8 糖原合成酶激酶-3β(glycogen synthase kinase 3β,GSK-3β)基因表达量的测定 按照动物组织RNA 提取试剂盒说明书提取小鼠肝脏中RNA,用核酸测定仪测定RNA 浓度,按照反转录试剂盒说明书方将RNA 反转录为cDNA,然后以cDNA 为模板进行荧光定量PCR 分析,引物序列为:β-actin-F:5’-CGTGAAAAGATGACCCAGA-3’;β-actin-R:5’-GTCCATCACAATGCCTGT-3’;GSK-3β-F:5’-GCCAATGCAGAGGTCCTAAA-3’;GSK-3β-R:5’-CGAAAGGGAAGAGAAGGTAACA-3'。
1.4 统计分析
实验数据均以平均值±标准差表示,利用SPSS 17.0 软件对数据进行统计分析,以P<0.05为显著差异水平。
2 结果与分析
2.1 副干酪乳杆菌TD062 对小鼠体重的影响
副干酪乳杆菌TD062 对小鼠体重的影响见图1。实验期间,正常组小鼠体重先增加后趋于平缓。在1~4 周时,喂食高脂高糖饲料的小鼠体重不断增加,且始终高于正常饮食的小鼠体重。第5 周时,小鼠腹腔注射STZ 诱导糖尿病模型,结果糖尿病小鼠体重连续3 周出现下降趋势,推测可能是STZ 药效发挥的时间较长,小鼠耐受性较差所致。从第8 周开始,糖尿病小鼠体重开始持续性上升,灌胃高剂量副干酪乳杆菌TD062 的小鼠体重增长趋势明显高于低剂量组、中剂量组和模型组,且具有显著性差异(P<0.05)。初步推测副干酪乳杆菌TD062 对糖尿病症状具有良好的改善作用。
2.2 副干酪乳杆菌TD062 对小鼠血糖值的影响
由图2可以看出,腹腔注射STZ 后,小鼠血糖值迅速增加且远高于正常水平,说明糖尿病小鼠模型诱导成功。在灌胃1~2 周(实验第6~7 周)时,小鼠血糖值变化不明显,推测是由于注射STZ 对小鼠的影响远大于副干酪乳杆菌TD062 的改善作用或者是因为灌胃时间较短,所以效果不明显。从灌胃第3 周(实验第8 周)开始,小鼠血糖值出现明显的下降趋势,且灌胃高剂量副干酪乳杆菌TD062 组的血糖值显著低于中剂量和低剂量组(P<0.05)。实验结束时,灌胃高剂量组的小鼠血糖值降至11.7 mmol/L,而模型组小鼠血糖值高达20.3 mmol/L。实验结果表明副干酪乳杆菌TD062可在一定程度上降低高血糖水平,延缓糖尿病的发生。这与Manaer 等[8]研究的双峰驼驼乳可以改善糖尿病小鼠血糖值的结果一致。
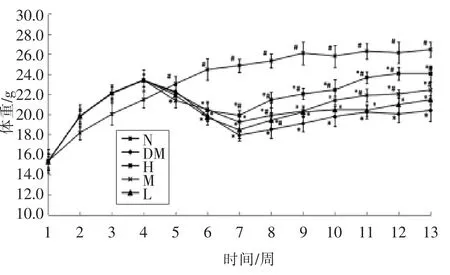
图1 副干酪乳杆菌TD062 对小鼠体重的影响Fig.1 Effect of L.paracasei TD062 on body weight of diabetic mice

图2 副干酪乳杆菌TD062 对小鼠血糖值的影响Fig.2 Effect of L.paracasei TD062 on glucose of diabetic mice
2.3 副干酪乳杆菌TD062 对小鼠糖耐量的影响
通过口服糖耐量实验了解胰岛β 细胞功能和机体对葡萄糖的调节能力[9],该方法被广泛应用于临床实践中。从图3a 可以看出,正常组小鼠在灌胃葡萄糖15 min 时血糖值达到顶峰值(10.7 mmol/L),然后迅速下降并恢复至正常值。其它4组的血糖均在30 min 时达到最大值,且和正常组相比具有显著性差异(P<0.05)。灌胃葡萄糖30 min 后,血糖开始呈缓慢下降趋势,2 h 后血糖值仍未恢复至原始状态。AUC 葡萄糖代表葡萄糖曲线下面积,可以直观地判断机体对葡萄糖的耐受性。从图3b 可以看出,糖尿病小鼠的AUC 葡萄糖明显高于正常组。与模型组相比,高剂量和中剂量组具有显著性差异(P<0.05),低剂量组虽在一定程度上可以增强葡萄糖耐受能力,但变化不明显。试验结果表明副干酪乳杆菌TD062 可以改善糖尿病小鼠的葡萄糖耐受性,且这种作用呈现剂量依赖性。
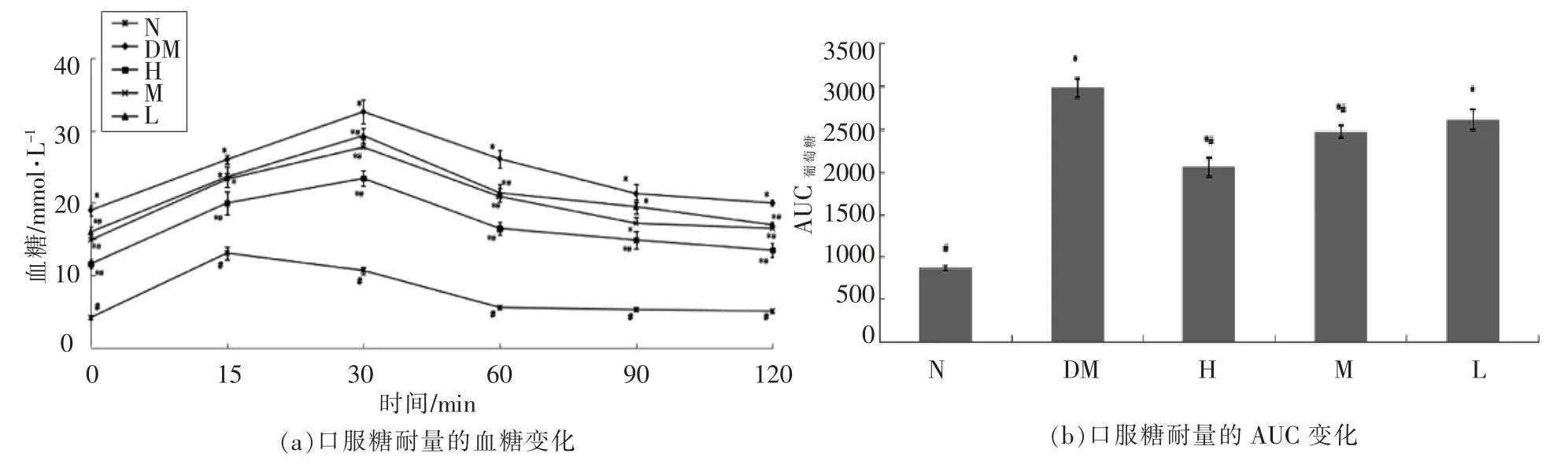
图3 副干酪乳杆菌TD062 小鼠糖耐量的影响Fig.3 Effect of L.paracasei TD062 on glucose tolerance of diabetic mice
2.4 副干酪乳杆菌TD062 对小鼠脏器指数的影响
肝脏是糖代谢发生的主要器官,在机体血糖的调节中发挥很重要的作用[10]。与正常组相比,患病组中的肝脏指数增加,说明糖尿病小鼠出现明显的肝脏肿胀现象,导致肝脏功能异常。由表1可知,副干酪乳杆菌TD062 灌胃8 周后,患病组小鼠肝脏指数呈现下降趋势,其中灌胃高剂量组中肝脏指数下降趋势最明显(P<0.05),中剂量组次之。脾脏是机体最大的免疫器官,是细胞免疫和体液免疫的中心。由表1可以看出,患病组中出现脾脏增大现象,可能导致机体免疫功能降低。经副干酪乳杆菌TD062 干预后,高、中、低剂量组可显著性降低脾脏指数(P<0.05),增强机体免疫能力。同时,副干酪乳杆菌TD062 也可抑制肾脏指数的增加,与模型组相比,治疗组不具有显著性差异(P>0.05)。综上,副干酪乳杆菌TD062 可在一定程度上抑制脏器指数的增加,对器官具有一定的保护作用,减少糖尿病并发症。
2.5 副干酪乳杆菌TD062 对糖尿病相关指标的影响
胰岛素是由胰岛β 细胞分泌而来,主要作用在肝脏、肌肉和脂肪中,控制着体内糖类、蛋白质、脂肪的合成和代谢。胰岛素具有促进肝糖原合成,降低血糖的功能。图4a 显示,患病组中胰岛素含量明显高于正常组,这可能是由于体内存在胰岛素抵抗,造成胰岛素不能被机体组织有效利用,因此发生胰岛素代偿性增加的现象。副干酪乳杆菌TD062 灌胃8 周后,小鼠体内胰岛素含量降低,可能是胰岛素抵抗减轻,机体组织对胰岛素的利用增加,因此胰岛素的合成与分泌减少。Tabuchi等[11]研究表明鼠李糖乳杆菌可以显著降低Ⅱ型糖尿病小鼠中的胰岛素水平,这与本研究结果一致。

表1 副干酪乳杆菌TD062 对糖尿病小鼠脏器指数的影响Table1 Effect of L.paracasei TD062 on organ coefficient of diabetic mice
糖基化血红蛋白可反映一段时间内的平均血糖浓度。从图4b 可以看出,与正常组相比,患病组中的糖基化血红蛋白水平明显增加(P<0.05),灌胃副干酪乳杆菌TD062 后,糖基化血红蛋白水平呈下降趋势,其中高剂量组中的下降趋势最明显,中、低剂量组次之,说明副干酪乳杆菌TD062 具有降低血糖的作用并表现为剂量依赖性。

图4 副干酪乳杆菌TD062 对胰岛素和糖基化血红蛋白含量的影响Fig.4 Effect of L.paracasei TD062 on the levels of glycosylated hemoglobin and insulin
2.6 副干酪乳杆菌TD062 对肝脏指标的影响
氧化应激可以损伤蛋白质、脂质和DNA 等大分子物质,是疾病和衰老的重要因素[6]。氧化应激易导致自由基产生和抵御机制之间的不平衡,直接损伤胰岛β 细胞[12]。同时,由高血糖引起的活性氧簇活化与破坏胰岛素信号通路导致胰岛素抵抗,从而导致糖尿病的发生[13-14]。Li 等[15]研究表明植物乳杆菌X1 能够提高糖尿病小鼠的抗氧化能力,改善胰腺受损情况。由表2可知,模型组中SOD 和GSH-Px 的含量明显下降,自由基清除能力降低。MDA 是脂质过氧化物的重要产物,可以反映机体组织受到自由基攻击的程度。与正常组相比,模型组中的MDA 含量高于正常水平。副干酪乳杆菌TD062 干预8 周后,SOD 和GSH-Px 的含量显著提高,MDA 含量明显下降。结果表明,副干酪乳杆菌TD062 可以提高肝脏抗氧化能力,降低脂质过氧化程度,保护机体免受自由基的攻击。
肝糖原的主要合成部位为肝脏,胰岛素抵抗抑制肝糖原的生物合成,造成机体外周葡萄糖水平升高,外周葡萄糖水平的升高又会加剧胰岛素抵抗,导致糖尿病的发生。由表2可知,经副干酪乳杆菌TD062 干预后,糖尿病小鼠中的肝糖原含量增加,这可能是由于胰岛素抵抗减轻,机体对胰岛素的利用增强,同时肝脏指数降低,肝脏肿胀现象减弱,肝功能增强,从而使肝糖原含量增加。

表2 副干酪乳杆菌TD062 对糖尿病小鼠肝脏中抗氧化指标和肝糖原含量的影响Table2 Effect of L.paracasei TD062 on liver antioxidant index and glycogen levels
2.7 副干酪乳杆菌TD062 对GSK-3β 表达量的影响
GSK-3β 是一种丝氨酸/苏氨酸激酶,在糖代谢和胰岛素信号传导过程中发挥着重要的作用。胰岛素与细胞表面的胰岛素受体结合后,促使胰岛素信号通路发生级联反应,使PI3K 和Akt 发生磷酸化,活化PI3K/Akt 信号通路[16-17]。研究表明,活化的Akt 可以磷酸化GSK-3β 并使之失活,肝糖原合成酶因此发生去磷酸化,恢复催化肝糖原合成的能力,增加肝糖原含量,降低血糖水平[18]。糖原合成酶是糖原合成过程中的限速酶,其上游信号分子GSK-3β 通过调控糖原合成酶的磷酸化状态,从而改变合成肝糖原的能力。由图5可知,患病组中的GSK-3β 相对表达量增加,副干酪乳杆菌TD062 干预8 周后,小鼠肝脏中GSK-3β 的相对表达量下降,说明副干酪乳杆菌TD062 可能通过调控胰岛素信号通路改善胰岛素抵抗,从而使糖原合成酶的活性提高,调节糖代谢水平,增加肝糖原含量。这与上述实验结果是一致的。
3 结论

图5 副干酪乳杆菌TD062 对肝脏中GSK-3β表达量的影响Fig.5 Effect of L.paracasei TD062 on relative expression of GSK-3β in liver
本研究表明,副干酪乳杆菌TD062 可在一定程度上改善Ⅱ型糖尿病症状和相关指标。初步推测是由于副干酪乳杆菌TD062 通过调控胰岛素信号转导通路,调节相关因子的表达,从而改善胰岛素抵抗,调节糖代谢。同时通过提高Ⅱ型糖尿病中的氧化应激水平,可有效预防Ⅱ型糖尿病的发生。
