高糖胁迫下蜂蜜接合酵母碳代谢流的研究
2020-05-24刘功良朱宝生高苏娟白卫东费永涛艾连中俞剑燊
刘功良 朱宝生,2 高苏娟 刘 锐 白卫东 费永涛 艾连中 俞剑燊 郭 波
(1 仲恺农业工程学院轻工食品学院 广州510225 2 广西轻工业科学技术研究院有限公司 南宁530031 3 上海理工大学医疗器械与食品学院 上海200093 4 上海金枫酒业股份有限公司 上海200120 5 广东石湾酒厂集团有限公司 广东佛山528031)
随着工业水平的发展,工业乙醇的生产越来越偏向于浓醪发酵。与传统发酵相比,浓醪发酵能提高设备利用率,降低能耗,节约成本,提高产物生成率[1-4]。鉴于这些优点,浓醪发酵的研究备受关注。近年来,为使底物更加有效地转化成目标产物,细胞内部的代谢流分布成为研究的重点[5-6]。代谢流分析是代谢网络分析的重要组成,是代谢工程中用以指导遗传操作的重要手段[7-8]。作者从蜂蜜中筛选获得1 株可耐受700 g/L 葡萄糖质量浓度的蜂蜜接合酵母(Zygosacharomyces mellis,Z.mellis)LGL-1,鉴定其种属与抗逆性能,同时对蜂蜜接合酵母LGL-1 的发酵性能进行初步探讨[9]。本文以蜂蜜接合酵母LGL-1 为研究对象,考察其在高糖胁迫下的代谢流,旨在为深入研究酵母菌高糖胁迫应激机制,耐高糖酵母的代谢调控和菌种工业化改造提供理论依据。
1 材料与仪器
1.1 菌种
蜂蜜接合酵母LGL-1,保存于中国典型培养物保藏中心。
1.2 培养基
1)高糖培养基[7]称取13 g 麦芽汁,78 g 葡萄糖,溶于100 mL 去离子水中,可得到400 g/L 的高糖培养基,于70 ℃水浴摇匀,溶解后115 ℃灭菌20 min。
2)常规培养基 称取13 g 麦芽汁,27 g 葡萄糖,溶于100 mL 去离子水中,可得到100 g/L 的常规培养基,于70 ℃水浴摇匀,溶解后115 ℃灭菌20 min。
1.3 主要试剂
蒽酮、海藻糖、甘油、乳酸、苹果酸、柠檬酸、α-酮戊二酸,阿拉丁生化科技股份有限公司;硫酸,天津市福晨化学试剂厂。
1.4 主要设备与仪器
SHZ-82 水浴恒温摇床,常州市国立试验设备研究所;G716-3 小型台式离心机,广州市正一有限公司;722G 可见光分光光度计,上海一恒科学仪器有限公司;JJ600 精密电子天平,常熟双杰测试仪器厂;LC-20A 液相色谱仪,岛津企业管理(中国)有限公司。
2 试验方法
2.1 蜂蜜接合酵母代谢产物的测定
取活化后的蜂蜜接合酵母LGL-1,以10%接种量接入高糖浓度培养基中,初始pH6.0,30 ℃发酵96 h 后,用比重法测发酵液的酒精浓度[10],用HPLC 检测酵母细胞中有机酸(苹果酸、α-酮戊二酸、乳酸、柠檬酸)的浓度[11],采用高碘酸钠-乙酰丙酮法测定酵母细胞中甘油的浓度[12-13],采用硫酸蒽酮法测定酵母细胞内海藻糖的浓度[14-15]。重复检测3 次,利用SPSS 软件统计分析数据。
HPLC 的操作条件和参数:选用(NH4)2HPO4为无机盐缓冲液,经磷酸调解节后超声波脱气30 min,调缓冲液pH 值至3.0。甲醇为有机相,设定V0.01mol/L(NH4)2HPO4∶V甲醇=95%∶5%为流动相,检测波长213 nm,柱温30 ℃,流速0.8 mL/min,进样体积10 μL。称量400 mg 苹果酸、200 mg α-酮戊二酸、320 mg 乳酸、200 mg 柠檬酸,用超纯水定容100 mL。取混合标准样品各2,4,6,8,10 μL,分别平行进样3 次。以含量为横坐标,峰面积为纵坐标,绘制标准曲线,得到回归线方程。取蜂蜜接合酵母LGL-1 在不同糖度条件下的发酵液,4 ℃、8 000 r/min 离心10 min,取上清,用0.22 μm 滤膜过滤,4℃保存,上机检测。
2.2 代谢通量的计算方法
假设细胞中的代谢产物处于拟稳态,其浓度变化速率为0,以细胞内代谢流通量平衡为基础,按照物料守恒原理,核算中间代谢产物的积累速率,单位为mmol/(L·h),通过代谢产物的约束条件构建方程,结合实验测出F 个不相关速率即可确定胞内整体流量分布,定量描述生理行为[16-17]。
2.3 代谢网络的构建
蜂蜜接合酵母LGL-1 在稳定期的物质代谢网络[1],见图5。
2.4 代谢矩阵方程组的构建
图5含有13 个变量(V1-V13),qGlu(葡萄糖代谢通量)、qTre(海藻糖代谢通量)、qGly(甘油代谢通量)、qLA(乳酸代谢通量)、qCIA(柠檬酸代谢通量)、qα-KG(α-酮戊二酸代谢通量)、qMAL(苹果酸代谢通量)根据上述实验方法的测定结果计算得出[2]。假设细胞内中间代谢产物处于拟稳态,构成13 个方程,建立矩阵方程组(表1),应用软件MATLAB 7.0 求解各反应途径的代谢通量。
3 结果与分析
3.1 高糖胁迫下蜂蜜接合酵母LGL-1 的代谢特性
采用对数期的酵母菌接入高糖培养基和常规培养基中,菌体质量变化、葡萄糖消耗、代谢产物的生成情况如图1所示。
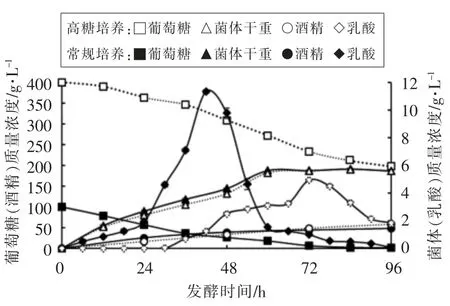
图1 高糖培养和常规培养下酵母菌的细胞生长、底物消耗和产物合成(n=3)Fig.2 Grow-up of cell,consumption of substrate and synthesis of products under sugar stress condition and normal condition(n=3)
由图1可知,酵母细胞在高糖培养基和常规培养基中培养0~12 h,菌体质量浓度几乎相同。培养12~60 h 时,常规培养基中的酵母菌体质量浓度比高糖培养基稍高。蜂蜜接合酵母LGL-1 在常规培养和高糖培养60 h 后趋于稳定,进入稳定期,菌体质量浓度几乎相同。培养84 h 时,常规培养和高糖培养时的菌体质量浓度都达到最高值,分别为5.74 g/L 和5.71 g/L。
蜂蜜接合酵母LGL-1 培养0~96 h,高糖培养基和常规培养基中的葡萄糖质量浓度不断降低,葡萄糖不断被消耗。与常规培养相比,高糖培养基中蜂蜜接合酵母LGL-1 的葡萄糖消耗速率减慢。常规培养基中细胞在72 h 时葡萄糖质量浓度为6.13 g/L,而在高糖培养基中糖耗延迟至96 h 尚未耗尽,葡萄糖质量浓度为198.40 g/L。
随着培养时间的延长,蜂蜜接合酵母LGL-1所产的酒精质量浓度逐渐增加。培养0~24 h 时,常规培养比高糖培养时酒精生成速率要高。培养24 h 后,常规培养的酒精生成速率放缓,高糖培养产酒精速率没有变化。培养96 h 后,常规培养产酒精含量达到47.9 g/L,随后基本趋于稳定。而同一培养时间,高糖培养产酒精含量达到最高值58.4 g/L,所产酒精质量浓度是常规培养的1.22倍。
蜂蜜接合酵母 LGL-1 高糖培养0~18 h 时,几乎没有乳酸生成,高糖培养18~72 h,乳酸含量逐渐增加,以适应高糖环境。高糖培养72 h 后乳酸含量逐渐降低。常规培养0~44 h 时,乳酸含量快速增加,44 h 后快速减少。发酵60 h 后,高糖培养条件下,乳酸浓度高于常规。在高糖培养条件下乳酸的合成明显受到抑制,最大值由常规培养的11.4 g/L 降为高糖时的6.9 g/L。
综上所述,高糖培养基和常规培养基中的细胞在生长过程中没有显著差异,说明对数生长期的细胞能较好地抵御高糖胁迫,与彭郦等[18]的试验结果一致。
3.2 蜂蜜接合酵母LGL-1 中海藻糖的合成
海藻糖在高糖胁迫环境下对细胞的生物膜、蛋白质和核酸等大分子具有良好的保护作用,是一种典型的应激性代谢物[19-20]。由图2可知,高糖培养0~60 h 时,蜂蜜接合酵母LGL-1 产海藻糖含量低于在常规培养基中的海藻糖含量,而在高糖培养60 h 后蜂蜜接合酵母LGL-1 产海藻糖含量一直维持在较高的水平。同一时间常规培养中蜂蜜接合酵母LGL-1 产海藻糖含量逐渐减少。常规培养时海藻糖质量分数最高达到细胞干重的0.37%,而高糖培养时达到0.83%。
3.3 蜂蜜接合酵母LGL-1 中甘油的合成
甘油含有羟基,亲水性能好,能有效地维持细胞内水活度,保护细胞免受脱水的侵害,是一种良好的生物相容性溶质[21-23]。由图3可知,培养0~72 h,常规培养基和高糖培养基生长的蜂蜜接合酵母LGL-1 中甘油的合成量逐渐增加,培养72 h 后逐渐减少。高糖培养基中甘油的合成量明显高于常规培养。常规培养条件下甘油最高达1.1 g/L,而高糖培养时甘油产量最高达2.6 g/L。
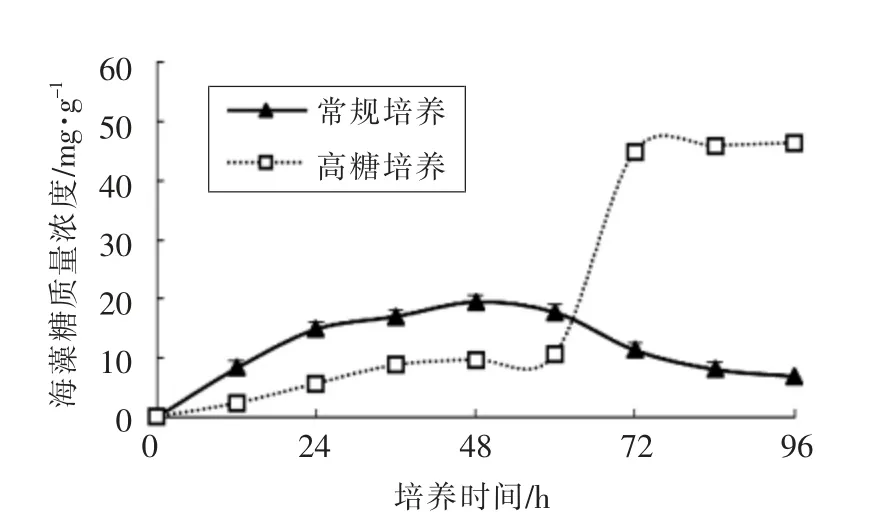
图2 高糖培养和常规培养下蜂蜜接合酵母LGL-1积累的海藻糖(n=3)Fig.2 Trehalose accumulation in Z.mellis LGL-1 under high sugar cultivation and normal cultivation(n=3)
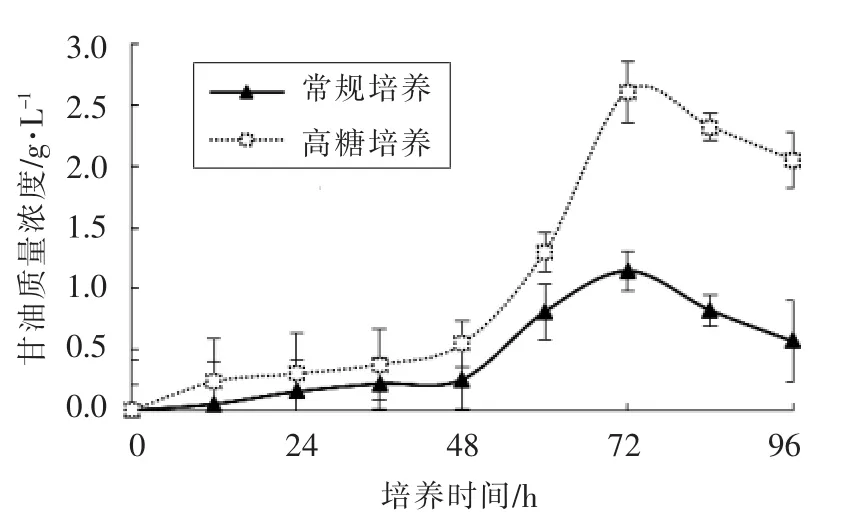
图3 高糖培养和常规培养下蜂蜜接合酵母LGL-1积累的甘油(n=3)Fig.3 Glycerol accumulation in Z.mellis LGL-1 under high sugar cultivation and normal cultivation(n=3)
3.4 蜂蜜接合酵母LGL-1 中有机酸的合成
图4是有机酸的合成图。高糖培养0~6 h 时,苹果酸、柠檬酸含量开始增加;高糖培养6 h 后,苹果酸和柠檬酸含量逐渐降低。高糖培养0~60 h时,α-酮戊二酸含量逐渐增加;高糖培养60 h 后,α-酮戊二酸含量逐渐减少。常规培养0~60 h,苹果酸和α-酮戊二酸含量逐渐增加;常规培养60 h 后趋于稳定。常规培养0~6 h,柠檬酸含量增加;常规培养6~84 h,柠檬酸含量趋于稳定;常规培养84 h后逐渐减少;常规培养96 h 时柠檬酸几乎分解殆尽。
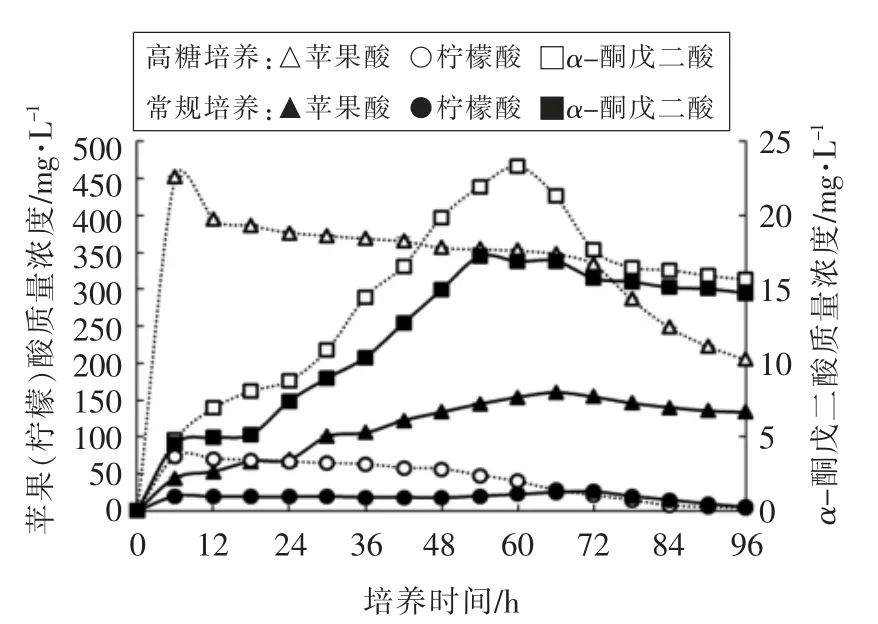
图4 高糖培养和常规培养下蜂蜜接合酵母LGL-1积累的有机酸(n=3)Fig.4 Organic acid accumulation in Z.mellis LGL-1 underhigh sugar cultivation and normal cultivation(n=3)
有机酸合成在高糖培养中明显高于常规培养。高糖培养条件下苹果酸、柠檬酸、α-酮戊二酸含量最高分别达452.83,73.16,23.31 mg/L,而常规培养苹果酸、柠檬酸、α-酮戊二酸含量最高达160.35,26.19,17.23 mg/L。
3.5 碳代谢网络的构建
由图1、图2、图3和图4可知,蜂蜜接合酵母LGL-1 在高糖培养条件下,甘油、海藻糖、乳酸和有机酸等的合成均较常规培养有显著提高。蜂蜜接合酵母LGL-1 稳定期(60~72 h)细胞生长趋于稳定,来自底物葡萄糖的碳流量主要用于产物合成。细胞摄入葡萄糖,使其进入中心代谢途径[24],一些中间代谢产物经转化合成与分解重组等形成细胞结构物质单体,从而构成了细胞,其中一些反应还涉及如FAD/FADH 和NAD(P)/NAD(P)H 等辅助因子以及ATP/ADP/AMP 的周转[25]。此过程的碳代谢网络如图5所示,其中葡萄糖消耗速率和胞外代谢产物生成速率经测定并换算为代谢通量q。Vi(i=1~13)表示未知流量。图5中的代谢节点平衡式和代谢方程式见表1和表2[1,25]。
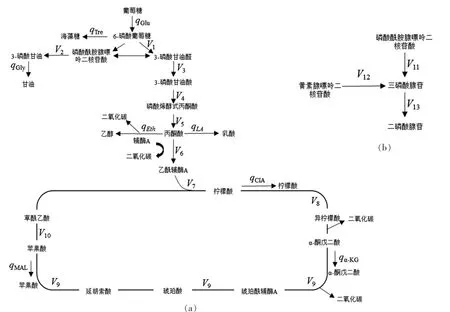
图5 蜂蜜接合酵母LGL-1 在稳定期的碳代谢网络Fig.5 Carbon metabolism network of Z.mellis LGL-1 at stable stage
根据所建立的代谢网络和代谢流分析方法,采用Matlab 软件对蜂蜜接合酵母LGL-1 在稳定期(60~72 h)的代谢流分布进行求解,如表1所示。

表1 蜂蜜接合酵母LGL-1 碳代谢节点的平衡方程Table1 Equilibrium equations of carbon metabolism node in Z.mellis LGL-1

表2 碳代谢网络中不同代谢产物的化学计量关系和代谢反应式Table2 Stoichiometric relationships and metabolic reactions of different metabolites in carbon metabolism network
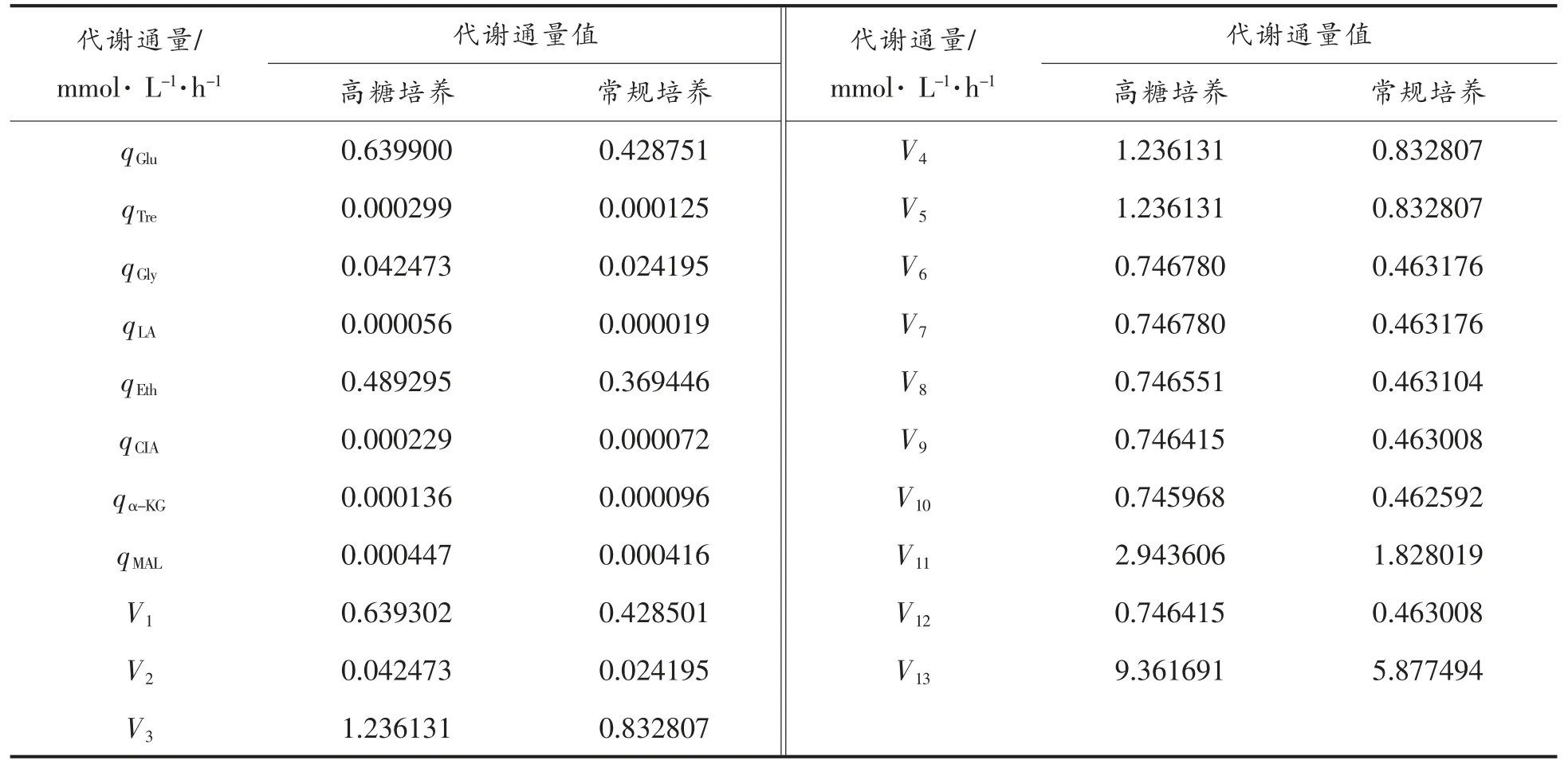
表3 高糖培养和常规培养下蜂蜜接合酵母LGL-1 的代谢流分布Table3 Metabolic flux distribution of Z.mellis LGL-1 under high sugar cultivation and normal cultivation
3.6 节点代谢流分布
由表3可知,高糖环境下蜂蜜接合酵母LGL-1 的代谢流分布发生明显改变。影响生成物产出的6 个重要代谢节点,即糖酵解途径(EMP)中六磷酸葡萄糖(G6P)节点、丙酮酸(PYR)节点及由磷酸二羟丙酮(DHAP)和3-磷酸甘油醛(GAP)组成的分流节点,三羧酸循环(TCA)途径中柠檬酸(CIA)节点、α-酮戊二酸(α-KG)节点和苹果酸(MAL)节点。本文采用归一法[26-28]分析代谢流分布情况,如图6所示。
由图6可知,与常规培养相比,高糖培养条件下蜂蜜接合酵母LGL-1 代谢网络中各通量发生一定变化。代谢产物的节点分析是影响产物生成的关键。在常规培养(100 g/L 葡萄糖)的稳定期,蜂蜜接合酵母LGL-1 处于拟稳态,其碳代谢物质的形成与消耗基本维持恒定,来自葡萄糖的碳流量有99.94%流向了DHAP&GAP 节点,而有0.06%的碳流量进入合成海藻糖的代谢途径;在DHAP & GAP 节点处的碳流量有97.18%进入TCA 循环途径,有2.82%流向了合成甘油的代谢途径;而在PYR 节点处有44.36%的碳流量用于乙醇的形成,有0.02%的代谢碳流量用于乳酸的转化,最终流向乙酰辅酶A 代谢碳流量占有55.62%;在TCA 循环途径的各代谢节点中的碳流量有0.02 %用于柠檬酸的形成,0.02 %的代谢碳流量用于产出α-酮戊二酸,0.09%的代谢碳流量用于产出苹果酸。与常规培养比较,高糖(400 g/L)培养时来自G6P 节点的碳流量有0.09%流向海藻糖,是常规培养的1.5 倍;从DHAP&GAP 节点进入三磷酸甘油形成途径的流量为3.32%,是常规培养的1.18 倍。从PYR 节点进入乙醇形成途径的流量为39.58%,是常规培养的89.22%,流向乳酸的流量为0.01%,与常规培养几乎相近,并且从该节点进TCA 循环途径的流量为60.41%,较常规培养增加了4.79%;在TCA 循环途径的各代谢节点中,柠檬酸、α-酮戊二酸、苹果酸处的碳流量分别为0.03%,0.02%,0.06%,与常规培养的碳流量相近。酵母发酵过程中存在一些可逆的反应,代谢流作用于糖异生途径,三羧酸途径的有机酸积累与丙酮酸的分解动态有关[26]。
4 结论
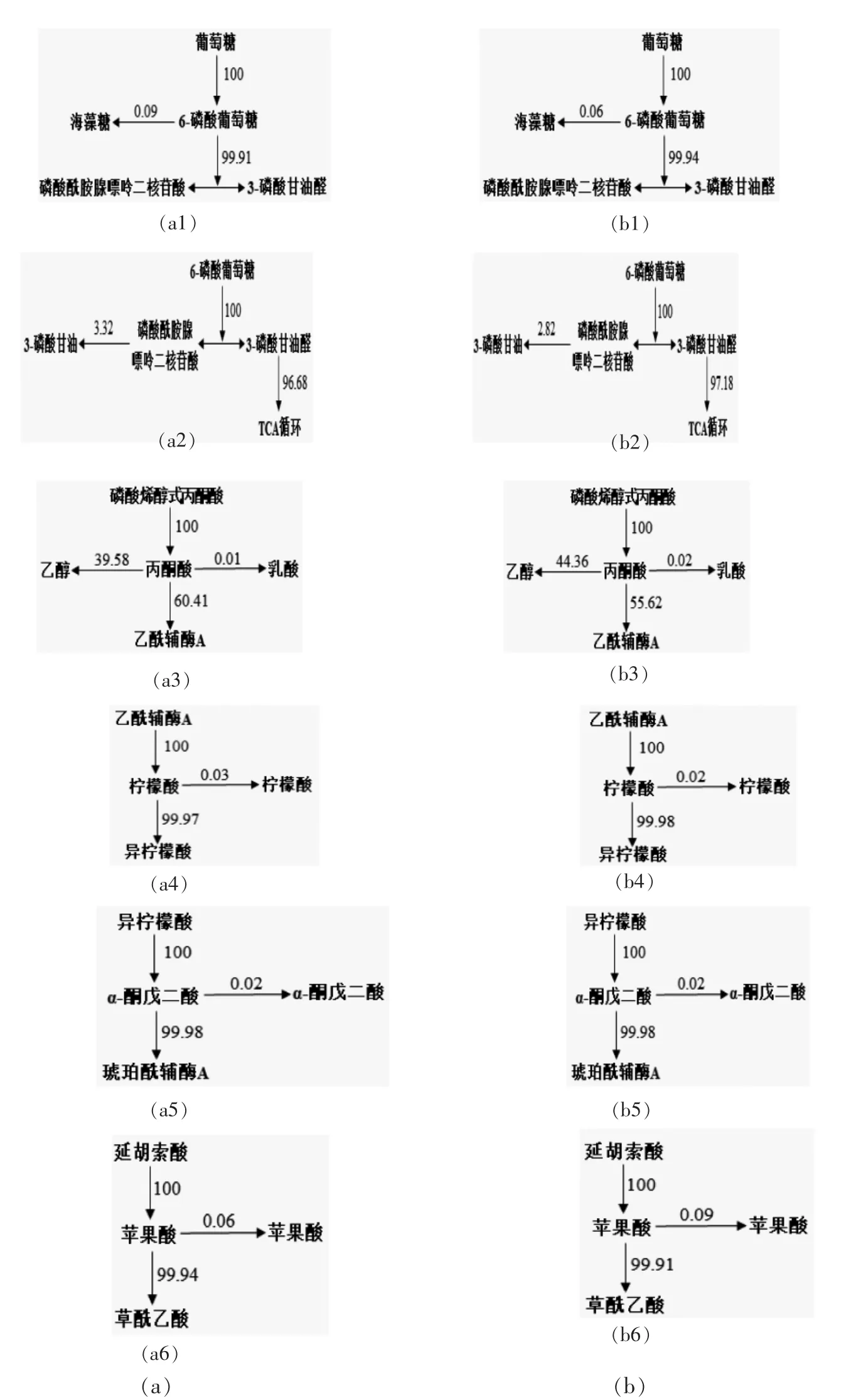
图6 蜂蜜接合酵母LGL-1 在高糖培养(a)和常规培养(b)下不同节点处的代谢流分布Fig.6 Metabolic flux distribution of Z.mellis LGL-1 at different metabolic nodes under high sugar cultivation(a)and normal cultivation(b)
蜂蜜接合酵母LGL-1 在高糖胁迫条件下,其中心代谢途径中各节点的代谢通量发生一定的变化。高糖胁迫时蜂蜜接合酵母LGL-1 碳流量偏向流入海藻糖、甘油、乙醇等形成途径和TCA 循环的代谢支路,与常规培养相比,海藻糖、甘油和TCA 循环的通量分别增加了50.00%,17.73%和4.79%,乙醇的代谢通量接近。在高糖条件下蜂蜜接合酵母LGL-1 细胞中甘油、海藻糖产出通量的变化和进入TCA 循环的碳流量变化也反映了其对酵母细胞的重要保护功能。通过对蜂蜜接合酵母LGL-1 在高糖胁迫下中心代谢途径中各节点的代谢通量的分析,可为酿酒酵母在高糖胁迫条件下的理化特性和应激代谢机制研究提供理论依据。
