不同热处理条件下大豆蛋白体外模拟消化产物结构和分子质量分布
2020-05-24赵城彬尹欢欢鄢健楠刘景圣齐宝坤
赵城彬 尹欢欢 鄢健楠 刘景圣 杜 琛 牛 希 齐宝坤
(1 吉林农业大学食品科学与工程学院 小麦和玉米深加工国家工程实验室 长春130118 2 东北农业大学食品学院 哈尔滨150030)
大豆中含有40%左右的蛋白质,被认为是经济、安全且最具发展潜力的植物蛋白资源之一[1]。大豆蛋白属全价蛋白,具有良好的功能性和较高的营养价值,富含必需氨基酸,与鱼、肉、蛋、奶接近,是一种优质的植物蛋白,被广泛应用于食品加工中[2]。大豆分离蛋白(SPI)是大豆油工业的副产物,其蛋白质含量高于90%,由脱脂豆粕在低温下除去水溶性非蛋白成分而制得,其结构、组成和性质与纯大豆蛋白几乎相同[3]。为了反映营养物质的消化利用特性,根据体内消化情况建立体外消化模型,将复杂的体内胃、肠消化系统转化成体外模拟消化体系,从而实现了消化特性研究的可行性和便捷性,在营养成分消化吸收及有效成分生物利用等方面的应用越来越广泛[4]。目前,国内外涉及蛋白质体外模拟消化研究对象主要为小麦蛋白、大豆蛋白和菜籽蛋白等植物蛋白[5]以及乳清蛋白、β-乳球蛋白和酪蛋白等动物蛋白[6],采用的消化酶主要包括胰蛋白酶、胃蛋白酶和胰液素等。然而,大豆蛋白分子在空间排布上具有紧密的折叠结构,导致其对蛋白酶的消化作用不敏感[7],这极大地降低了大豆蛋白的消化效率。Tang 等[8]研究发现对豌豆球蛋白进行预处理,使其紧密结构变得松散,利于蛋白质消化。胡少新等[9]研究指出对大豆蛋白进行适当的加热变性处理能够提高胰蛋白酶酶解效率,获得抗氧化活性强的功能性蛋白肽。热处理能够使大豆蛋白紧密的结构展开,变得松散,导致分子内部的酶作用位点暴露出来,从而利于蛋白酶与作用位点结合,促进其对大豆白质的消化作用。目前,关于热处理下SPI 体外模拟消化产物结构和分子质量分布鲜有研究报道,且SPI亚基组成、分子结构与体外消化率之间关系方面的报道更是罕见。本试验对热处理后的SPI 进行体外模拟胃消化,利用凝胶电泳分析SPI 亚基的降解情况,采用红外光谱法分析蛋白质二级结构,通过体积排阻-凝胶色谱法分析蛋白质分子质量分布,探究热处理对SPI 体外模拟胃消化产物的结构和分子质量分布的影响,为建立及评价大豆蛋白营养消化模式及影响SPI 消化特性的作用机制提供理论依据。
1 材料与方法
1.1 材料与试剂
大豆(陕豆125),陕西省农业科学院;胃蛋白酶,诺维信生物技术有限公司;三硝基苯磺酸(TNBS),美国Sigma 公司;无水乙醇、NaOH、HCl、Na2HPO4·12H2O、NaH2PO4·2H2O 等化学试剂均为国产分析纯级。
1.2 设备与仪器
DK-98-1 型电热恒温水浴锅,天津市泰斯特仪器有限公司;FD 5-3 型冷冻干燥机,美国SIM公司;1600PC 紫外-可见分光光度计,上海美普达仪器有限公司;Mini-Protean 4 电泳仪,美国Bio-Rad 公司;MAGNA-IR560 傅里叶变换红外光谱系统,美国尼高力公司;HiLoad 16/60 Superdex 200、Sephadex G-75 制备级预装凝胶层析柱,美国GE 公司。
1.3 试验方法
1.3.1 大豆分离蛋白(SPI)的制备 SPI 的制备根据Petruccelli 等[10]的方法。将脱皮、粉碎的大豆过60 目筛,采用正己烷40 ℃脱脂2 h。将脱脂豆粕与水以料液比1∶10 的比例混合,采用NaOH 溶液调节pH 值至8.0,室温下碱提1 h,然后10 000×g 离心30 min,取上清液,用HCl 溶液调节上清液pH值至4.5,静置后6 000×g 离心30 min,取沉淀,将沉淀水洗后复溶,用NaOH 溶液调节pH 值至7.0,以10 000×g 离心30 min,然后将上清液冻干,即得SPI。通过凯氏定氮法(GB/T5009.5-2010)测得SPI 中蛋白质含量为90.84%。
1.3.2 SPI 体外模拟消化 将SPI 分散于蒸馏水中,室温下磁力搅拌2 h,配成5%的蛋白溶液,然后对蛋白溶液进行热处理,热处理条件分别为70℃处理20 min,85 ℃处理10 min,85 ℃处理20 min,85 ℃处理30 min,100 ℃处理20 min,然后迅速冰浴冷却,待用。将人工模拟胃液缓冲液(pH 1.2,84 mmol/L HCl 溶液,35 mmol/L NaCl 溶液)的温度控制在37 ℃,待体系温度稳定后添加胃蛋白酶(酶活3 000 U/g),使酶与底物比为1∶100,搅拌混匀后添加到蛋白溶液中,在恒定的温度和pH条件下进行消化反应1 h[11]。消化结束后调节pH值至7.0,将消化产物冻干后4 ℃保存,备用。以未经热处理的SPI 消化产物为对照样。
1.3.3 水解度测定 根据Adler-Nissen[12]的研究,水解度(DH)采用三硝基苯磺酸(TNBS)法测定。在弱碱性条件下TNBS 与游离氨基酸反应生成的产物在波长340 nm 处有吸收峰,而在酸性条件下即终止反应。绘制标准曲线L-Leu(0~2.0 mmol/L)。DH 的计算公式如下:
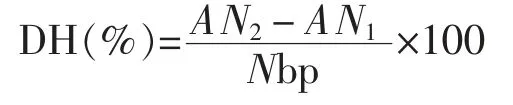
式中,AN1——蛋白水解前氨基氮的含量(mg/g 蛋白);AN2——蛋白水解后氨基氮的含量(mg/g蛋白);Npb——蛋白底物中肽键的氮含量(mg/g蛋白),大豆球蛋白的为109.2 mg/g。
1.3.4 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)测定 蛋白质的SDS-PAGE 测定参照Yadav 等[13]的方法。样品缓冲液:0.05 mol/L Tris-盐酸缓冲液,2.5% β-巯基乙醇,0.02%溴酚蓝,1%SDS 和5%甘油。将样品溶于样品缓冲液中配成3 mg/mL 的蛋白溶液,95 ℃加热5 min 后上样,上样量为10 μL。浓缩胶质量分数为5%,分离胶质量分数为15%。浓缩胶电压80 V,分离胶电压120 V。电泳结束后,采用考马斯亮蓝R250 染色,脱色后用Tanon 凝胶成像系统拍照。
1.3.5 傅里叶红外光谱(FTIR)测定 FTIR 的测定参照Zhao 等[14]的方法。将1 mg 蛋白样品与100 mg 溴化钾研磨均匀后压片,置于红外光谱仪中测定。波数扫描范围4 000~500 cm-1,扫描次数64 次,波数精度0.01 cm-1,分辨率4 cm-1,测定温度25 ℃。利用Peakfit Version 4.12 软件谱图拟合处理,根据其峰面积计算蛋白质各二级结构含量。
1.3.6 分子质量分布测定 采用体积排阻-凝胶色谱(SEC-HPLC)对蛋白样品的分子质量分布进行测定[15]。使用Agilent 高效液相系统和HiLoad 16/60 Superdex 200 制备级预装层析柱。将样品溶于蒸馏水中配成10 mg/mL 的溶液,10 000×g 离心10 min,采用0.22 μm 滤膜过滤后上样,上样量为1 mL。设置柱体积为120 mL,柱温25 ℃。Superdex 200 凝胶柱的流动相为50 mmol/L 磷酸盐缓冲液(pH 7.0),洗脱速率为1 mL/min。SephadexG-75 凝胶柱的流动相为0.03 mol/L Tris-HCl 缓冲液(pH 8.0),洗脱速率为0.5 mL/min。洗脱后于280 nm 处检测洗脱液的吸光度。建立相对分子质量与保留时间的回归方程,根据保留时间估算出蛋白质的分子质量。
1.3.7 统计分析 每个试验重复3 次,采用SPSS V17.0 软件进行ANOVA 差异显著性分析,P<0.05为显著性差异。采用Origin8.5 软件作图。
2 结果与分析
2.1 水解度分析
在温度为70,85,100 ℃条件下对SPI 热处理不同时间,然后进行体外模拟消化1 h。图1显示不同热处理条件对SPI 水解度(DH)的影响。热处理使SPI 消化产物的DH 增加,这说明不同热处理条件SPI 的消化降解有一定促进作用,这是由于热处理使蛋白质变性、结构展开,暴露分子内部的活性基团及酶结合位点,增加了对蛋白酶的敏感性,因此易被胃蛋白酶消化降解,导致DH 增加[16]。热处理温度的升高和时间的延长均使DH 先升高后降低,且热处理温度对DH 的影响更显著。在85 ℃热处理20 min 时,DH 达到最大值。然而,100 ℃的热处理会显著降低DH,且低于70 ℃热处理的样品。这可能是由于过高的热处理温度使SPI严重变性,导致蛋白质发生热聚集,使暴露出来的酶解位点重新包埋,同时蛋白质球状分子发生变形,不易与酶分子结合,导致酶对蛋白质的消化降解作用减弱。该结果与Sorgentini 等[17]的研究结果相似。
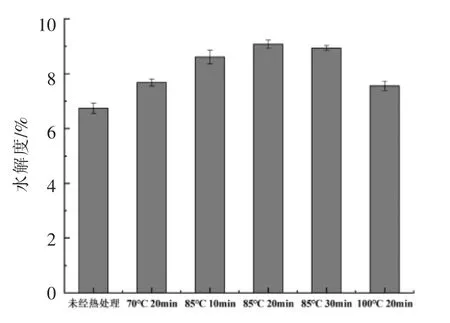
图1 不同热处理条件对SPI 水解度的影响Fig.1 Effect of different heat treatment conditions on degree of hydrolysis of SPI
2.2 SDS-PAGE 分析
不同热处理条件下SPI 消化产物的SDSPAGE 图谱见图2。SPI 主要由具有酸性亚基(A1~4)及碱性亚基(B)的大豆球蛋白(11S)与具有α、α′及β 亚基的β-伴大豆球蛋白(7S)组成,这与Cucu 等[18]对大豆蛋白电泳分析得到的特征谱带相似。未经热处理的SPI 消化产物11S 亚基组分几乎被完消化降解,而7S 亚基组分并没有被降解。Zhao 等[19]研究发现大豆7S 蛋白较难被胃蛋白酶消化,这与本研究结果一致。热处理对消化产物的亚基组成具有显著影响,使SPI 体外消化模式发生改变,不易消化降解的7S 亚基组分被消化降解。70 ℃热处理20 min 和85 ℃热处理10~30 min均会使SPI 的7S 亚基组分被完全消化(c-f 泳道),而经100 ℃热处理20 min 的消化产物电泳条带中还可看到残留有少量的7S 亚基组分(g 泳道),这表明影响SPI 消化性的主要因素为热处理温度。Peng 等[20]研究发现大豆多肽的紧密结构对胃蛋白酶的水解作用具有抗性,经热处理使大豆蛋白结构展开,暴露出酶解位点,提高蛋白质消化性,使原本不易酶解的7S 亚基被降解。当热处理温度过高,使7S 球蛋白严重变性而形成热聚集体,不易于酶与蛋白质结合,导致部分7S 亚基组分没有被消化,这也与本文的水解度的变化规律相符。此外,热处理会使SPI 的11S 亚基消化程度降低,其中A 亚基只有部分被消化降解,而B 亚基几乎完全被降解,形成分子质量低于17 ku 或更低分子质量的组分。与未经热处理的SPI 消化产物相比,经热处理的SPI 在消化过程中被胃蛋白酶降解成更多的低分子质量组分。
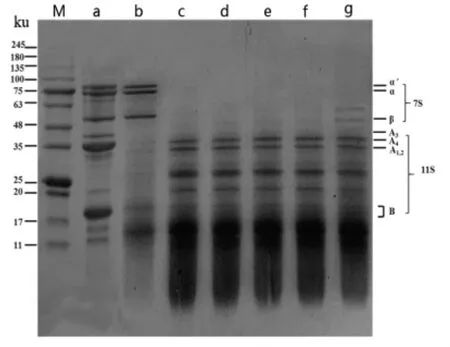
图2 不同热处理条件下SPI 消化产物的SDS-PAGE 图谱Fig.2 SDS-PAGE pattern of SPI digestion products at different heat treatment conditions
2.3 红外光谱分析
因蛋白质的二级结构与其红外光谱的酰胺I带(1 600~1 700 cm-1)吸收密切相关,故可采用此方法分析蛋白质二级结构[21]。图3为不同热处理条件下SPI 消化产物的红外光谱,所有SPI 消化产物在酰胺I 带(Amide I)1 600~1 700 cm-1处具有强吸收峰。根据Carbonaro 等[22]的方法对酰胺I带进行拟合,建立各二级结构与扫描波数的对应关系:1 650~1 660 cm-1为α-螺旋结构,1 610~1 640 cm-1为β-折叠结构,1 660~1 700 cm-1为β-转角结构,1640~1649 cm-1为无规卷曲结构,根据对应的峰面积计算各二级结构含量。
不同热处理条件下SPI 消化产物的二级结构含量如图4所示。未经热处理的SPI 消化后,α-螺旋和无规卷曲含量增加,β-折叠和β-转角含量降低,说明胃蛋白酶对蛋白质的消化主要破坏其β-结构。热处理能够使消化产物的α-螺旋含量增加,β-折叠含量降低,而β-转角与无规卷曲含量变化不显著。李杨等[23]研究指出完全变性的7S 球蛋白二级结构也具有类似的变化趋势。此外,相比于热处理时间,热处理温度对SPI 消化产物二级结构的影响更大,导致α-螺旋含量先增加后降低,β-折叠含量先降低后增加。适当的加热使大豆蛋白变性,结构展开,包埋在分子内部的作用位点暴露出来,使蛋白质发生解折叠,导致α-螺旋含量增加,β-折叠含量降低;而过高的加热温度使蛋白质发生热聚集,部分酶解位点重新包埋,同时变形的球状分子不利于酶的水解,导致α-螺旋含量降低,β-折叠含量增加[24]。这也表明高温可能会导致α-螺旋结构解旋,进而通过分子间相互作用转化为β-折叠结构,与Carbonaro 等[25]在豆科蛋白的溶解消化关系的研究结果相似。
2.4 分子质量分布分析
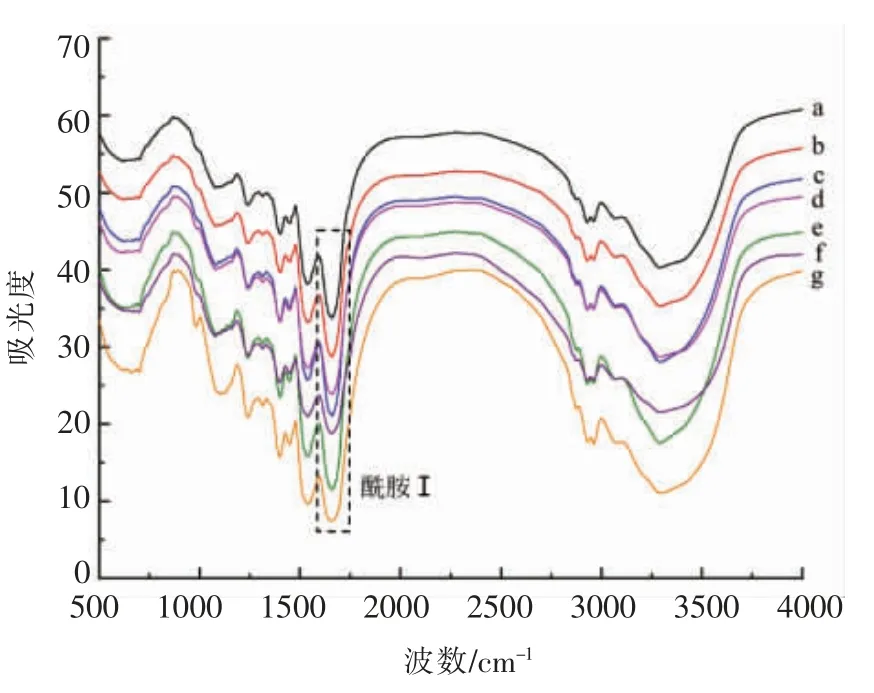
图3 不同热处理条件下SPI 消化产物的红外光谱Fig.3 Infrared spectra of SPI digestion products at different heat treatment conditions
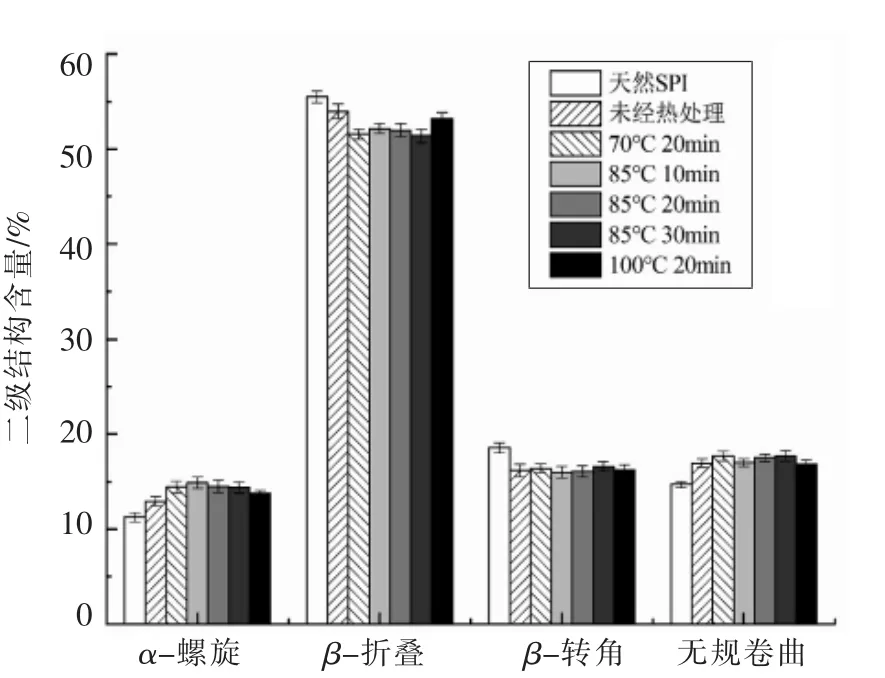
图4 不同热处理条件下SPI 消化产物的二级结构含量Fig.4 Secondary structure contents of SPI digestion products at different heat treatment conditions
体积排阻-凝胶色谱(SEC-HPLC)主要是根据多孔凝胶对不同分子大小蛋白质的不同排阻效应进行分离,从而测定蛋白质分子质量[26]。天然SPI 的Superdex 200 凝胶洗脱图谱和蛋白质分子质量分布标准曲线如图5所示。其标样曲线的回归方程为y=-0.0796x+6.5721,R2=0.9891。根据该回归方程的保留时间估算出蛋白质的分子质量[27]。表1为不同热处理条件下SPI 消化产物的分子质量分布。与天然SPI 相比,未经热处理的SPI消化产物中大分子质量肽(>100 ku)的含量显著降低(P<0.05),中等分子质量肽(10~100 ku)和小分子质量肽(<3 ku)的含量显著增加(P<0.05),而中小分子质量肽(3~10 ku)的含量变化不显著(P>0.05),这说明胃蛋白酶能够将大分子SPI 消化降解成小分子肽。与未经热处理的SPI 消化产物相比,升高热处理温度或延长热处理时间虽会增加大分子质量肽(>100 ku)和中小分子质量肽(3~10 ku)的含量,但会降低中等分子质量肽(10~100 ku)和小分子质量肽(<3 ku)的含量,这说明热处理改变SPI 消化产物的分子质量分布。这可能是由于热变性导致SPI 结构伸展,促进了可溶性和不溶性聚集体的形成[28]。胃蛋白酶消化降解这些变性蛋白形成的聚集体时,主要生成大分子质量肽,而小分子质量肽及氨基酸释放较少。Iung 等[29]在对β-乳球蛋白的消化性研究中发现,采用胰蛋白酶水解β-乳球蛋白会产生较多小分子质量肽,而消化热处理的β-乳球蛋白则会产生较多大分子质量肽,这与本研究结果相似。
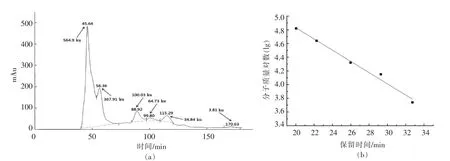
图5 天然SPI 的Superdex 200 凝胶洗脱图谱(a)和蛋白质分子质量分布标准曲线(b)Fig.5 Superdex 200 gel elution spectrum of native SPI(a)and the molecular weight distribution curve of standard samples(b)

表1 不同热处理条件下SPI 消化产物中蛋白分子质量分布Table1 Protein molecular weight distribution of SPI digestion products at different heat treatment conditions
3 结论
采用胃蛋白酶对热处理后的大豆分离蛋白(SPI)进行体外模拟消化。热处理会使SPI 消化产物的水解度增加,85 ℃热处理20 min 时,DH 达到最大值。凝胶电泳分析表明热处理使SPI 体外消化模式发生了改变,11S 亚基消化程度降低,同时不易消化降解的7S 亚基组分被消化降解,产生更多低分子质量的组分。红外光谱分析表明热处理的SPI 经消化后α-螺旋含量增加,β-折叠含量降低。相比于热处理时间,热处理温度对SPI 消化产物二级结构的影响更大。分子质量分布分析表明:热处理会改变SPI 消化产物的分子质量分布,随着热处理温度和时间的增加,大分子质量肽(>100 ku)和中小分子质量肽(3~10 ku)的含量升高,而中等分子质量肽(10~100 ku)和小分子质量肽(<3 ku)的含量呈下降趋势。
