培养肉的研究进展与挑战
2020-05-24周光宏丁世杰徐幸莲
周光宏 丁世杰 徐幸莲
(南京农业大学食品科技学院 国家肉品质量安全控制工程技术研究中心教育部肉品加工与质量控制重点实验室 农业农村部肉品加工重点实验室江苏省肉类生产与加工质量控制协同创新中心 南京210095)
肉类因含有丰富的蛋白质、脂肪、维生素等营养成分而成为人类最重要的食品之一。随着世界总人口的增长以及发展中国家生活水平的提高,全球肉类消费量持续升高,预计到2050年会增加50%以上[1]。2030年,我国的人均肉类消费量预计较2010年增长100%~200%[2]。依赖畜牧业的肉类生产方式与资源环境禀赋之间的矛盾日益突出,畜牧业生产资源消耗多,温室气体排放量大,对环境污染严重,同时也存在动物福利和健康等方面的问题[1]。近年来,非洲猪瘟、禽流感等动物疫病的流行也给肉类安全生产带来严峻的挑战,亟需开发高效绿色的肉类生产技术。培养肉技术是近年来兴起的一项颠覆性肉类生产技术,可以部分取代传统畜牧业生产肉类,是一种未来食品生产技术[3-4]。
培养肉(Cultured Meat,亦称为细胞培养肉或培育肉)是依据动物肌肉生长修复机理,利用其干细胞进行体外培养而获得的肉类,它不需要经过动物养殖,直接用细胞工厂化生产肉类[5-7]。培养肉技术是近年来兴起的一项具有颠覆性的未来食品生产技术,与传统肉类生产方式相比,培养肉可以减少7%~45%的能源消耗,降低78%~96%的温室气体排放量,降低99%的土地使用,减少82%~96%的用水量等[8]。2013年8月,荷兰Mark Post教授在英国伦敦举办了全球首次培养牛肉汉堡试吃大会,第1 次证明了培养肉的概念的可行性[9]。自2013年以来,对培养肉的研究在国际上迅速发展,取得了一系列重大突破。2019年11月18日,南京农业大学使用猪肌肉干细胞培养20 d,获得中国第1 块细胞培养肉。
由于基础研究、工业化生产、食品化技术以及安全监管等问题,目前全球还没有培养肉商业化产品。本文首先总结了培养肉的发展历程,然后从肌肉的生长发育规律出发,结合肉类的理化性质和加工特性,从种子细胞获取、干性维持、无血清培养条件、扩大培养、大规模分化、食品化技术、产品安全评价与管理规范7 个方面阐述培养肉产业化生产的挑战及可能的未来发展方向,为培养肉相关领域的技术发展提供参考。
1 培养肉发展历程
培养肉的概念早在1931年由丘吉尔提出[10],经过近80年的技术积累才逐渐变为现实。动物肌肉的生长发育、细胞生物学和组织工程等科学技术的发展推动了培养肉技术研究。表1梳理了培养肉的发展历史。

表1 培养肉的发展历史Table1 Events in cultured meat history
2 肌肉发育及损伤修复
培养肉的生产是模拟和遵循动物肌肉的生长发育以及肌肉损伤修复规律。深入研究肌肉组织发育和损伤修复过程,可以为培养肉生产提供理论和技术支撑。肌肉细胞的发育主要分为胚胎期、胎儿期以及出生后3 个部分[20-21]。在发育过程中,一部分细胞分化形成轴旁中胚层,再发育为生皮肌节,最后进一步发育成为肌肉祖细胞。肌肉祖细胞相互融合形成初级肌纤维和次级肌纤维,帮助胚胎期和胎儿期的肌肉形成。出生以后,肌肉则主要依靠增加肌原纤维骨架蛋白合成实现肌肉增长[20-21]。在成体肌肉组织中,还存在肌肉干细胞(Muscle Stem Cell,MuSC)。肌肉干细胞又被称为肌卫星细胞(Satellite cell),主要来源于胎儿期的肌肉祖细胞,负责出生后的肌肉组织损伤修复[22]。
在肌肉发育和损伤修复过程中,肌源性细胞会表达特异性的转录因子,包括Pax3/7 以及其它的肌肉调节因子,如Myf5,MyoD,Mrf4 和Myog等,并最终表达肌肉细胞特有的如MyHC 等肌肉蛋白[20]。肌肉细胞形成的主要生物学过程见图1。阐明肌细胞形成规律,为体外形成肌肉组织奠定了良好的理论基础,推动了培养肉的研究进程。
3 肉的组成及加工特性
肉类的肌肉蛋白质赋予肉独特的理化性质和加工特性。从化学成分上来说,肉中的蛋白质含量约为20%,是最重要的营养成分[23-24]。肉中的蛋白质主要包括约50%的肌原纤维蛋白,约30%的肌浆蛋白和约20%的基质蛋白[24]。肉中的蛋白质对于肉的加工特性、质构、风味、颜色等都有着非常重要的作用[24-25]。肌原纤维蛋白是肉制品加工过程中最重要的蛋白质,在较高的盐离子强度下,肌原纤维蛋白充分溶解,帮助形成良好的肌肉蛋白凝胶制品。肌浆蛋白可以增强肌原纤维蛋白凝胶。结缔组织蛋白由于溶解性较差,因此对于肉制品的凝胶作用有限[24]。同时,肌肉蛋白对乳化型肉制品的乳化特性也非常重要。将肌浆蛋白和高盐离子强度下溶解的肌原纤维蛋白一起作为乳化剂,可以降低脂肪和水之间的界面张力,形成稳定乳浊液,肌原纤维蛋白的乳化特性更好[24]。另外,肌肉蛋白对于色泽(肌红蛋白)、风味(美拉德反应)等食用特性也有非常重要的作用[26]。
细胞培养肉目前还很难形成大块的肌肉组织,而分化的肌管中富含大量的肌肉特有的蛋白质。考虑到肌肉组织中蛋白质的重要作用,在培养肉的生产过程中,应注重肌管生成效率,最大程度地生产肌肉细胞和肌肉细胞蛋白,从而帮助生产“真正”的培养肉肉制品。
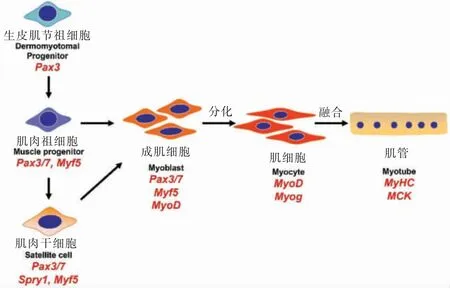
图1 骨骼肌细胞谱系图Fig.1 Proposed lineage scheme for skeletal muscle
4 培养肉生产流程
根据肌肉细胞的生物学过程以及肌肉的理化、加工特性,培养肉生产的第1 要务就是生成大量的肌肉细胞及蛋白质。培养肉的产业化方案见图2。首先需要分离获取肌肉干细胞(muscle Stem cell,MuSC)、胚胎干细胞(embryonic stem cell,ESC)或诱导性多能干细胞(induced pluripotent stem cell,iPSC)、间充质干细胞(mesenchymal stem cell,MSC)和其它底盘细胞(Others)等种子细胞,种子细胞需要具有或可诱导的肌源性(脂源性)细胞命运;然后,通过生物反应器扩大培养,实现种子细胞的大规模增殖;再利用分化模具、生物反应器或3D 打印的方法大规模生产肌肉组织;最后利用食品化加工技术制作培养肉产品。

图2 培养肉产业化方案Fig.2 Schematic of cultured meat production
5 培养肉的研究进展及技术挑战
利用现有的技术方法,可以实现培养肉的小规模实验室生产,然而,要实现培养肉低成本、高效率和产业化生产仍有很多技术难题需要攻克。
5.1 干细胞获取
干细胞获取是培养肉生产的基础。根据肌肉发育和损伤修复的生物学过程,肌源性细胞命运是培养肉种子细胞的必然要求。除此之外,培养肉的种子细胞还需具备以下的要求:①细胞要易于获取,且能够在体外持续增殖并有较高的肌管分化效率;②在培养过程中,细胞的基因组要相对稳定。目前,适宜的培养肉种子细胞大致有以下几种,包括肌肉干细胞、胚胎干细胞或诱导性多能干细胞、间充质干细胞和其它底盘细胞。
肌肉干细胞又称肌卫星细胞,是肌肉组织中的专能干细胞。肌肉干细胞易于分离培养和肌源性分化特性使其成为良好的培养肉种子细胞[27]。由于肌肉组织中存在着至少十几种不同类型的细胞,包括成纤维细胞、内皮细胞、血液细胞等,所以如何分离获取畜禽动物高纯度肌肉干细胞成为一大难题[28-29]。早期研究肌肉干细胞通常采用贴壁法或Percoll 密度梯度离心法。这类的方法可以实现一定程度上的肌肉干细胞富集,然而方法的重复性和细胞纯度存在较大的不稳定性[28,30-31]。现阶段的流式细胞分选技术则是根据肌肉干细胞特有的表面标志物进行分离,细胞纯度很高,然而该方法的成本较高[28-29]。未来肌肉干细胞的分离技术需要通过肌肉干细胞特有的代谢特点,制定特异性的分离条件,选择性地促进肌肉干细胞生长或者通过代谢障碍选择性地抑制其它类型的细胞生长。相关的技术已应用于肌肉干细胞、心肌细胞的纯化,然而稳定性和细胞纯度还需进一步研究[32-33]。
其它细胞类型,由于自身不具有肌源性细胞命运,所以需要进行诱导才能作为种子细胞。胚胎干细胞和诱导性多能干细胞具有全能性,经过细胞命运调控,可以定向诱导分化为PAX7 阳性的肌肉干细胞或者MyHC 阳性的多核肌管[20,34]。相关的命运调控过程遵循胚胎肌肉发育过程。相关的研究也集中在小鼠和人的研究中,涉及畜禽动物的研究还较少[35]。未来研究ESC 和iPSC 作为培养肉种子细胞,需要建立相关的畜禽动物ESC/iPSC细胞系并完善培养方法,制定属于畜禽动物最合适的肌源性诱导分化方法。间充质干细胞是一类多能性干细胞,具有分化成脂肪组织、骨组织和软骨组织的潜力。已有的一些研究发现,间充质干细胞可以诱导分化形成肌细胞,然而分化效率很低[36-38]。未来将MSC 作为种子细胞,需要进一步研究畜禽动物间充质干细胞的分离和培养方法,进行肌源性定向诱导分化研究,提高分化效率。另外,MSC 可以作为脂肪组织的种子细胞,用来开发含有脂肪细胞的培养肉组织。
除了上述的干细胞,通过异位基因表达,可以让其它底盘细胞转分化为成肌细胞,作为种子细胞。底盘细胞可以选取常见的成纤维细胞等,细胞来源较为容易。该方法需要通过基因编辑操作,使底盘细胞表达成肌决定因子,如MYOD,PAX3/7等,从而具有肌源性的细胞命运[20]。利用这类方法制作种子细胞,需要首先注意基因编辑操作直接用于食品的安全性评价。另外,需要构建畜禽动物异位表达成肌决定因子细胞株[39]。
在培养肉的生产过程中,其它类型的种子细胞都需要诱导分化形成肌肉干细胞或者成肌细胞,通过肌源性细胞命运生产肌肉细胞和肌肉蛋白。在以下论述时,主要以肌肉干细胞作为讨论对象。
5.2 肌肉干细胞的干性维持
培养肉是需要在体外大量培养具有分化为肌管能力的种子细胞。以肌肉干细胞为例,肌肉干细胞的干性维持主要是维持细胞的增殖能力和肌源性分化能力。细胞在长期培养过程中会出现细胞增殖能力减弱,称为海佛里克极限(Hayflick Limit)[40]。其主要原因是端粒的长度在细胞分裂过程中逐渐缩短,最终引发基因组不稳定而导致细胞衰老[40]。不仅如此,体外培养还会造成表观遗传变异、蛋白质稳态失衡等一系列细胞衰老现象[41]。猪、牛等动物肌肉干细胞的体外培养结果表明:培养过程会导致细胞的增殖能力减弱,干性基因表达量下降,细胞的肌管形成能力和修复肌肉损伤的能力也显著降低[28-29]。目前有研究发现,通过添加一定的炎症因子来模仿骨骼肌再生的炎症环境,能够帮助肌肉干细胞增殖和干性维持[42-43]。另外,抑制p38 信号通路也可以维持体外培养的肌肉干细胞干性[29,44]。目前的研究大多集中在小鼠模型上,未来能否借鉴应用于畜禽农产动物,还需做大量的研究。另外,能否通过基因编辑维持端粒酶活性,从而维持端粒的长度,延缓畜禽动物肌肉干细胞衰老,也需进一步研究。
5.3 无血清培养基
胎牛血清是体外培养基中常见的补充物,然而胎牛血清来源困难,营养成分未知,批次之间品质难以控制,有感染病毒风险等问题[45]。建立无血清培养方法对于降低培养肉的生产成本,保证生产过程的可控性非常重要。J.van der Valk 等[45]总结了开发无血清培养基的模块化方法。在该金字塔模型中,由下到上包括基础培养基、细胞外基质包被的培养表面、生长因子、激素、β-巯基乙醇、脂类、维生素等。越接近金字塔顶部,作为无血清培养成分的特异性越高[45]。目前针对胚胎干细胞、血液干细胞已开发出无血清培养基[46-47]。早期针对肌肉干细胞或成肌细胞的无血清培养发现,适宜的睾酮激素能够帮助成肌细胞增殖[48]。类胰岛素生长因子也能够持续促进成肌细胞增殖[49-50]。Florini 等[51]进一步测试了各类激素、糖蛋白和生长因子,最终总结出一种成肌细胞无血清培养条件。该培养基用Ham’s F-12 作为基础培养基,添加胎球蛋白、胰岛素和地塞米松,最终得到的培养基能够达到与10%马血清培养基相似的增殖效率[51-52]。无血清分化培养基也是培养肉的研究重点,通过IGF-1 等生长因子配制的无血清分化培养基帮助成肌细胞体外分化,然而效率还有待提高[53-55]。另一种商业的血清替代物Ultroser G 能够帮助成肌细胞更好地分化融合为肌管[28,56-57]。然而,Ultroser G 含有人源蛋白,从而限制了其在培养肉研究中的应用。在胚胎干细胞体外分化为肌肉细胞的研究中,利用胰岛素和N-2 培养基组成的无血清培养基也可以诱导肌管分化[58-59]。
对于培养肉而言,将小鼠和人的无血清研究成果转化应用到畜禽动物细胞上,并进一步优化到食品领域,仍是一个巨大的挑战。未来研究应通过转录组学、代谢组学(包括脂质组学、糖组学等)、蛋白组学等多组学联用,建立肌源性细胞增殖、分化等生物学过程中的营养物质的摄入和废弃物产出的“精准营养”调控过程,从而实现无血清培养基的个性化定制。另外,筛选出培养肉所需的生长因子等重要无血清成分后,利用生物工程技术,合成相关功能因子,从而大幅降低培养基成本,提高培养基的稳定性[4,60]。
5.4 种子细胞大规模培养
Mark Post 教授第1 块85 g 培养肉汉堡约含有1.5×1010个成肌细胞,经过诱导分化生成培养肉组织[9]。而普通的10 cm 培养皿只能生产约1×106个细胞。如何实现工业化种子细胞生产,也是制约培养肉产业化的重要难题。传统的二维培养因较低的表面积体积比,不能对培养条件进行实时监测,传代过程繁琐等一系列不足而不能用于培养肉种子细胞的扩大培养。大规模培养通常所用的方法是微载体悬浮培养[61]、固定化培养[62]或者聚集体悬浮培养[63]等方法。肌肉干细胞由于贴壁培养以及分化过程中需要细胞融合的生物学特性,因此选择微载体悬浮培养是目前较为可行的培养方法。微载体细胞培养就是使细胞在微载体表面附着生长,同时通过持续搅动使微载体始终保持悬浮状态,其兼具悬浮培养和贴壁培养的优点[64]。
微载体培养成肌细胞过程中,高密度容易发生细胞聚集和分化现象[65]。Pascale Boudreault 等[66]详细研究了二维培养和三维培养现象,发现早期的流体剪切力会抑制细胞生长。Sanne Verbruggen等[61]研究发现,牛的成肌细胞能用几种商业的微载体悬浮培养,并且细胞可以实现在微载体上的转移。上述研究仅针对1 L 以下的转瓶条件,而在2~20 L 生物反应器以及更大的超过200 L 的生物反应器中还没有详细研究[60,67]。未来的研究首先应关注畜禽动物肌肉干细胞高密度培养下的干性维持;然后,需要优化微载体培养时的种类、微载体含量、细胞接种数目、搅拌频率等工艺参数;最后,需要设计规模200 L 以上的生物反应器,培养条件如细胞摄入氧气的动力学参数、剪切应力对细胞的影响等也需进一步研究[67]。
5.5 种子细胞大规模分化形成肌管
在生理状态下,肌肉组织最终通过筋腱连接在骨骼上。通过模仿生理状态下的肌肉,这种拉伸的组织工程模具能够帮助肌肉细胞的排列、延伸,最终形成良好的收缩性和功能的肌肉组织[68-70]。目前用于生产肌肉组织的模具主要有单柱型、双柱型以及多柱型[9,68]。然而,传统的组织工程所生产的肌肉组织较小,通常应用到药物筛选和小鼠模型研究中。如何生产较大的肌肉组织用于培养肉生产也成为一大难题。未来研究应聚焦于大型肌肉组织模具的开发,并研究如何大批量生产肌肉组织的方法。
在生理状态下,骨骼肌肌肉细胞在细胞外基质的包裹下有序排列,形成肌肉组织。这些细胞外基质一般包括层粘黏蛋白、胶原蛋白IV、胶原蛋白I 和糖蛋白等[71-73]。在三维的肌肉组织研究中,通常用天然分离的生物材料或合成的生物材料作为细胞外基质[74]。未来的支架材料应首先利用现有的食品动物源蛋白材料(胶原蛋白、明胶等)作为支架材料,研究培养肉肌肉组织生产过程和工艺,作为培养肉的过渡生产方式[75]。然而,培养肉的初衷是减少动物饲养,要研究非动物源的生物材料,如植物源的蛋白以及多糖类大分子,通过修饰或者改性后用于肌肉组织生产[76]。另外,研究一些可生物降解的合成材料,如聚乳酸,用于培养肉组织生产。最后,依据生物支架材料所需的特性,利用合成生物学的方法生产,如用大肠杆菌、酵母等生产体外重组胶原蛋白等[77]。
由于培养肉的主要目的是获得分化的肌细胞,并大量生产肌肉蛋白,因此提高细胞的分化效率以及蛋白合成效率也是需要研究的重要课题。IGF-1/PI3K/Akt 信号通路[78],mTORC1 信号通路[79]可以帮助肌细胞在体外分化并诱导肌管肥大,从而增加肌管的蛋白质合成。Insulin,IGF 和Wnt7a等可以通过这些信号通路来诱导肌管肥大[80-81]。机械拉伸作用[82-83]、电刺激[84]也能进一步帮助肌管成熟。明确这些信号通路在畜禽农产动物成肌细胞分化中的作用,从而帮助培养肉的蛋白生产还需进一步研究。
培养肉生产的最终目标是在体外培养1 块与真实肌肉组织相同的肌肉组织,因此需探索分化形成大块肌肉组织的方法。三维结构支架+灌注式反应器是一种潜在的方式[3]。然而,经过测算,这样的方式仅能用于几毫米到1~2 cm 厚的支架,相关的生物反应器也需要进一步开发[67]。另外,现阶段的3D 打印技术可以实现较大块的肌肉组织生产。Kang H W 等[69]利用3D 打印的方式,生产出1块(15×5×1)mm3的小鼠肌肉组织。未来可以通过混合可食用支架材料以及不同种细胞,直接3D打印肌肉组织用于培养肉的生产。
5.6 食品化技术
现阶段,各公司和科研机构生产的培养肉肌肉组织在肉特有的色、香、味、型等方面还存在不足,需要通过商品化加工和重塑成型处理,制成培养肉产品[85]。食品化的首要前提是了解畜禽动物的肌肉组织构成以及产品的色、香、味、型形成原因。在肌肉组织中,血红蛋白和肌红蛋白是肉类颜色的主要来源;脂质氧化、美拉德反应是肉品风味的重要来源;肌肉细胞内的小分子代谢产物,加工过程中大分子降解生成的一些小分子肽、氨基酸、核苷酸等是肉品滋味的主要来源;而肉品的加工特性如乳化特性、凝胶特性等都是依赖肌原纤维蛋白和肌浆蛋白的作用[24,86-87]。根据色、香、味、型的形成原理,利用添加各种辅料以及培养肉自身的蛋白特性,制作培养肉产品[88]。赵鑫锐等[85]综述了培养肉食品化的一些途径,包括生物合成血红蛋白以维持产品的色泽和风味,体外美拉德反应形成风味物质,生物合成脂肪酸等以丰富产品的色、香、味等办法,用于未来培养肉产品的产业化开发。未来研究中除了要开发利用生物合成、体外化学合成生产培养肉的加工辅料外,还应关注如何提高培养肉自身肌红蛋白合成,以及研究培养肉生成的肌肉蛋白对色、香、味、型的作用。
5.7 培养肉产品安全评价与管理规范制定
由于培养肉是新兴的肉类生产技术,因此其安全性需要慎重研究。美国食品药品监督管理局已经和美国农业部就培养肉监管问题进行了多次商讨,制定了管理框架[89]。国内一些学者也在积极研究培养肉的生产过程,探讨培养肉安全性评价和监管办法[90]。培养肉的食品安全风险主要来自生产过程中的化学安全、生物安全和营养安全[5,90]。对于化学安全,主要是生产过程中的化合物成分、支架材料、模具材料以及加工辅料等,这些材料对于细胞的增殖、分化以及产品加工等过程非常重要,然而许多材料还没有食品安全使用史[5,90]。生物安全一方面是细胞在分离、增殖和分化过程中,可能在体外培养过程中产生了基因突变而带来与体内发育过程不一样的细胞核酸、蛋白等成分。另一方面,采用基因编辑等手段进行种子细胞改造时,容易引入高风险的生物外源物质,因此更要对细胞的功能和食用特性进行致敏性、毒性等安全性评价[91]。此外,需要考虑培养肉与普通肉在组成成分、加工后成分变化以及食用后的消化吸收情况,评估培养肉的摄入标准与营养价值。未来应针对相应的化学、生物和营养安全,建立培养肉产业链条中各产品的安全性评价指标,构建培养肉营养评价模型,制定培养肉评估暴露膳食摄入标准,为培养肉的市场推广提供安全性政策、法规保障[5,90]。
6 结语
培养肉作为一种未来食品生产技术,可以实现肉类蛋白的高效绿色生产。未来培养肉研究应围绕如何产业化生产肌肉蛋白这一核心问题,在基础研究、扩大生产、食品化技术以及市场准入等方面继续攻关。目前欧美等国正处在技术攻坚和商业化应用开拓的关键时期,我国也应该加大培养肉投入,力争在未来的培养肉技术竞争中实现并跑甚至领跑。最终让培养肉能早日走上百姓餐桌,保障我国未来动物蛋白供应。
