乳酸菌群体感应系统研究进展
2020-05-23逄晓阳张书文李伟勋吕加平
逄晓阳,朱 青,芦 晶,张书文,刘 浏,杨 兰,李伟勋,吕加平
(中国农业科学院 农产品加工研究所,北京 100193)
乳酸菌是一类能利用可发酵碳水化合物产生大量乳酸的革兰氏阳性细菌,这类细菌在自然界分布极为广泛,具有丰富的物种多样性,至少包含18个属,共200多个种。乳酸菌是世界公认的对人类健康有益的安全菌株,在代谢过程中合成的抗菌肽有溶菌作用,故可作为天然食品防腐剂;乳酸菌代谢产生的大量胞外多糖和有机酸有助于发酵产品风味和质地的形成,乳酸菌具有较强的耐酸、耐盐能力,加入腌制品中可增加风味防止食物败坏[1],广泛应用于食品工业中;乳酸菌也是存在于人体消化道内的益生菌,在生长过程产生的有机酸和分泌的胞外抗菌肽,可抑制病原微生物的生长繁殖、调节肠道微生物菌群的平衡[2],从而对宿主的营养状态、生理功能、应激反应等产生作用。Yin等[3]研究证明,乳酸菌可降低血液中胆固醇含量,且具有抑制肠道炎症的潜力,所以在医学领域也有重要应用前景;此外,随着高通量测序技术的飞速发展,乳酸菌的功能基因组研究也取得了瞩目进展,成为研究功能基因、遗传分类学等的理想材料。乳酸菌在理论研究与生产实践都具有重要的应用价值。
近年研究发现,群体感应(quorum sensing,QS)系统会调控乳酸菌的多项重要生理功能,如调控菌体生物膜的形成[4]、抗菌肽的合成[5]、胞外酶的合成[6]、肠道定殖能力[7]等等。乳酸菌QS系统通过细胞密度的改变进行信息传递,同时根据信号分子的供体和受体是否为同一种菌,将群体感应系统分为种内信息交换系统和种间信息交换系统[8-9]。种内信息交换以自诱导肽(AIP)作为信号分子,前体AIP被转录修饰形成成熟的AIP分子[10],然后借助位于细胞膜上的ABC(ATP-binding cassette transporter)转运系统或其他膜通道蛋白转运达到细胞外[11],当分泌到周围环境中AIPs的浓度达到某个阈值时,位于细菌细胞膜上的双组分系统(two component signaling system,TCS)会被AIPs所激活,通过磷酸化的方式将群体感应信号传递给下游靶基因,并调控相应靶基因的表达[12],有些细菌的sRNA也参与在这个信号的传递过程中。另一方面,种间信号传导是不同种属细菌之间的信号交流模式,目前发现该类交流模式常用的信号分子是AI-2(autoinducer-2)类信号分子。研究表明,无论革兰氏阳性菌和革兰氏阴性菌中都存在通过AI-2信号分子感应环境变化的AI-2/LuxS QS调控机制[13-15],经证实,参与QS的luxS基因可调控乳酸菌的许多生理活性[16]。目前被证实有两种合成AI-2的方法,一种是使用蛋氨酸作为起始原料的四步酶促反应途径,另一种方法则是基于细菌的半生物合成途径(图1)。
细菌的群体感应系统包括AIPs 信号分子和TCS。典型的TCS由组氨酸蛋白激酶(HPK)和反馈调节蛋白(RR)组成。表1列出了已报道的乳酸菌感应信号分子及其参与的生理功能。

图1 AI-2合成途径[15]Fig.1 AI-2 synthesis pathway[15]
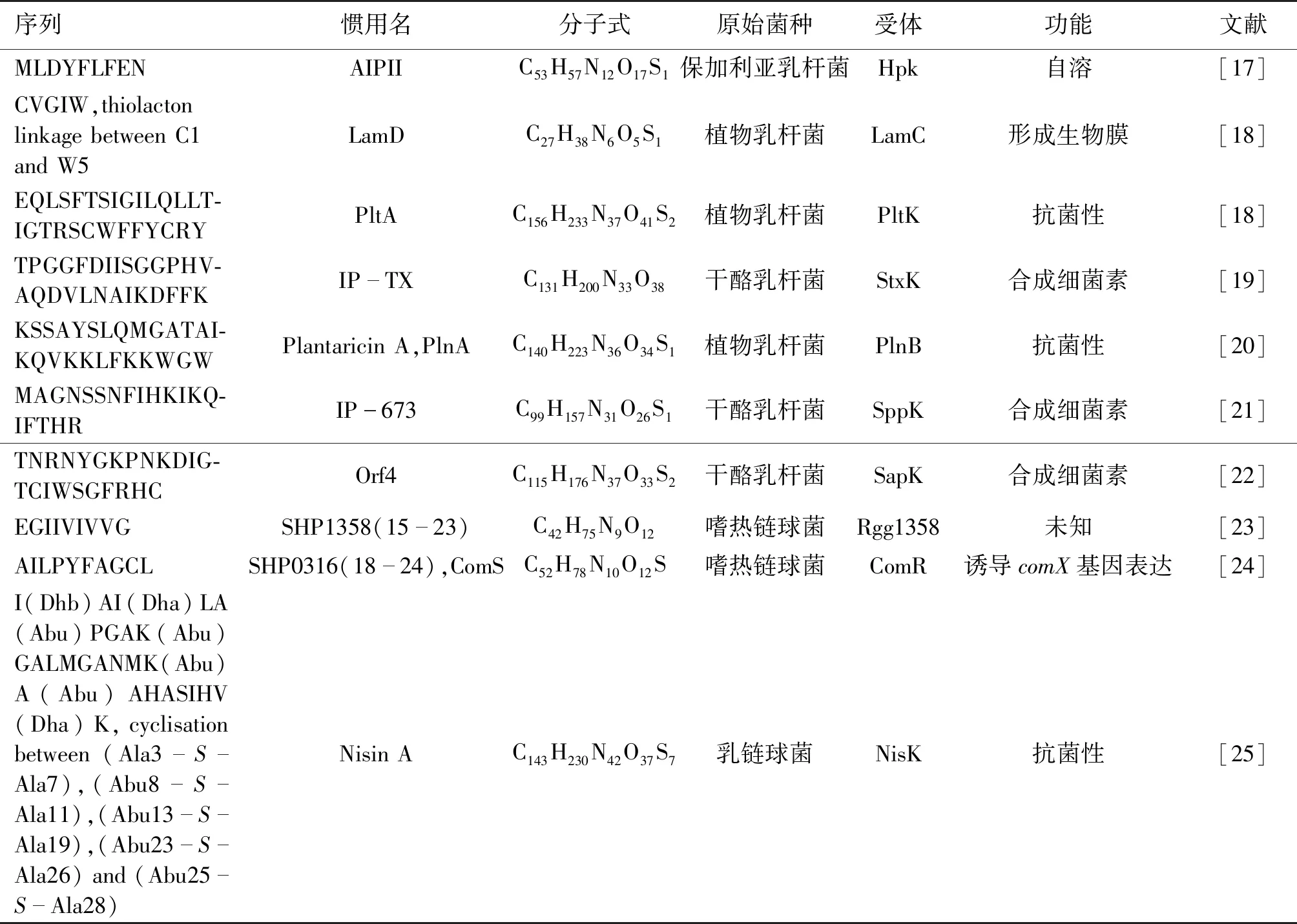
表1 乳酸菌群体感应信号分子Table 1 Lactic acid bacteria quorum sensing signal molecule
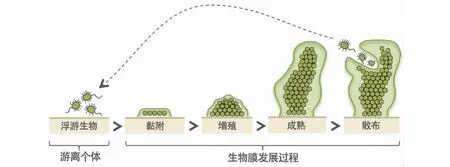
图2 生物膜形成过程[26]Fig.2 Biofilm formation process[26]
1 群体感应系统调控乳酸菌生物膜的形成
生物膜是一种高度组织化的微生物菌落聚集体,由黏附在惰性物体或活生物体上的细菌形成,并被细菌自身分泌的胞外基质包裹。除了水和细菌外,生物膜还含有细菌分泌的大分子多聚物、吸附的营养物质和代谢产物等。它是细菌为了抵抗不利环境而形成的一种自我保护形式,除了为细菌提供黏附力还赋予细菌高度的疏水性。在自然界中,除了少数浮游生物不合成生物膜以外,大多数的细菌都以生物膜的形式存在。因为生物膜可提高乳酸菌对胃酸和胆盐渗透的抵抗力,因此推测乳酸菌生物膜的形成可能间接影响其益生功能的发挥。
乳酸菌生物膜的形成是细菌在物体表面从可逆黏附转变为不可逆黏附并积聚的过程,其通过群体感应系统和细菌间的相互作用来调控。由于形成生物膜的细菌与生物膜直接接触,所以与浮游细菌相比,其生理功能已经发生了巨大改变。另外,位于生物膜不同位置的细菌也有很大差异,一般来说位于生物膜表层的细菌更容易接触到环境中的营养物质,所以分裂更快、代谢更活跃,而位于膜内层的细菌只能通过特定运输通道获得营养物质、排泄代谢产物,因此营养匮乏,易受到积累的代谢产物的毒害。所以内层细菌代谢缓慢,多处于休眠期。生物膜的形成大致分为以下几个过程(图2):首先,细菌通过鞭毛运动初步附着在物体表面,此时的黏附依赖于细胞表面的理化性质,膜尚未形成,是一个可逆的黏附。其次,聚集的细菌开始向环境中分泌胞外基质,其主要成分为多糖类、脂蛋白、纤维蛋白以及细胞外DNA等,在这些多糖类黏性基质的介导下,细菌黏附力增强,菌体也越来越多,形成了不可逆黏附。最后,随着胞外基质的增加,菌体的堆积,菌落形成有一定组织结构的聚集体,生物膜逐渐成熟。其中,最关键的步骤是:膜表面的细菌分泌更多的胞外基质提高细菌的附着力,进一步提高其在物体表面形成生物膜的能力,已经有研究证明,群体感应系统可通过感知胞外化学信号的浓度改变从而调控细胞膜的形成,在细菌黏附积累过程中发挥重要作用。
1.1 群体感应系统与细菌黏附的关系
促进生物膜形成和成熟的关键因素是菌体的累积和菌体黏附性的增强。生物膜形成能力与细胞黏附之间的关系已经在一些研究中得到证明。
Salas-Jara等[26]研究表明,在加了粘蛋白且不加葡萄糖的MRS培养基中,鼠李糖乳杆菌形成生物膜的能力提高了20%;在高浓度的胆汁和黏液中,植物乳杆菌和发酵乳杆菌可以形成生物膜。Lebeer等[27]得到了一个鼠李糖乳杆菌突变株,该菌株含有与细胞外多糖合成相关的基因,与野生型相比,该基因的突变株有更高的生物膜形成能力。此外,已经有关于QS系统的信号分子可以影响乳酸菌黏附的报道,luxS是AI-2分子合成的关键酶基因,Buck等[28]发现,与野生型菌株相比,luxS基因缺失的嗜酸乳杆菌突变体黏附至肠上皮细胞的能力降低了58%。Sturme等[12]在植物乳杆菌WCFS1中发现了与金黄色葡萄球菌agrBDCA系统同源的lamBDCA系统。在agrBDCA系统调控生物膜形成的过程中,AgrD充当合成有独特硫酯环结构的八肽型AIP前体,并通过AgrB膜蛋白被转运到细胞外。随着细胞密度的增加,AIP的浓度逐渐增加,结合组氨酸激酶受体AgrC并将其磷酸化,然后激活应答调控剂AgrA。活化的AgrA与总调控剂SarA协同作用激活了细胞内RNAII(与QS扩增相关的基因)和RNAIII(与胞外蛋白合成相关的基因)的转录[29](图3)。在植物乳杆菌WCFS1的lamBDCA系统中,LamD是一种自我诱导的前体肽,被LamB加工蛋白加工成LamD衍生肽,两者均由lamBD基因表达。LamD衍生肽是类似于agr系统中AIP结构的环状硫代内酯五肽,被命名为LamD558。Sturme等[30]研究发现,Lam系统参与了植物乳杆菌表面黏附的调控,这表明乳杆菌中的agr类QS系统(lamBDCA系统)在改善细胞黏附方面具有不可忽略的作用。因此QS系统可以为乳酸菌生物膜的形成提供一些证据。

图3 金黄色葡萄球菌的agrBDCA系统[29]Fig.3 agrBDCA system of Staphylococcus aureus[29]
1.2 群体感应系统诱导生物膜形成的机制
群体感应系统可以介导乳酸菌生物膜的形成。Lebeer等[27]的一项研究发现,LuxS基因缺失的鼠李糖乳杆菌突变株形成生物膜的能力下降,若在突变株中添加AI-2前体分子或野生型菌株,虽无法使突变株恢复到原始形成生物膜水平,但可部分弥补突变菌株对生物膜形成的影响。乳杆菌自生肽信号分子在乳杆菌生长过程中表达水平较低,但当细胞密度达到某个阈值时,它将与TCS中的受体激酶HPK结合,进行自我磷酸化,然后活化反应的调控剂(RR)被磷酸基团转移,从而导致动态范围的自身诱导。群体感应系统介导的乳酸菌生物膜的形成在生物膜的生长和传播中起了重要作用,生物膜的生长期指细菌不可逆附着和积累的时期,该阶段的特征是:向细胞外分泌黏性基质、乳酸菌大量黏附和聚集、通过信号分子感知细胞密度,以及在达到阈值后细胞转录特定RNA从而促进生物膜的成熟。生物膜成熟后,固有细菌的代谢废物只能通过间隙水通道运出,当大量的细菌在有限空间中附着在生物膜上时,会发生代谢废物的积累以及种内或种间竞争,在此过程中,细菌QS系统通过不利环境因素激活特异基因的表达,调控细菌生物膜的部分脱落。因此,细菌又变成浮游形式,从而防止了细菌的过度生长、代谢废物的积累和营养的缺乏。
2 群体感应系统调控乳酸菌自溶
乳酸菌是生产酸奶和其他乳制品常用的发酵剂。在发酵过程中,乳酸菌菌体会随着发酵密度的增加出现菌体裂解的现象,该现象称为乳酸菌的自溶。乳酸菌的自溶会对发酵乳制品的品质产生较大影响,近年来引起了越来越多的关注[31-32]。在奶酪生产过程中,奶酪的成熟阶段对于确定最终产品的风味和质地至关重要[33],自然情况下该过程最少需要3周,有的甚至要持续超过2年,所以自然成熟奶酪的生产是一个漫长的过程[34]。加快奶酪成熟的一般做法有:适当提高发酵温度、选用合适的发酵剂[35]和补充酶制剂[36]。实践证明,选用合适的乳酸菌发酵剂是安全、成本低廉且效果显著的一种解决方案,这是由于发酵菌株自溶会释放出胞内酶,这种酶有促进肽链的降解和去除苦味的作用[37-40],可以将奶酪中的大分子蛋白降解为短肽甚至是氨基酸[37]。因此,在加快奶酪成熟过程中定向调控发酵菌株的自溶非常重要。在生产酸奶过程中,乳酸菌自溶可显著降低发酵终产品中的活菌数量[41],因此需要开发低自溶度的发酵剂菌株来生产酸奶、益生菌等饮品。以上干酪和酸奶的案例都证明了乳酸菌自溶对发酵乳品工业会产生重要影响,因此揭示其自溶的分子机制,并根据生产实践需要定向调控其自溶的进程具有重要意义。
细菌通常通过双组分系统(TCS)感知环境中的各种变化并对其作出反应[41]。在大多数细菌中都发现了TCS,它主要是作为环境感受器和细胞信号传导因子[42-44]。对乳酸菌进行全基因组测序和基因功能分析后发现,每个乳酸菌基因组均编码多个TCS系统[45],但是很多TCS涉及的生物学功能还没有被系统研究。目前已有的研究证明有的TCS与细菌素的合成有关[46],有的TCS与耐酸性有关[45],有的TCS与胆汁耐受性有关,还有的TCS系统(源于植物乳杆菌lamBDCA)与菌体黏附性有关。
以保加利亚乳杆菌BAA-365为例,要研究一个未知TCS系统,通常要采用如下的方法:从NCBI和Pfam数据库中获取组氨酸蛋白激酶(HPK)和反馈调节蛋白(RR)保守结构域的hmm文件,用Hmmer软件扫描保加利亚乳杆菌BAA-365的蛋白质组序列,以预测可能的HisKA、HATPase-c和Response-reg位点。结果如表2所示,总共发现了7个HPK和7个RR。

表2 保加利亚乳杆菌BAA-365 TCS系统的功能预测[47]Table 2 Functional prediction of L.bulgaricus BAA-365 TCS system[47]
注:L.aci—Lactobacillusacidophilus;E.fae—Enterococcusfaecalis;L.sak—Lactobacillussakei;L.cri—Lactobacilluscrispatus;L.equ—Lactobacillusequicursoris。
保加利亚乳杆菌BAA-365共有7个TCS系统,其中有5个TCS已被报道分别与胆汁耐受性、万古霉素抗性等相关,还有2个TCS的功能未知。为了研究这2个TCS系统潜在的生物学功能,笔者运用分子生物学技术敲除功能未知的TCS编码基因,结果显示,与野生型BAA-365相比,LBUL_RS00115基因突变体的自溶速率明显较低,这表明LBUL_RS00115(WP_011677872.1的编码基因)与保加利亚乳杆菌的自溶相关(图4)[17]。
此外,通过酵母双杂交分析发现,在WP_011677872.1和WP_011677871.1之间存在直接磷酸化的相互作用。以上结果表明,WP_011677872.1/WP_011677871.1的TCS与保加利亚乳杆菌菌体自溶有关。总的来说,保加利亚乳杆菌在其生长过程中会向周围环境分泌一个信号肽分子,当周围环境中信号肽的浓度达到或超过阈值时,位于细胞壁上的组氨酸蛋白激酶vicK就会启动磷酸化反应,进而反馈调节蛋白vicR磷酸化。磷酸化的vicR与位于lytM、ssaA和atlA的RNA聚合酶结合,促进了这3个基因的表达,且表达的肽聚糖水解酶加速了细胞壁的裂解(图5)[47]。

图4 菌体自溶度检测结果[47]Fig.4 Autolysis data[47]

图5 保加利亚乳杆菌通过vicKR途径调控菌体自溶[47]Fig.5 Lactobacillus bulgaricus regulates autolysis through vicKR pathway[47]
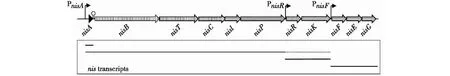
图6 乳链球菌素生物合成的基因簇Fig.6 Organization of Nisin biosynthetic gene clusters
3 群体感应系统调控羊毛硫抗生素合成
许多乳酸菌都可合成羊毛硫抗生素,该过程通过细胞密度依赖性的方式受到调控。羊毛硫抗生素通常在对数生长中期到后期开始合成,在静止期达到最大值。研究显示,在许多情况下这种调控模式都涉及小肽类信号分子(信号肽)[25]。乳酸菌在生长过程中会不断向周围环境中分泌这些信号肽,当浓度达到一定阈值时,信号肽与其关联受体(组氨酸蛋白激酶)相互作用,通过跨膜信号的传递,触发羊毛硫抗生素的高效表达。群体感应通过信号分子浓度的介导感知菌体密度,当菌体密度增加时,信号分子的浓度也会随之增加,激活信号转导等一系列级联反应调控细菌素的表达。
羊毛硫抗生素是最常见的乳链球菌素,它是一类小分子热稳定段肽,具有广泛的抗菌活性,作为一种天然防腐剂,在食品工业中的应用广泛。乳链球菌素的生物合成由nisABTCIPRKFEG基因簇完成(图6),基因簇包括编码乳链球菌素前体(nisA)的结构基因、转录后修饰基因(nisB,nisC)、跨膜转运基因(nisT)、切割前导序列的肽蛋白酶基因(nisP)、编码免疫蛋白基因(nisI、nisF、nisE、nisG)和菌肽合成的调控基因(nisK、nisR)。
乳链球菌素的合成受双组分信号转导系统NisK和NisR的调控[48]。当组氨酸蛋白激酶NisK或应答调控蛋白NisR被破坏时,则不能合成乳链球菌素。乳链球菌素合成的群体感应调控过程如图7所示。首先,在细胞中形成乳链球菌素前体,接着NisB和NisC修饰该前体,然后被NisP裂解后,由NisT转运到细胞外。乳链球菌肽作为信号分子积累到一定阈值时被双组分调控系统NisK、NisR识别,使细菌素合成基因表达。由于存在免疫蛋白,所以细菌本身不会被菌肽杀死或抑制。
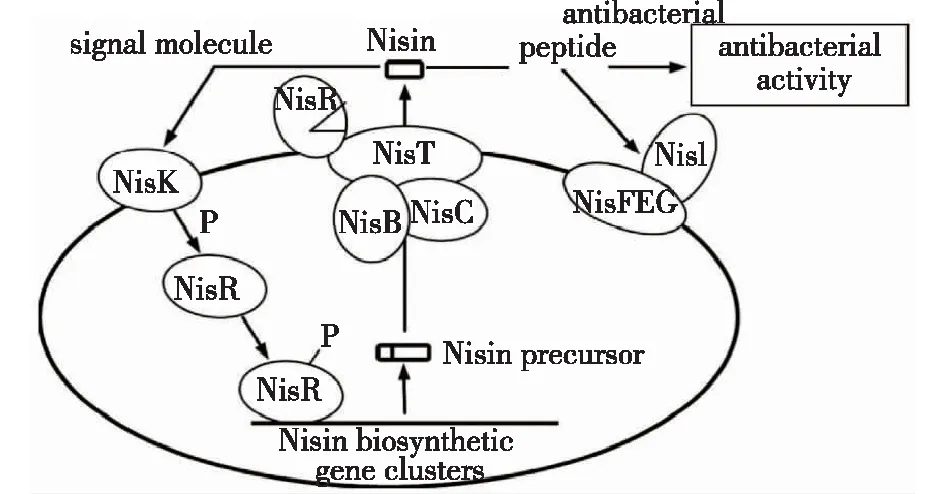
图7 乳链球菌素合成的群体感应调控过程[48]Fig.7 Regulation of Nisin synthesis by quorum sensing in LAB[48]
4 群体感应系统调控酸胁迫应答
对乳酸菌环境胁迫的研究主要是酸胁迫研究。Moslehi-Jenabian等[49]研究发现,逐渐适应酸胁迫环境的乳酸菌存活率高于那些直接暴露于酸环境的乳酸菌,适应酸胁迫环境的乳酸菌产生的信号分子AI-2的浓度低于直接暴露于酸环境的乳酸菌产生的浓度,同时,信号分子AI-2的分泌随pH的降低而增加。鼠李糖乳杆菌GG和嗜酸乳杆菌NCFM中luxS基因的转录水平在酸性胁迫时间达1 h时显著增加,并且不同菌株之间的转录水平存在差异,这可能是由于luxS基因参与了菌株的自我保护过程。Rorers等[50]发现在低剂量的青霉素刺激下,肺炎链球菌过表达luxS基因来自我保护。在鼠李糖乳杆菌GG的研究中发现,luxS基因突变的菌株耐酸性显著降低,这也表明luxS基因在鼠李糖乳杆菌GG的酸胁迫适应过程中起重要作用。以上结果表明,由AI-2介导的QS系统可能参与了乳酸菌的酸胁迫应答反应。
5 总结与展望
群体感应系统是乳酸菌与环境相互作用的重要调控机制。近些年来,已经广泛开展了与乳酸菌基因组相关研究,例如用生物信息学的方法预测和分析已知乳酸菌的基因组,为在分子水平上系统地阐明乳酸菌的生理和代谢机制提供了可能。虽然已在保加利亚乳杆菌、嗜酸乳杆菌和其他乳酸菌中发现了群体感应系统,但仍有许多问题有待进一步探索,例如:AI-2是否仅调控细菌本身的行为?它是否还参与与环境中其他细菌的交换?乳酸菌群体感应系统的深入研究有助于阐明乳酸菌适应环境以及益生功能的机制。
