响应面法优化乳酸菌抽提物的制备工艺研究
2022-09-28刘依盟鲍正好李雨晴王春婷金银玉闫志鹏贾丽娜
刘依盟,鲍正好,马 倩,李雨晴,王春婷,金银玉,闫志鹏,贾丽娜,齐 威
(天津科技大学 生物工程学院,天津 300457)
乳酸菌(lactic acid bacteria,LAB)是一类能利用碳水化合物产生大量乳酸的无芽孢、革兰氏阳性细菌的通称[1],其广泛分布于人体、动物体、植物以及发酵食品中,部分已经被列入可用于食品的菌种名单[2-3]。它们不仅是研究生化、遗传、分子生物学和基因工程的理想对象,同时在工业、农牧业、食品和医药等与人类生活密切相关的重要领域应用价值也极高[4-6]。乳酸菌在自溶过程中,会释放胞内蛋白酶、肽酶、酯酶等多种酶类,能够将蛋白、多肽和脂肪分解成不同的风味成分或风味前体成分[7]。乳酸菌自溶物含有多种风味物质、胞内代谢物,可能具有潜在的营养、保健功能、调香调味等作用和用途。
目前,对以乳酸菌为原料,将乳酸菌细胞内的蛋白质、核酸等进行降解及后加工的纯天然乳酸菌抽提物的研究报道较少。因此本试验以自溶率为评价指标,探究NaCl、溶菌酶、超声、蛋白酶对乳酸菌自溶的影响,进一步利用Box-Behnken响应面法优化乳酸菌抽提物制备工艺参数,并对乳酸菌抽提物的氨基酸态氮、蛋白质、总酚、抗氧化能力、挥发性风味成分等营养和功能指标进行分析研究。以期明确乳酸菌抽提物含有的营养成分、香气物质和保健功能,为乳酸菌抽提物应用于食品添加剂和保健食品等领域提供基础理论依据。
1 材料与方法
1.1 材料与试剂
植物乳杆菌(Lactobacillus plantarum)CGMCC8198:由本实验室保存;中性蛋白酶(50 000 U/mL)、酸性蛋白酶(100 000 U/mL)、碱性蛋白酶(300 000 U/mL)、胰蛋白酶(250 U/mg):山东隆科特酶制剂有限公司;溶菌酶(20 000 U/mg)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)试剂盒:北京索莱宝科技有限公司。
1.2 仪器与设备
Agilent 7890B气相色谱-5977B质谱联用仪:美国安捷伦公司;SpectraMAX 190酶标仪:美国Molecular Devices公司;FE20 pH计:瑞士Mettler Toledo公司;Scientz-1200E超声破碎仪:宁波新芝公司;50/30 μm二乙烯基苯/羧基/聚二甲基硅氧烷(divinylbenzene/Carboxen/Polydimethylsiloxane,DVB/CAR/PDMS)复合萃取头:美国Sigma公司;HP-5极性毛细管柱(30 m×0.25 mm×0.25 μm):美国安捷伦公司。
1.3 方法
1.3.1 乳酸菌抽提物制备工艺流程及操作要点
乳酸菌培养→离心收集乳酸菌泥→配制乳酸菌悬液→自溶(超声、自溶促进剂、蛋白酶等)→加热灭酶活→离心分离→收集上清液→冷冻干燥成粉状
乳酸菌培养:①活化:挑取L.plantarumCGMCC8198小菌落接种于10 mL MRS液体培养基37 ℃厌氧培养24 h。②一级种子液:以10%的接种量接种于MRS液体培养基中,置于37 ℃厌氧培养12 h。③二级种子液:以10%的接种量接种于MRS液体培养基中,置于37 ℃厌氧培养至对数中后期。④乳酸菌扩大培养:以10%的接种量接种于MRS液体培养基中,置于37 ℃厌氧培养至稳定期。
离心收集乳酸菌泥:将乳酸菌在离心机中以4 500~5 000 r/min离心分离15~20 min。
配制乳酸菌悬液:用pH 6.8~7的磷酸盐缓冲液(phosphatebuffersaline,PBS)溶液重悬乳酸菌泥,悬液浓度为10%。
自溶:在适宜的温度和pH条件下,利用超声处理、添加一定浓度的氯化钠、溶菌酶和蛋白酶等,使乳酸菌溶解。
加热灭酶活:在85~95 ℃条件下保温15 min,使溶菌酶和蛋白酶等失活。
离心分离,收集上清液:将乳酸菌在离心机中以4 500~5 000 r/min离心分离15~20 min。
冷冻干燥:上清液样品放置冷冻干燥机物料盘内,开机设置温度为-40 ℃,预冻样品4 h。冻干条件为真空度10 Pa,冷阱温度-55 ℃。上清液通过低温冷冻干燥制得粉状乳酸菌抽提物。
1.3.2 乳酸菌抽提物制备工艺优化单因素试验
超声功率对乳酸菌自溶率的影响:配制10%乳酸菌悬浮液(pH7),超声破碎(0 ℃,工作时间2 s、间隔3 s、工作次数600次),超声功率分别设置为90 W、190 W、285 W、380 W、475 W,测定乳酸菌自溶率。
NaCl添加量对乳酸菌自溶率的影响:配制10%乳酸菌悬浮液,超声破碎(超声功率285 W、工作时间2 s、间隔3 s、工作次数600次),分别添加2%、6%、10%、14%和18%(W/W)的NaCl,在37 ℃、pH7条件下自溶24 h,测定乳酸菌自溶率。
溶菌酶添加量对乳酸菌自溶率的影响:配制10%乳酸菌悬浮液,超声破碎(超声功率285 W、工作时间2 s、间隔3 s、工作次数600次),添加2%(W/W)的NaCl,分别添加1 000 U/g、3 000 U/g、5 000 U/g、7 000 U/g、9 000 U/g的溶菌酶,在37 ℃、pH7条件下自溶24 h,85~95 ℃加热15 min灭酶,测定乳酸菌自溶率。
蛋白酶添加量对乳酸菌自溶率的影响:配制10%乳酸菌悬浮液,超声破碎(超声功率285 W、工作时间2 s、间隔3 s、工作次数600次),添加2%的NaCl,添加3 000 U/g溶菌酶,在37 ℃、pH7条件下自溶24 h后,再分别加入5 000 U/g、7 000 U/g、9 000 U/g、11 000 U/g、13 000 U/g的酸性蛋白酶、中性蛋白酶和碱性蛋白酶,分别在最适酶活的条件下自溶24 h,85~95 ℃加热15 min灭酶活,测定乳酸菌自溶率。
复合蛋白酶添加量对乳酸菌自溶率的影响:配制10%乳酸菌悬浮液,超声破碎(285 W、工作时间2 s、间隔3 s、工作次数600次),添加2%(W/W)的NaCl,添加3 000 U/g的溶菌酶,在37 ℃、pH7条件下自溶24 h后,再分别加入2 000 U/g、6 000 U/g、10 000 U/g、14 000 U/g、18 000 U/g复合蛋白酶(胰蛋白酶∶中性蛋白酶=1∶1),45 ℃条件下自溶24 h,测定乳酸菌自溶率。
1.3.3 响应面试验
根据Box-Benhnken中心组合设计原则,在单因素试验的基础上,以超声功率(X1)、溶菌酶添加量(X2)、复合蛋白酶添加量(X3)为自变量,以乳酸菌自溶率(Y)为响应值,进行3因素3水平的响应面试验分析,响应面试验因素与水平见表1。

表1 乳酸菌抽提物制备工艺优化响应面试验因素与水平Table 1 Factors and levels of response surface tests for preparation process optimization of lactic acid bacteria extract
1.3.4 测定方法
乳酸菌自溶率:紫外分光光度计(OD600nm值)检测乳酸菌细胞密度,计算乳酸菌自溶率[8]:
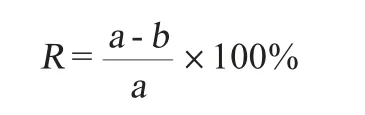
式中:R为乳酸菌自溶率;a为反应前的OD600nm值;b为反应后的OD600nm值。
pH:pH计测定;还原糖测定:3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法[9];总酸的测定:按照参考文献[10]的方法;抗氧化能力测定:使用DPPH自由基清除能力试剂盒;总酚含量测定:Folin-酚比色法[11];总黄酮含量测定:按照参考文献[12]的方法;氨基酸态氮的测定:按照参考文献[13]的方法。
顶空固相微萃取-气相色谱质谱分析:乳酸菌抽提物用生理盐水配制10%的溶液,15 mL顶空瓶装入待测样品5 mL,置于45 ℃恒温水浴中平衡10 min。然后将萃取头插入顶空瓶中,萃取头距样品液面距离约5 mm。萃取30 min后将萃取头插入气相色谱仪的进样口,解吸3 min。色谱柱为HP-5极性毛细管柱;升温程序:柱温60 ℃保持10 min,以5 ℃/min升至180 ℃,保持15 min;氢气流速47.0 mL/min,分流比10∶1,氢火焰离子化检测器(flame ionization detector,FID)温度260 ℃,进样口温度260 ℃。
质谱条件:离子源温度220 ℃,接口温度280 ℃,溶剂延迟时间3 min,电子能量70 eV,质量扫描范围50~500 amu。
定性及定量方法:采用美国国家标准与技术研究院(national institute of standards and technology,NIST)质谱库检索对比分析进行定性,采用面积归一化法进行相对定量。
2 结果与分析
2.1 乳酸菌抽提物制备工艺优化单因素试验结果
2.1.1 超声功率对乳酸菌自溶的影响
超声波是最常见的用于细胞破碎的实验技术,不同超声功率对乳酸菌自溶的影响如图1所示。由图1可知,当超声破碎功率为285 W,乳酸菌自溶率最高,达到42.3%。随着超声功率的增加,乳酸菌的自溶率没有显著提升。因此,选择285 W作为后续超声破碎处理条件。

图1 超声功率对乳酸菌自溶的影响Fig.1 Effect of ultrasonic power on autolysis of lactic acid bacteria
2.1.2 NaCl添加量对乳酸菌自溶的影响
乳酸菌在285 W超声处理后,分别添加2%、6%、10%、14%和18%(W/W)NaCl,自溶处理24 h后,不同NaCl添加量对乳酸菌自溶率的影响如图2所示。

图2 NaCl添加量对乳酸菌自溶的影响Fig.2 Effect of NaCl addition on autolysis of lactic acid bacteria
由图2可知,NaCl添加量为14%时乳酸菌自溶率最高,达到了51.44%。NaCl添加量为2%时乳酸菌自溶率可以达到48.82%。说明添加NaCl可以一定程度上促进乳酸菌自溶,但是对乳酸菌自溶率的影响不显著。在保证自溶率的同时,为了避免引入过多的盐离子影响后续添加的酶活。因此,选择NaCl添加量2%来促进自溶。
2.1.3 溶菌酶添加量对乳酸菌自溶的影响
乳酸菌在285 W超声和2%的NaCl处理后,分别添加1 000 U/g、3 000 U/g、5 000 U/g、7 000 U/g、9 000 U/g的溶菌酶,在37 ℃、pH7条件下自溶24 h,不同溶菌酶添加量对乳酸菌自溶率的影响如图3所示。由图3可知,溶菌酶添加量为5 000 U/g时,乳酸菌自溶效率最高,可达78.18%。溶菌酶添加量>5 000 U/g,自溶率呈现下降的趋势。当溶菌酶添加量为3 000 U/g时,乳酸菌自溶率达到77.17%,与溶菌酶添加量5 000 U/g差异不大,从产品成本方面考量,后续试验选择溶菌酶添加量为3 000 U/g。

图3 溶菌酶添加量对乳酸菌自溶的影响Fig.3 Effect of lysozyme addition on autolysis of lactic acid bacteria
2.1.4 蛋白酶添加量对乳酸菌自溶的影响
乳酸菌在285W超声和2%的NaCl处理后,添加3000 U/g溶菌酶,在37 ℃、pH7条件下自溶24 h,再分别加入5 000 U/g、7 000 U/g、9 000 U/g、11 000 U/g、13 000 U/g的酸性蛋白酶、中性蛋白酶和碱性蛋白酶,分别在最适酶活的条件下自溶24 h。酸性蛋白酶,碱性蛋白酶,中性蛋白酶添加量对乳酸菌自溶率的影响如表2所示。
由表2可知,中性蛋白酶促乳酸菌自溶效果优于酸性蛋白酶和碱性蛋白酶,中性蛋白酶添加量为5 000 U/g时,乳酸菌自溶率最高,可以达到81.77%。这可能是由于乳酸菌胞内pH环境接近中性,中性蛋白酶在此环境下酶解作用更加充分。乳酸菌的胞内蛋白可被胰蛋白酶水解成小分子肽及游离的氨基酸,其中包括多种呈味氨基酸。呈味肽是指从食物中提取或由氨基酸合成得到的对食品风味具有一定贡献的分子质量低于3 000 Da的寡肽类,包括特征滋味肽和风味前体肽。呈味肽能够赋予酶解物一定的风味。因此,为了增加乳酸菌抽提物的风味成分和提高乳酸菌自溶率,接下来进一步考察中性蛋白酶和胰蛋白酶等比例混合的复合蛋白酶对乳酸菌自溶的影响。
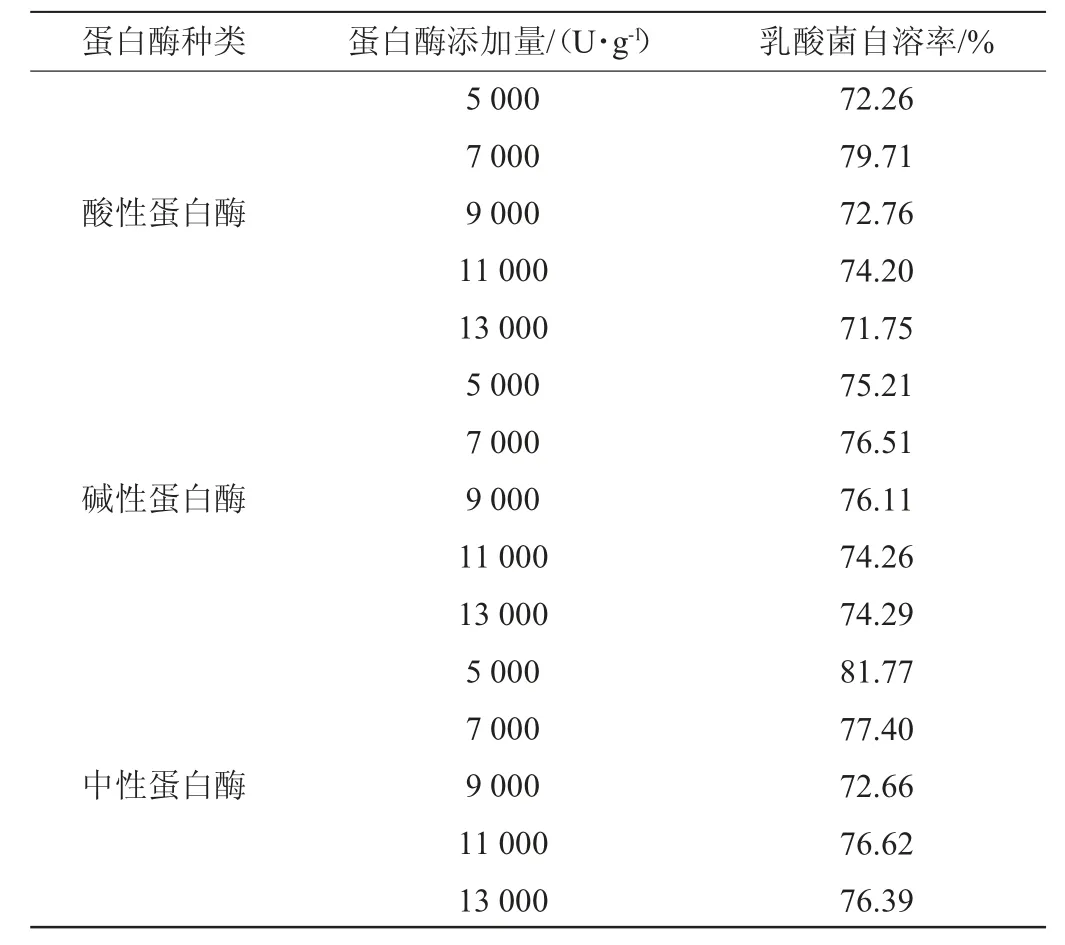
表2 蛋白酶添加量对乳酸菌自溶的影响Table 2 Effect of protease addition on autolysis of lactic acid bacteria
2.1.5 复合蛋白酶添加量对乳酸菌自溶的影响
乳酸菌在285W超声和2%的NaCl处理后,添加3000 U/g溶菌酶,在37 ℃、pH7条件下自溶24 h,再分别加入2 000 U/g(胰蛋白酶∶中性蛋白酶=1∶1)、6000U/g、10000U/g、14000U/g、18 000 U/g复合蛋白酶,45℃条件下自溶24 h,复合蛋白酶添加量对乳酸菌自溶率的影响如图4所示。由图4可知,复合蛋白酶添加量为6 000 U/g时,乳酸菌自溶效果最高,可达83.88%。复合蛋白酶添加量为2 000~18 000 U/g时,自溶率均能达到80%以上。复合蛋白酶最适添加量为6 000 U/g。
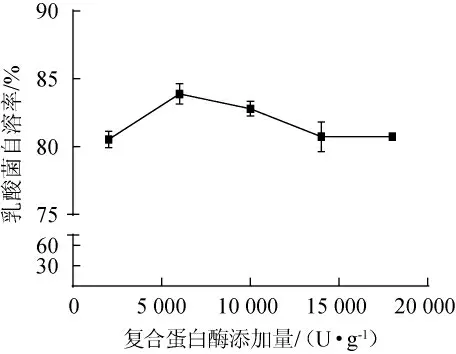
图4 复合蛋白酶添加量对乳酸菌自溶的影响Fig.4 Effect of compound protease addition on autolysis of lactic acid bacteria
2.2 乳酸菌抽提物制备工艺优化响应面试验结果
响应面试验设计与结果见表3,利用Design Expert软件对表3试验数据进行多项式拟合,以超声功率(X1)、溶菌酶添加量(X2)、复合蛋白酶添加量(X3)为自变量,以乳酸菌自溶率(Y)为因变量建立回归方程:Y=81.30+0.850 0X1+0.861 3X2-1.06X3-0.595 0X1X2+0.510 0X1X3+1.49X2X3+2.11X12+2.67X22+3.46X32。回归模型方差分析见表4。
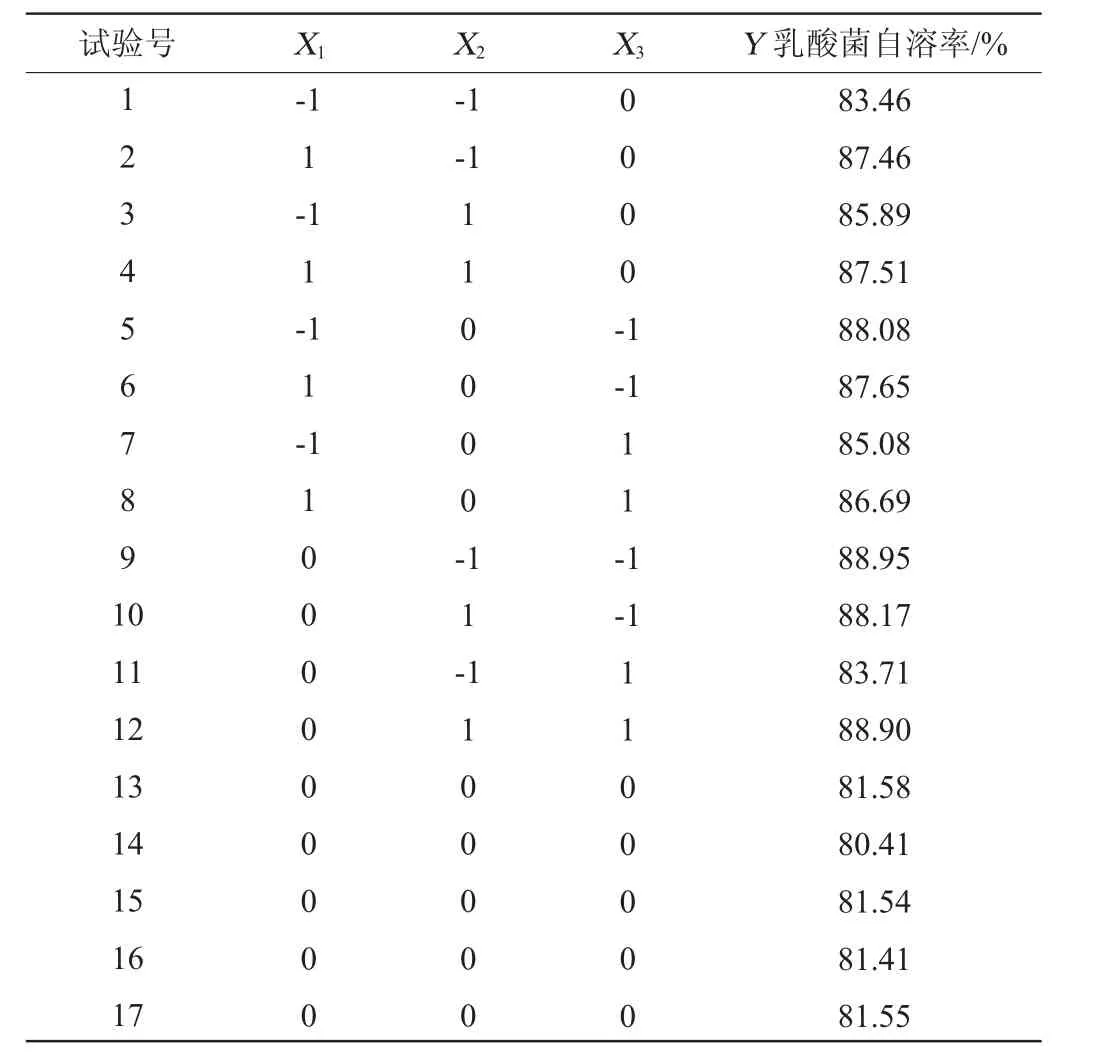
表3 乳酸菌抽提物制备工艺优化响应面试验设计与结果Table 3 Design and results of response surface tests for preparation process optimization of lactic acid bacteria extract
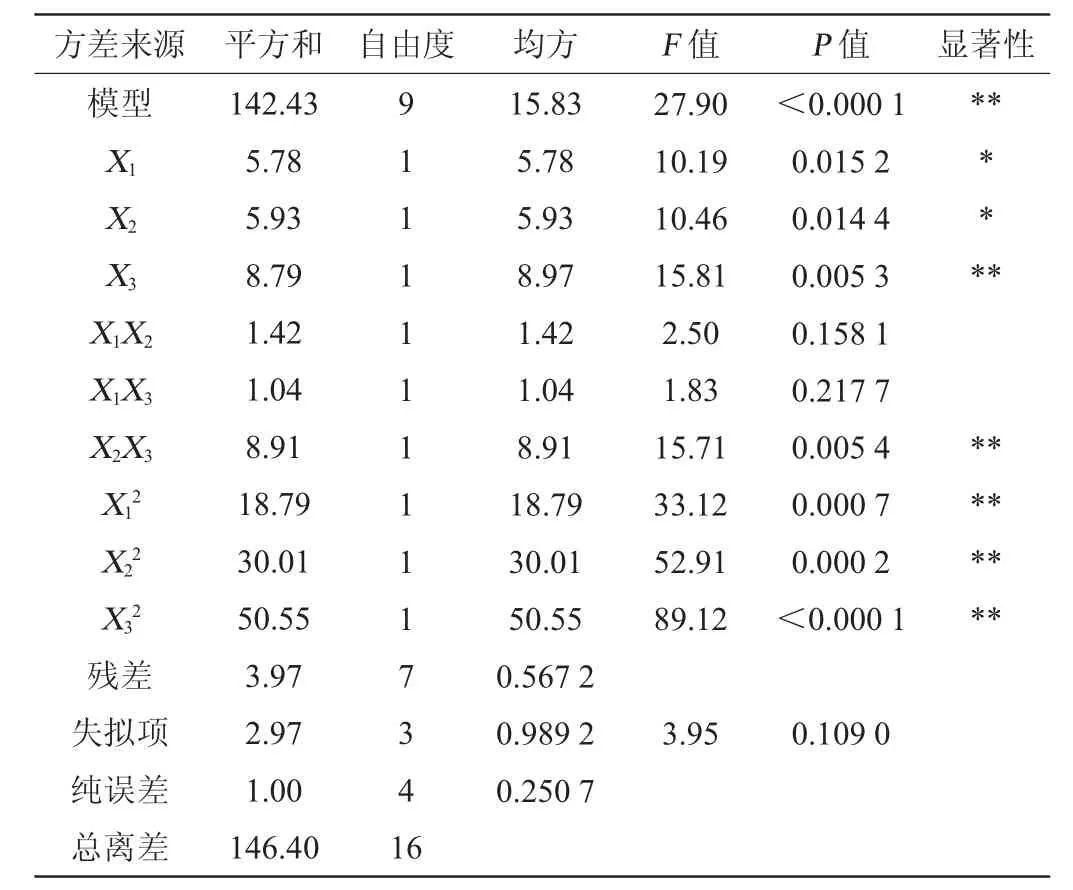
表4 回归模型方差分析Table 4 Variance analysis of regression model
从表3及图5可知,一次项X3,交互项X2X3,二次项X12、X22、X32对乳酸菌自溶率影响极显著(P<0.01);一次项X1、X2对乳酸菌自溶率影响显著(P<0.05)。其中,失拟项P=0.109>0.05,表明该方程可以预测最优的乳酸菌自溶率。
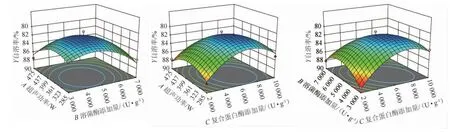
图5 各因素交互作用对乳酸菌自溶率影响的响应曲面及等高线Fig.5 Response surface plots and contour lines of interaction between each factor on autolysis of lactic acid bacteria
由响应面优化结果可知,乳酸菌自溶的最佳理想条件为超声功率474.997 W,溶菌酶添加量3 000.024 U/g,复合蛋白酶添加量2 000.036 U/g,在此条件下,乳酸菌自溶率的预测值为95.215%;根据实际操作的限制性,修正最佳工艺条件为超声功率475 W,溶菌酶添加量3 000 U/g,复合蛋白酶添加量2 000 U/g,在此条件下,得到乳酸菌自溶率为94.68%,略低于预测值(95.215%),说明试验模型合理,该结果也合理可靠。
2.3 乳酸菌抽提物主要成分分析
2.3.1 营养和功能指标分析
由表5可知,乳酸菌抽提物pH为6.57。乳酸菌抽提物具有多种营养物质,还原糖含量为55.16 mg/g,蛋白质含量为7 mg/g,氨基酸态氮含量达到3.85 mg/g,总酸含量为2 mg/g。乳酸菌抽提物还富含多种生物活性物质,其中总酚含量1.40 mg/g,总黄酮含量0.15 mg/g,对DPPH自由基清除能力达到46.16%。基于此,乳酸菌抽提物兼具潜在的营养性及功能性。

表5 乳酸菌抽提物营养和功能指标Table 5 Nutritional and functional indexes of lactic acid bacteria extract
2.3.2 挥发性成分分析
乳酸菌抽提物检测到24种挥发性风味物质(表6),主要包括醇类、醛类、酮类、酯类、烯烃类和芳香环类化合物。苯乙醇、反-2-壬烯-1-醇、α-松油醇、4-十二醇、苯乙醛、月桂酸、吲哚呈现不同种类的花香[14-16];叶醇呈现青香、绿叶香[17];苯乙醛、α-丙基苯乙醇、己酸己酯、γ-松油烯、香橙烯、肉桂酸甲酯、3-羟基己酸乙酯、壬酸具有水果甜香味[18-20];二甲基吡嗪、2,3-二甲基-5-乙基吡嗪等吡嗪类物质呈现烘烤香气,是一类对食品很重要的香气成分[21-24]。其中月桂酸(十二酸)、2,4-二甲基苯甲醛含量最高,对乳酸菌抽提物主体风味呈现起显著作用,赋予乳酸菌抽提物芳香风味。

表6 乳酸菌抽提物挥发性风味物质Table 6 Volatile flavor substances of lactic acid bacteria extract
续表
月桂酸和壬酸等中链脂肪酸具有抑菌和抗氧化等功能[25-27]。苍术酮具有抑菌、保护肝脏、降血糖等作用[28]。α-松油醇具有抑菌作用。由此可见,乳酸菌抽提物具有增香调味的作用,同时兼具有保健功能[29]。
3 结论
本研究在超声波、溶菌酶、蛋白酶单因素试验基础上,对乳酸菌抽提物制备工艺进行响应面优化试验,并采用多元线性回归分析。得到乳酸菌抽提物制备最佳工艺参数:超声功率475 W,NaCl添加量2%,溶菌酶添加量3 000 U/g,复合蛋白酶添加量2 000 U/g,在此条件下,乳酸菌的自溶率达到94.68%。乳酸菌抽提物具有多种营养物质,含有3.85 mg/g氨基酸态氮,7 mg/g蛋白质,55.16 mg/g还原糖。乳酸菌抽提物还具有生理活性物质,含有1.40 mg/g总酚,0.15mg/g总黄酮,对DPPH自由基清除能力可以达到46.16%。
乳酸菌抽提物挥发性风味成分富含多种营养和功能性物质,芳香性成分以月桂酸、2,4-二甲基苯甲醛含量最高,形成了复杂的香气。乳酸菌抽提物兼具有营养、保健功能、调香等潜在用途。
