微生物群体感应系统与食品防腐保鲜
2020-05-23阿热爱巴合提李平兰
周 幸,阿热爱·巴合提,李平兰
(1.中国农业大学 食品科学与营养工程学院,北京 100083;2.新疆维吾尔自治区产品质量监督检验研究院,新疆 乌鲁木齐 830013)
微生物利用食品中的营养物质促进自身生长繁殖,会引起食品腐败变质。世界粮农组织(FAO)在2019年估计,全球每年约有三分之一的食品损失,其中微生物引起的食品腐败是损失的主要原因[1]。
群体感应(QS)是一种微生物在菌体密度产生变化时,通过特定信号分子——自诱导剂(AI)的分泌与接收调控微生物群体的信息交流现象[2],它参与了微生物中许多重要的生物学过程,如孢子形成、毒性物质合成、生物被膜形成等[3]。QS系统有3种主要类型和1种特殊类型:第一类为以费氏弧菌(Vibriofischeri)发光现象为代表的革兰氏阴性菌为主的LuxI/LuxR型群体感应,通过自动诱导剂合酶LuxI与转录激活蛋白LuxR调控信号分子N-酰基高丝氨酸内酯(AHLs)(又称AI-1)的合成与作用[2,4](图1(a));第二类为革兰氏阳性菌为主的肽介导型群体感应,常利用修饰后的特异性寡肽(AIP)作为信号分子进行QS调控,其中AIP不具有直接跨膜的能力,需通过ABC转运系统(ATP-binding cassette)实现胞外转移并在环境中发挥作用(图1(b));第三类为革兰氏阴性菌和革兰氏阳性菌共有的种间LuxS/AI-2型群体感应,利用信号分子AI-2进行信息交流[5](图1(c));第四类是在黄色粘球菌(Myxococcusxanthus)中发现的一种特殊类型群体感应[6-7]。
当前,国内外大量研究发现能在变质食品中检测到QS信号分子,证实了QS系统通过调控微生物生理代谢与酶系活性参与了食品腐败过程[8-11]。因此,探究QS系统与食品腐败之间的关系并揭示其作用机制对开发食品防腐保鲜新方法具有重要意义。
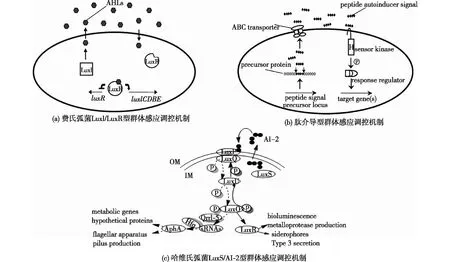
图1 3种主要QS系统类型调控机制[12-13]Fig.1 Control mechanisms of three miantypes of QS system[12-13]
1 食品腐败中的QS现象
微生物因素是导致食品腐败变质的重要因素。生鲜乳、肉、水产、果蔬等食品,因其营养丰富更易受微生物污染从而腐败变质。在食品腐败变质的过程中,少部分被称为特定腐败微生物(SSO)的群体暂时控制食品基质内的微生物演替[14]。多数引起食品腐败的微生物为革兰氏阴性菌,因此食品腐败变质中检测到的QS系统多为LuxI/LuxR型(表1)。
嗜冷菌是低温保藏条件下乳及乳制品中的SSO,它们可产生具有热稳定性的胞外蛋白酶、脂酶、糖苷酶,使乳制品经过工业处理后的保质期变短、品质下降[17-18]。Li等[19]的研究表明AHLs可在由嗜冷菌引起变质的食品中广泛检测到,且AHLs浓度随食品变质程度加深而增加。Yuan等[20]证明了外源添加AHLs会促进乳中生氮假单胞菌(P.azotoformans)和液化沙雷氏菌(S.liquefaciens)蛋白酶、脂肪氧化酶生产;研究显示,AHLs的添加上调了rpsR、rpsE、rplK、rplA等20个核糖体编码基因及调节蛋白EF-G、EF-Tu、EF-P编码基因,说明QS系统可能会通过信号分子调节细菌生长代谢和产物生成从而引起食品变质。

表1 受QS系统影响的食品腐败示例[15-16]Table 1 Examples of food spoilage affected by the QS system[15-16]
微生物在肉中生长繁殖,其代谢产物包括胺类化合物、硫化物,小分子醛、酮和有机酸等,微生物胞外蛋白酶是引起肉类食品腐败的重要成分,其分泌会受到QS系统的调控[21],例如肉制品中的肠杆菌(Enterobacteriaceae)受QS系统调控产生的AHLs会促进蛋白酶分泌,加速产品腐败变质[22]。Mellor等[23]发现鸡肉中的荧光假单胞菌(P.fluorescens)等可产生表面活性物质,帮助其分解肉中脂肪,且物质分泌与初始菌数相关,这一过程可能受到了QS系统的调节。
由于水产品水分含量高,优质蛋白与脂肪酸丰富,且通常运输距离远,腐败变质现象十分普遍,故QS相关研究较多。Li等[24]利用QS信号分子C6-HSL对分离自腐败大菱鲆的1株蜂房哈夫尼菌(Hafniaalvei)ATCC13337进行处理,发现该菌株鞭毛依赖性运动受到QS系统调节,信号分子增加能显著提高菌株运动性,增强其黏附性与定植性。Fu等[25]从大黄鱼中分离出希瓦氏菌025和003(Shewanella025 &003),研究发现希瓦氏菌内存在3个潜在受QS系统影响的基因torT、cysM和trxB,它们分别编码氧化三甲胺还原酶系统周质蛋白(TorT)、半胱氨酸合酶B和硫氧还蛋白还原酶,影响氧化三甲胺(TMAO)及其他呈味物质代谢加剧鱼肉腐败变质。Jie等[26]从变质的凡纳滨对虾中分离出野生型希瓦氏菌SAO3(ShewanellaSAO3)并构建ΔluxRSA03突变体,研究发现与野生型相比,突变型菌株丧失了对AHLs的敏感性,不再因AHLs浓度变化而产生种群数量变化,证明了希瓦氏菌在腐败变质产品中的群体密度受QS系统调控。
由于QS系统参与调控,微生物会产生大量果胶裂解酶、聚半乳糖醛酸酶、果胶甲基酯酶,导致果蔬腐败变质,常见的腐败菌有欧文氏菌属(Erwiniaspp)和假单胞菌属(Pseudomonasspp),其果胶酶的产生依赖于3-oxo-C6-HSL、C6-HSL两类AHL信号分子[27]。软腐的豆芽中可检测到AHLs,Rasch等[9]分离得到了AHLs的产生菌,并构建出AHLs生产缺陷的突变型菌株接种到豆芽上,结果显示实验豆芽在细菌总数与普通豆芽相似的情况下不产生软腐现象。Zhang等[28]发现白菜中分离的胡萝卜软腐欧文氏菌(E.carotovora)和生菜中分离的荧光假单胞菌(P.fluorescens)运动性、毒性及胞外聚合物(EPS)生成均受到QS系统调控。
2 QS系统调控生物被膜形成
在食品腐败变质中,QS系统不仅直接参与微生物生理活动代谢调节,还会在宏观角度促进生物被膜(bacterial biofilm)形成(图2)。生物被膜是由微生物及一种或多种细胞外基质组成,具有复杂生态系统的膜状物,是细菌自我保护的一种形式,通过微生物表面吸附、附着表面分解、细胞增殖、被膜形成与成熟、分离分散5个部分形成和传播(图3)[27,29]。生物被膜能附着在各种食品工业设备表面和包装材料上,如不锈钢、玻璃、聚乙烯、聚丙烯等[29]。通过这种方式,微生物可大幅度避免环境对生长繁殖造成的不利影响,比如食品工业中常见的干燥处理、高温处理和化学消毒剂处理等,故生物被膜是造成产品污染的重要因素之一[30]。
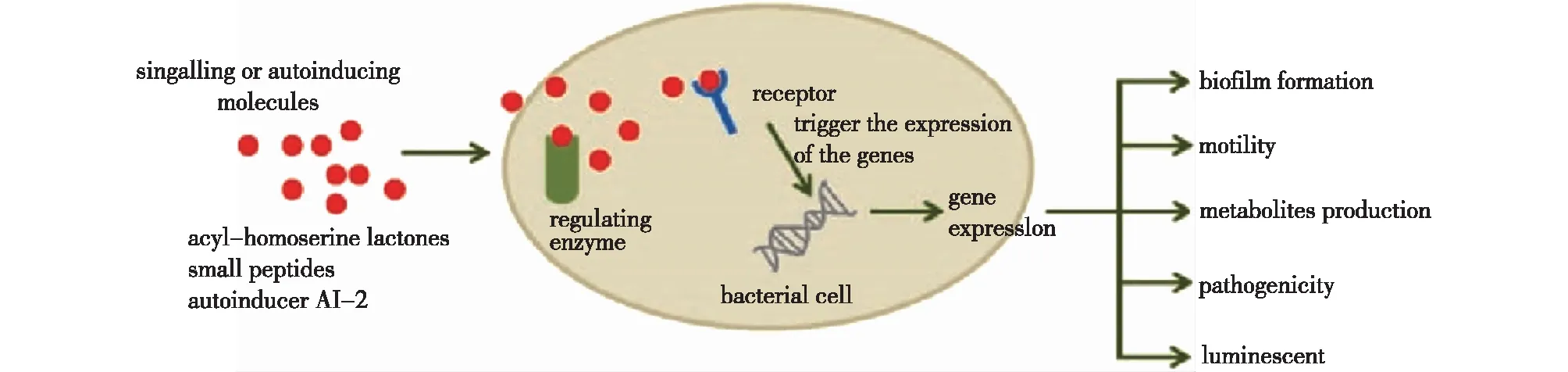
图2 QS系统调控生物被膜形成机制[27]Fig.2 QS system sensing mechanism of bacterial biofilm[27]

图3 生物被膜的形成过程[27]Fig.3 Development of bacterial biofilm[27]
2.1 食品中的生物被膜
Hou等[31]在腐败的海参中分离得到1株受AHLs调控的蜂房哈夫尼菌H4(HafniaalveiH4),研究显示信号分子3-oxo-C8-HSL和低浓度C4-HSL抑制菌株生物被膜形成,而低浓度信号分子C6-HSL促进其形成,这说明QS系统会根据环境情况促进或抑制生物被膜形成,帮助菌株定殖,使其更难从食品体系中去除。Vergara等[32]研究了22株分离自食品的耐甲氧西林金黄色葡萄球菌(MRSA),发现其中5株可在常见食品包装材料聚苯乙烯上成膜,1株可在不锈钢上成膜,它们大多携带Iva型葡萄球菌染色体mec基因盒(SCCmec),说明Iva型SCCmec可能与生物被膜形成相关。涂春田等[33]在270份冷藏鸡翅中分离出38株单增李斯特菌(L.monocytogenes),发现其中仅2株菌呈现弱生物被膜形成能力,生物被膜的形成会增强食源性病原菌及腐败菌的竞争力,因此其他腐败菌中很可能也广泛具备这项能力。
Gauvry等[34]提出,生物被膜中可共存的细胞类型主要有活的微生物细胞、基质产生细胞和微生物孢子三类,其中孢子具有黏附特性,可附着在食品工业管线上形成生物被膜。这些研究显示,多种微生物可通过生物被膜形成复杂的共生关系,QS系统作为微生物间信息交流的“桥梁”协调了各类菌株功能与密度的变化,提升了细胞本身抗性和适应性,此外,孢子的存在还增强了微生物的扩散性。对食品工业而言,清除生物被膜易存在死角,但QS系统的研究能为生物被膜的控制与清除提供新方向。
2.2 QS系统调控生物被膜生成
2.2.1 QS系统调节革兰氏阴性菌生物被膜形成
铜绿假单胞菌(P.aeruginosa)是一类在乳、肉等基质中常见的革兰氏阴性腐败菌,也是一类主要的生物被膜侵染菌。铜绿假单胞菌中包含las、rhl两类由AHLs调控的QS系统和一类不受AHLs调控的pqs系统:las系统中,调节蛋白LasI负责生产信号分子N-(3-氧十二烷酰基)-L-高丝氨酸内酯(3-oxo-C12-HSL),调节蛋白LasR负责接收并识别信号分子;在rhl系统中,调节蛋白RhlI负责生产信号分子N-丁酰基-L-高丝氨酸内酯(C4-HSL),调节蛋白RhlR负责接收并识别信号,rhl系统还会通过LuxR调节器QscR受到来自las系统的影响;pqs系统由pqsABCDE操纵子及pqsR、pqsH、pqsL3个转录单位组成,以2-烷基-4-喹诺酮类物质(AQ)为信号分子,与AHLs调控的QS系统类似,pqs系统也可通过转录调节因子PqsR进行自我调节[35-36]。
在铜绿假单胞菌中,3-oxo-C12-HSL可通过调控被膜分化调节其结构;此外,3-oxo-C12-HSL还与细胞运动性相关[37-38]。通过rhl系统调控合成的鼠李糖脂具有生物表面活性剂功能,在生物被膜结构形成过程中发挥了重要作用,同时它还具有毒性因子的作用[37,39]。pqs系统会参与调解细胞外DNA(eDNA)的成产,进而调节细胞外基质、生物被膜成熟过程及凝集素LecA和LecB的产生,影响被膜形成与定殖[40]。综上可知,QS系统在铜绿假单胞菌的被膜形成中起关键作用(图4)。
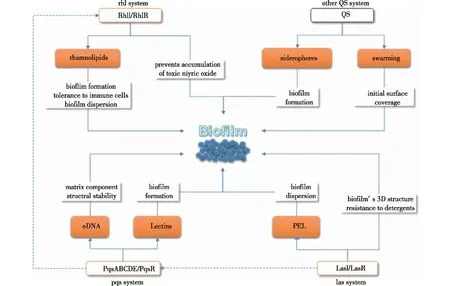
图4 QS系统调控铜绿假单胞菌生物被膜形成示意[47]Fig.4 Overview of biofilm QS regulation in Pseudomonas aeruginosa[47]
2.2.2 QS系统调节革兰氏阳性菌生物被膜形成
金黄色葡萄球菌(S.aureus)普遍存在于环境中,是一类重要的食源性致病菌,在速冻食品、鲜乳、肉、蛋中均可分离得到,其生物被膜形成受到由小分子肽AIP介导的Agr型QS调控:前体肽AgrD经调控蛋白AgrB和蛋白酶加工成为信号分子AIP后,与跨膜结合受体AgrC结合,使AgrC将磷酸基团转移至应答调节器AgrA上,磷酸化AgrA可激活agrP3启动子,从而驱动RNAIII的转录(图5)[41-42]。RNAIII是编码δ-毒素的mRNA,同时还参与调节毒素分泌与生物被膜分解过程。金黄色葡萄球菌中,AIP浓度与agr系统间有正反馈关系,即AIP浓度增加会进一步促进AIP生成,进而导致QS响应扩大[43]。这说明金黄色葡萄球菌中QS调控能促进生物被膜快速发展。
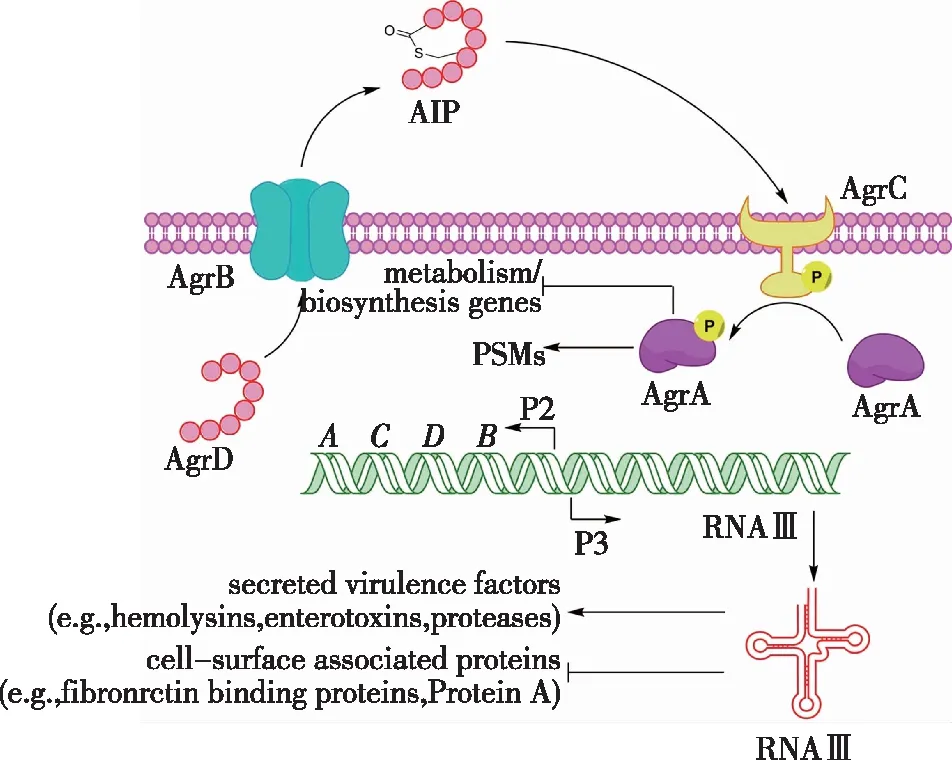
图5 金黄色葡萄球菌中的QS系统示意[44]Fig.5 QS system in Staphylococcus aureus[44]
3 QS与防腐保鲜
食品防腐保鲜中,微生物控制是一个关键问题。从杀灭腐败微生物的角度出发,添加食品防腐剂是当前应用最广泛的方式。常见的食品级微生物乳酸菌具有生产天然防腐剂细菌素的能力,且这一过程受QS系统调控[45]。因此QS系统的研究有利于增进乳酸菌细菌素生产。
从抑制微生物生长繁殖的角度出发,当前的研究集中在添加群体感应抑制剂(QSI)上。QSI能“混淆”微生物信息接收,使其通过自身调节达到停止生长或停止代谢的目的。
3.1 QS系统调控乳酸菌细菌素生成
乳酸菌细菌素是乳酸菌经核糖体机制产生的具有抗菌活性的多肽或蛋白质,根据其结构与理化性质特征分为四类:I类羊毛硫细菌素(lantibiotics)、II类非修饰多肽(unmodified peptides)和III类热敏感大分子蛋白、IV类大分子复合物[46-47],已商业应用于食品中的乳酸链球菌素Nisin属于I类细菌素、片球菌素PA-1属于II类细菌素,还有部分地区将II类细菌素肠球菌素AS-48用于果蔬汁的保鲜[48]。根据细菌素特点和当前应用情况,I类和II类细菌素是研究的主要方向。
Nisin是I类细菌素的代表,其合成受到QS系统调控(图6)。前体肽NisA在细胞内经修饰酶NisB和NisC加工后脱水环化,并通过跨膜转运蛋白NisT和NisC运输至细胞外,经切割前导肽蛋白酶NisP作用后形成Nisin。当其浓度达到阈值时,识别系统NisK结构域受到激活后使NisR磷酸化,从而回馈细菌素合成的基因表达,对细菌素合成进行调节[49]。基于QS系统对Nisin合成的调控,要促进细菌素不断产生,除了为其提供适宜的生产环境,还应使生产菌接收不到产物浓度增加的关键信息,因此NisK和NisR有潜力成为研究的关键靶点。
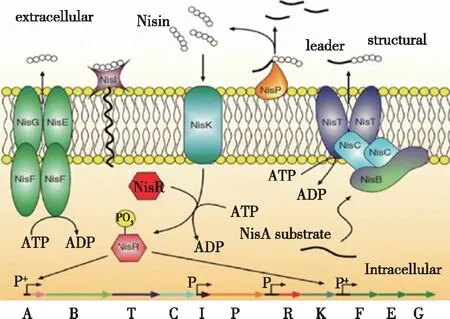
图6 Nisin的合成机制[50]Fig.6 Synthesis mechanism of Nisin[50]
多数植物乳杆菌素属于II类细菌素,其合成同样受QS系统调控(图7)。植物乳杆菌C11(L.plantarumC11)中,由操纵子plnABCD编码的植物乳杆菌素PlnA与组氨酸激酶PlnB相互作用,使调节蛋白PlnC、PlnD呈现磷酸化,磷酸化的PlnC能诱导特定基因表达,激活细菌素前体肽的转录,而当PlnD达到阈值浓度时,会对细菌素前体肽转录产生抑制作用[51]。植物乳杆菌素plnA不作为直接信号阻遏其产生,但其产量与专门的信号PlnD相关联,与Nisin相比机制更为复杂。在植物乳杆菌中,提高细菌素产量的关键是控制PlnD的胞内含量,因此可能需要采取定向进化或基因编辑降低PlnD的产生。

图7 植物乳杆菌素合成机制[51]Fig.7 synthesis mechanism of plnA[51]
3.2 QSI与食品防腐保鲜
理论上可以将QS系统作为靶点调控微生物生长繁殖与代谢,当前也已有大量研究验证了这一方法的可行性(表2)。干扰QS系统主要有以下3种方式:①抑制信号分子合成,使其数量减少,进而影响细胞正常生理代谢;②加速信号分子淬灭,同理可使其数量减少;③干扰信号分子与受体结合,使实际信息无法传递至细胞内部[52]。这3种方式在本质上都是切断微生物的信息传递与反馈,利用菌体本身的机制停止相应的生理活动,因此不存在抗性的产生。
作用于食品的QSI同理防腐剂,需要较高的安全性,因此当前着重在天然QSI的开发和研究上。

表2 部分天然来源QSI示例[15]Table 2 Parts of natural sources QSI[15]
当前的研究热点显示,植物提取物有巨大的QSI潜力,这可能是由于植物组织和组织液中数量庞大且结构复杂的天然化学产物本身就是长期进化而来直接或间接保护自身、对抗病害的成分。Husain等[53]研究表明,当前芒果叶中鉴别出的化合物已超过14种,并且其甲醇提取物显示出光谱抑制QS活性,这说明提取物可能针对多个靶点发挥作用。但在这类研究中,由于多数天然化学产物的稳定性不佳,且还存在大量类似物质,在分离提纯的过程中易发生变化,因此具体活性成分的确定与分析受到一定限制,还需要更精确的分析方法帮助研究。
食品工业研究者已开始尝试将天然植物精油作为防腐剂投入生产,并且天然植物精油能很好地抑制生物被膜形成[54]。如,柠檬草精油显著降低了食源性病原菌阪崎肠杆菌(C.sakazakii)的运动能力,限制了其生物被膜生成[55];Husain等[56]提取的薄荷油通过干扰AHLs作用限制了铜绿假单胞菌(P.aeruginosa)和嗜水气单胞菌(A.hydrophila)的被膜形成能力。但天然植物精油也存在成分复杂且不稳定的问题,食品基质本身的成分含有蛋白、碳水化合物、脂质,较易与精油中的活性成分发生反应,影响食品品质;此外,植物精油多有芳香气味,应用于食品中可能会给产品带来异味。因此,植物精油在食品中的应用可能需要包埋技术作为基础。
除了植物,微生物也可能是QSI的良好来源。微生物种类众多,且在一定环境下的微生物之间天然存在拮抗现象,同理细菌素的研究,微生物也有可能因种间或种内竞争产生具有QSI特性的产物。如枯草芽孢杆菌蛋白酶A,作为一种天然的蛋白酶,不仅可直接作用于生物被膜成分,还能影响信号分子AI-2的传递进而影响QS系统的正常功能[57]。当前,相关研究还较缺乏,但值得广泛探究。
4 展望
食物是人获取能量的唯一来源,食品腐败变质不仅仅会导致食物损失,更重要的是其可能会引发食源性疾病,甚至危及生命。QS是微生物生长繁殖过程中重要的生理现象,能帮助微生物更好地适应环境,但对于食品和食品工业而言,QS调控的生物被膜形成和各类产色素、产毒现象会导致巨大的经济损失。因此,了解微生物QS现象能更好地控制和利用它并应用于食品防腐保鲜领域。
综上,现有研究不断揭示腐败微生物和食源性病原菌QS原理,同时也在控制其发展上取得了一定成果,但在微生物QS机制研究中,由于系统本身错综复杂,不同QS之间的相互影响还需进一步明确;由于微生物种类丰富,不同微生物中的QS现象和机制也存在一定差异,因此还需要对更多微生物模型进行探究,寻找其中存在的规律。在细菌素与QSI的开发利用中,当前研究大多只针对某一个腐败微生物模型进行实验,且实验条件较为单一,不能模拟食品腐败或工业条件下的真实情况,因此还需要在多因素条件下做更深的探究;此外,细菌素与QSI毒理学研究也相对较少,需要加深对其安全性的探索,为其在食品及食品工业应用提供支持。
