环氧合酶-2在小鼠月经样模型中对子宫内膜崩解剥脱的作用研究
2020-05-22张博男陈西华梁敏刘婷婷南楠祝立权张欣汪坤刘书言贺斌徐祥波
张博男,陈西华,梁敏,刘婷婷,南楠,祝立权,张欣,汪坤,刘书言,贺斌,徐祥波*
(1.国家卫生健康委科学技术研究所,北京 100081;2.北京协和医学院研究生院,北京 100730;3.广西医科大学,南宁 450021)
月经是在子宫内分泌和旁分泌的影响下,子宫内膜为准备胚胎着床而经历一个增殖、分化,在胚胎未植入情况下崩解脱落的循环[1]。月经发生机制复杂,有关月经的生理现象还有许多问题有待探索。1957年,Pickles[2]从人体月经液中提取出来一种刺激平滑肌的物质,即前列腺素(Prostaglandin,PG)。环氧合酶(Cyclooxygenase,COX)是PGs的限速合成酶,可以催化花生四烯酸转化为PGs[3]。COX存在2种亚型,分别是环氧合酶-1(COX-1)和环氧合酶-2(COX-2)[4]。与COX-1在许多组织中广泛表达[5]不同的是,COX-2在如前列腺、输卵管、卵巢和子宫等少数生殖组织中呈现高度诱导性表达[6-7],且在生长因子或炎症因子的刺激下,细胞中的COX-2也会被迅速诱导表达参与炎症反应[8]。相关研究显示,通过抑制COX-2的表达可以降低小鼠胚胎的着床率和妊娠率[9],恒河猴和狒狒的COX-2在黄体期比在月经周期的增殖期表达更强烈[10-11]。此外,在人类中,COX-2在经前期子宫内膜中的表达强于排卵期[12]。这些研究提示,COX-2在月经发生过程中起到关键作用。
由于研究无法在人体内进行干预实验,而月经发生过程只在少数物种中存在,因此月经和子宫不规则出血等相关机制的研究受到伦理道德与实验物种的限制。小鼠月经样模型的建立在一定程度上打破了这一限制条件。本研究通过建立孕酮(Progesterone)生理性撤退小鼠月经样模型,使用COX-2特异性抑制剂Dup-697干预小鼠,探究COX-2蛋白在子宫内膜崩解时期的表达量变化以及COX-2在月经发生过程中的具体作用,为揭示月经发生机制提供线索,以及为临床治疗月经不规则出血提供理论依据。
材料与方法
一、研究对象
9~10周龄的SPFII级C57BL6雌性小鼠 40只,购自维通利华(实验动物许可证号:SCXK(京)2016-0006)。小鼠在可控的条件下给与充足的水和食物,光照时间8∶00~20∶00,温度为20℃±1℃。所有实验和外科手术都得到了国家卫生健康委科学技术研究所动物伦理委员会的批准。
二、研究方法
1.小鼠生理性月经样模型的建立:依据前期研究结果建立小鼠生理性孕酮撤退月经样模型[13-14](模型组,n=10):小鼠摘除卵巢休息一周后记为第1天,在第1~3天 9∶00皮下注射100 ng 雌二醇(E2),在第4~6天无处理,在第7天 9∶00 皮下注射5 ng E2和50 ng 孕酮,随后将含有孕酮的皮埋管植于小鼠背部皮下;在第8~9天 9∶00继续皮下注射5 ng E2。在第9天11∶30,向小鼠的双侧子宫角内注射15 μl无菌花生油以诱导子宫蜕膜化;在子宫蜕膜化49 h后去除孕酮皮埋管,记为取材0 h(图1)。小鼠分别在孕酮撤退后0 h、8 h、12 h、16 h以及24 h处死,将双侧子宫固定于4%多聚甲醛或用液氮冷冻并于-80℃保存备用。
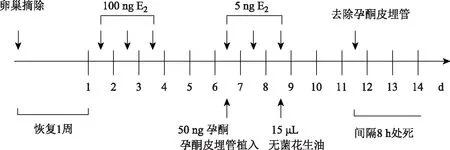
图1 小鼠月经样模型操作流程
2.COX-2蛋白的表达检测:利用western blot方法分别检测模型组小鼠子宫COX-2蛋白的表达量变化。首先,通过蛋白提取试剂盒(Invent Biotechnologies,美国)提取小鼠子宫组织蛋白并经BCA法(Thermo Scientific,美国)测定组织中的蛋白质浓度。蛋白总量50 μg上样到10% SDS-PAGE进行凝胶电泳,随后转移至PVDF膜(Millipore,美国),5%脱脂奶粉封闭后,分别与COX-2蛋白单抗(sc-19999,Santa Cruz,美国;1∶200稀释)以及β-ACTIN多抗(60008-1-Ig,Proteintech,美国;1∶10 000稀释)在4℃孵育过夜,与HRP标记的二抗(SA00001-1,Proteintech,美国;1∶5 000稀释)进行蛋白免疫印迹反应,使用Gel Documentation And Image Analysis System(北京赛智创业科技)检测蛋白条带和定量分析。
3.COX-2抑制试验及分组:根据是否进行COX-2特异性抑制剂Dup-697干预,将40只雌性小鼠分为2组:实验组(Dup-697干预组,n=20)和对照组(n=20)。实验组的干预方法根据前期研究[13],在孕酮撤退的-6 h、0 h、6 h、12 h和18 h分别向实验组小鼠腹腔注射剂量12.5 mg/kg的 COX-2特异性抑制剂Dup-697(Cayman,美国),对照组小鼠在相同时间点腹腔注射等体积生理盐水。小鼠分别在孕酮撤退后0 h、8 h、16 h以及24 h处死,将双侧子宫固定于4%多聚甲醛或用液氮冷冻并于-80℃保存备用。
4.石蜡组织切片HE染色:实验组和对照组的小鼠子宫组织固定48 h后,制备常规石蜡切片。首先,将切片梯度水化,用苏木素染液(珠海贝索生物)25℃染色2 min,使用1%盐酸乙醇溶液分化2 s后浸入1%氨水中反蓝40 s。随后,用1%伊红染液复染2 min(每次染色操作后用清水清洗3次)。梯度脱水后用中性树胶(中杉金桥)封片,光学显微镜下观察并拍照。
5.崩解面积计算:根据子宫内膜细胞的状态判定子宫内膜的崩解区域与蜕膜化区域:蜕膜化区域细胞呈现细胞体积增大,细胞核增大变圆的状态;崩解区域的细胞由于坏死而出现核固缩的现象。使用ImageJ软件统计崩解面积与蜕膜化面积,子宫的相对崩解面积=崩解面积/蜕膜化面积×100%。
三、统计学分析
结 果
一、COX-2蛋白在小鼠月经样模型子宫内膜崩解期的表达变化
Western blot结果显示,月经样小鼠孕酮撤退后,COX-2蛋白表达量在0 h表达量低,8 h开始升高,在12 h~24 h显著提高(P<0.05),并在24 h达到最高水平(P<0.05)(图2)。COX-2的表达趋势与子宫内膜破裂的进程一致,提示COX-2在小鼠子宫月经期可能具有重要调控作用。因此,针对COX-2进行了抑制干预实验。
二、COX-2抑制剂Dup-697对月经样模型小鼠子宫形态的影响
对照组小鼠子宫组织大体观察显示,孕酮撤退0 h、8 h、16 h、24 h子宫表面出血点逐渐增多,整体颜色逐渐加深,在24 h时呈现深红色;而干预组小鼠子宫相较于对照组在同一时间点的出血点较少,并且整体颜色呈粉红色,两组之间的颜色差异程度随着子宫崩解进程的加深而增大(图3)。
三、COX-2对月经样小鼠子宫内膜崩解面积的影响
小鼠子宫切片HE染色结果显示,干预组小鼠子宫在整个月经崩解期大部分的蜕膜区域保持完整,仅在子宫内膜的蜕膜化区域存在少量的崩解(图4)。统计结果显示,在孕酮撤退后8 h、16 h、24 h子宫相对崩解面积分别为4.56%、8.19%和11.09%,而对照组在相应时间点的子宫相对崩解面积分别为16.79%、39.84%和90.85%,与对照组相比,干预组小鼠的子宫相对崩解面积显著降低(P<0.01)。这些结果证明抑制COX-2在小鼠月经样模型子宫内膜崩解过程中的表达可以降低子宫出血程度以及减少子宫内膜崩解面积。
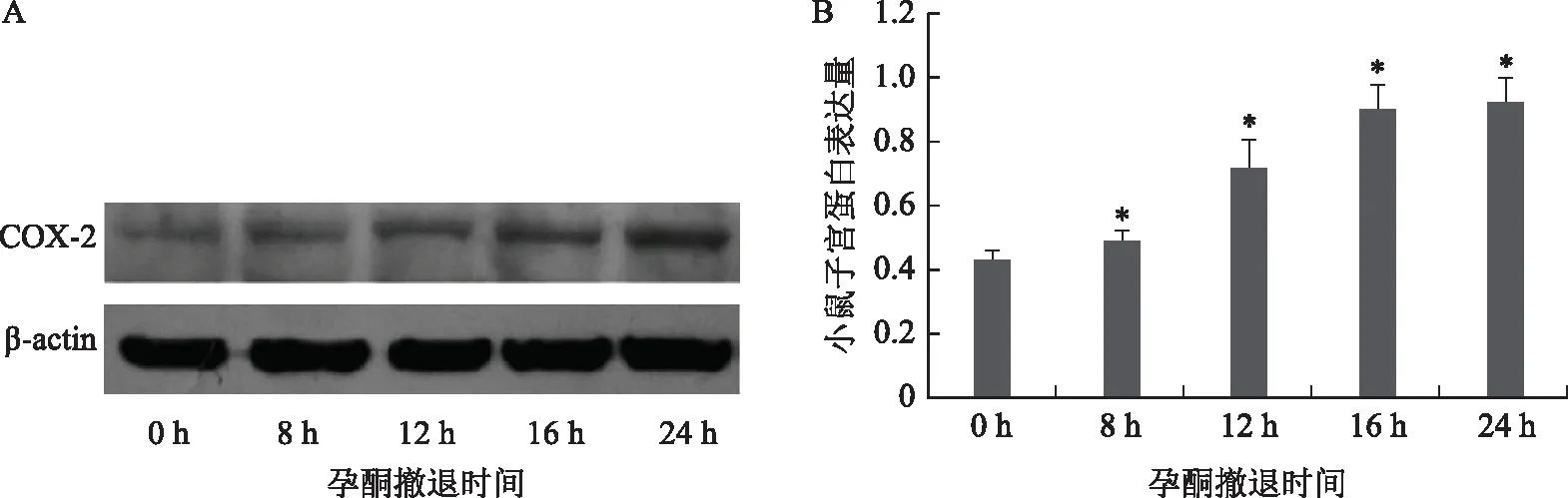
A:western blot 电泳条带;B:COX-2蛋白相对表达量;与0 h比较,*P<0.05图2 COX-2蛋白在小鼠子宫月经崩解期的表达
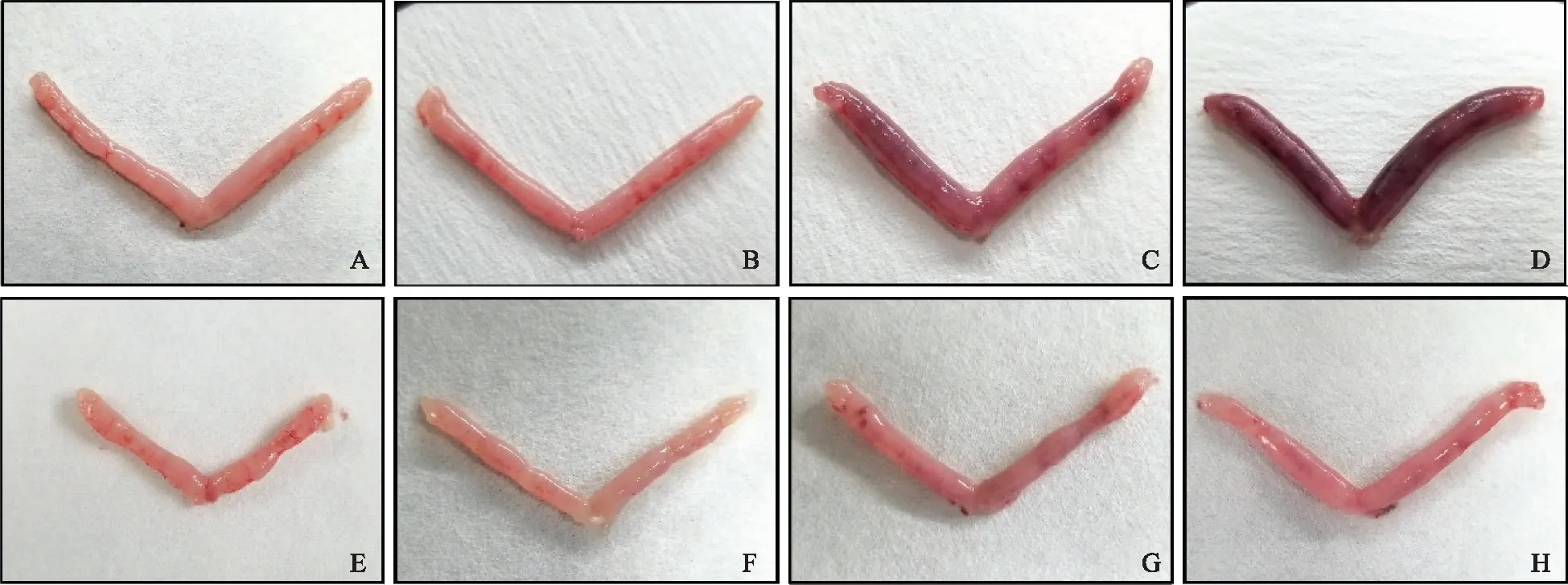
A~D:对照组小鼠子宫0 h~24 h大体形态;E~H:干预组小鼠子宫0 h~24 h大体形态图3 孕酮撤退后各个时间点实验组和对照组小鼠子宫大体形态结果

A~D:对照组小鼠子宫0 h~24 h石蜡切片HE染色结果;E~H:干预组小鼠子宫0 h~24 h石蜡 切片HE染色结果。黄色虚线内代表子宫内膜崩解面积,红色方框代表高倍图像放大区域。 低倍图像(×40)比例尺为200 μm,高倍图像(×200)比例尺为50 μm图4 孕酮撤退后各个时间点对照组和干预组小鼠HE染色结果
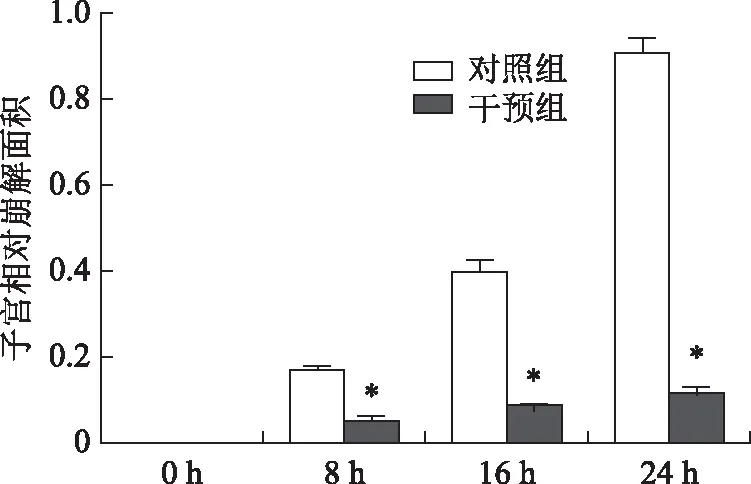
注:与对照组比较,*P<0.01图5 孕酮撤退后对照组和干预组小鼠子宫 不同时间点的相对崩解面积
讨 论
女性月经周期包含了子宫内膜的增殖、分化以及在未受孕的状态下出现的崩解与出血等现象[1]。在临床上,痛经、闭经、子宫异常出血等疾病的发生与月经过程联系紧密。由于月经的发生机制复杂,因此探究和了解月经的发生机制对于治疗子宫内膜相关疾病具有十分重要的意义。
本研究首先建立了月经样模型小鼠。根据模型小鼠的western blot结果选取了在月经周期中表达量出现显著差异的COX-2进行抑制干预试验。Western blot结果显示,COX-2蛋白表达量在孕酮撤退后8 h开始显著上升,在24 h时达到最高水平,COX-2蛋白表达量在12 h~24 h显著提高(P<0.01)。COX-2的表达趋势与子宫内膜破裂的进程一致。另外已有研究表明,COX-2蛋白定位于子宫内膜崩解区域[15],同样提示COX-2在小鼠子宫月经崩解期中促进子宫内膜崩解剥脱。
COX-2在炎症因子或生长因子刺激的细胞中可快速表达,参与细胞炎症反应以及细胞生长、增殖等过程。COX-2具有抑制细胞凋亡、促进细胞增殖,促进多种血管生成因子表达[16-17]的作用。在月经发生过程中,通过抑制COX-2在子宫内膜中的表达,可以干扰小鼠胚胎着床以及降低小鼠妊娠率[9];近期研究表明[18],COX-2的表达有利于胎盘的形成。同时COX-2在经前期子宫内膜中的表达强于排卵期[12]。这些研究结果提示COX-2在子宫月经期可能具有重要调控作用。
由于COX-2基因敲除小鼠在雌性生殖系统中存在许多缺陷,因此在小鼠月经样模型中采用药物干预的方法代替基因敲除技术抑制COX-2。Dup-697是一种COX-2特异性抑制剂,其对COX-2的抑制作用是COX-1作用的50余倍[19]。Dup-697能够特异性结合COX-2第523位点的缬氨酸,阻断COX-2与其疏水侧袋的连接,从而抑制COX-2的活性[20]。因此使用Dup-697抑制COX-2的表达成为研究COX-2在子宫组织崩解以及其他女性生殖过程中作用的重要方法。
根据western blot所提示的结果,通过使用COX-2抑制剂Dup-697来研究COX-2在小鼠月经崩解期的作用。我们首先通过小鼠子宫大体形态评估小鼠子宫出血程度,判断COX-2在小鼠子宫月经崩解期的作用。子宫组织取材结果表明,Dup-697干预组小鼠子宫组织颜色相较于对照组浅,且两组之间的差异随着子宫内膜崩解进程的推进而逐渐增大,这表明COX-2在小鼠月经崩解期可以有效调控子宫出血。
进一步分析COX-2抑制对子宫组织崩解的影响,我们通过HE染色对子宫组织形态学分析。结果显示,在给予COX-2抑制剂(Dup-697)后,小鼠子宫内膜相对崩解面积显著降低(P<0.01),且干预组与对照组之间的差异可能随着崩解进程的推进而增大。结果说明,COX-2在小鼠月经样模型中参与子宫的内膜崩解剥脱。
月经是孕酮撤退诱导的生理性事件[1]。COX-2在人类[12]中以及本研究使用的小鼠月经样模型中,均在月经早期被诱导激活。本研究中观察到的COX-2在子宫内膜崩解过程中的诱导表达,提示了COX-2在子宫内膜崩解过程中起促进作用。但是,COX-2的抑制并不能完全抑制子宫内膜的崩解,其原因可能为其他信号通路共同参与调控了月经这一过程,需要进一步研究。
本实验以小鼠月经样模型为基础,探究了COX-2在月经期子宫内膜崩解过程中起到的关键作用。这有助于我们更好的理解月经发生的复杂分子机制,选择性COX-2抑制剂已用于治疗临床上的不规则子宫出血[21-24],我们的研究将为子宫内膜异常出血的治疗提供新的策略。
