米非司酮致胚胎着床障碍动物模型的再评价
2020-05-22林益李咏倩齐聪张勤华
林益,李咏倩,齐聪,张勤华
(1.上海中医药大学,上海 201203;2.上海中医药大学附属曙光医院,上海 201203;上海市第一妇婴保健院,上海 200120)
辅助生殖技术(ART)发展至今已成为解决不孕不育的重要手段。尽管技术的不断革新带来前所未有的突破性进展,但ART总体妊娠率却仍在30%~50%范围内徘徊不前[1-2]。ART能否成功妊娠主要取决于两个因素,一是胚胎质量,二是子宫内膜对胚胎的容受性。目前由于移植前基因筛查/诊断技术、冻融胚胎技术的改进使胚胎优选成为可能。而子宫内膜容受性却成为了影响ART结局的瓶颈。母体子宫内膜组织病变、微血栓形成、母胎界面免疫细胞功能异常均可导致周期取消率、着床失败率,甚至反复移植失败的发生几率明显升高[3]。
啮齿类动物胚胎植入过程与人类胚胎植入过程具有一定相似度。研究发现,在着床窗口期啮齿类动物(大鼠、小鼠)胚胎同样可发生“定位-粘附-植入”的一系列动作,使胚胎突破内膜上皮层进入内膜基质层[4-5]。随后,它们同样可以在孕激素诱导下出现子宫内膜蜕膜化并进一步形成胎盘。因此啮齿类动物可作为研究人类胚胎着床机制的候选动物模型。
米非司酮是一种经典的抗妊娠药物,能够竞争性结合孕激素受体(PR),从而抑制孕酮对靶细胞如子宫内膜上皮细胞、基质细胞的增殖分化作用,使子宫螺旋动脉崩坏破裂,造成胚胎植入障碍。自1997年开始国内外学者相继报道了米非司酮造成胚胎着床障碍的动物模型[6-7]。但在米非司酮溶剂配置、用药剂量、给药方式及平均胚胎着床数等方面的综合性研究报道甚为少见[8-9],本实验将针对以上问题探索更为稳定有效的动物造模方式,为研究胚胎粘附、胚胎植入及子宫内膜基质细胞蜕膜化等提供参考依据。
材料与方法
一、实验动物及分组
清洁级性成熟未孕、未产雌性SD大鼠,体重200~220 g、清洁级性成熟未交配雄性SD大鼠,体重300~330 g,由上海中医药大学动物实验中心提供并饲养,许可证:SCXK(京)2016-0011。实验开始前雄鼠及雌鼠分笼进行适应性喂养。一周后每日8∶00am对雌性大鼠阴道涂片进行观察,动情期大鼠于当日6∶00pm与雄鼠进行合笼,合笼比例1∶1,次日8∶00am再次观察阴道涂片,若涂片中见精子,记为妊娠第1天(PD1)。PD1大鼠随机分为4组(A组、B组、C组、D组),每组10只。
二、米非司酮溶液配制
米非司酮片(25 mg,C019141008 上海新华联制药)。分析纯丙二醇(500 ml,20171212上海沪试化工),生理盐水(100 ml,S1808115,上海百特医疗用品),灭菌注射用水(500 ml,M18062306-2,四川科伦药业),药用级橄榄油(500 ml,M33718073,上海麦克林),食用麻油(220 ml,5070045,上海金龙鱼)。将米非司酮片剂研磨后加入5种溶液中,分别配成0.5 mg/ml、0.75 mg/ml、1 mg/ml三种不同浓度的米非司酮溶液,将配置的米非司酮溶液静置于室温下1 h后进行观察。
三、造模及取材
于妊娠第3日(PD3)9:00am进行造模。根据米非司酮在不同溶剂中的溶解度,A组予米非司酮+丙二醇(0.5 mg/ml)颈部皮下注射造模,注射剂量为2 mg/kg;B组予米非司酮+丙二醇(0.5 mg/ml)颈部皮下注射造模,注射剂量为4 mg/kg;C组予米非司酮+生理盐水(1 mg/ml)灌胃,灌胃剂量4 mg/kg;D组予米非司酮+生理盐水(1 mg/ml)灌胃,灌胃剂量8 mg/kg。于PD8 9:00am麻醉后处死动物。剖腹后计数双侧子宫胚胎着床数,将子宫剪切成0.5 cm×0.5 cm×0.5 cm大小的组织段,分别保存于4%多聚甲醛溶液(拟行HE染色及免疫组化)。部分避光保存于2.5%戊二醛中(拟行扫描电镜观察)。
四、HE染色及光镜下观察
取出存放在多聚甲醛溶液(10010018,上海国药集团)中的大鼠子宫组织进行石蜡包埋并切片(厚度3~5 μm),石蜡切片经过脱蜡、水化后置于苏木素(20180335,江苏凯基生物科技)中染色5 min,细流水充分水洗10 min。伊红(20180325,江苏凯基生物科技)染色1~2 min,然后乙醇(10092680,上海国药集团)脱水。二甲苯(10023418,上海国药集团)透明,中性树胶(G8590,北京索莱宝)封片。光学显微镜下(ECLIPSE Ci,日本尼康公司)观察大鼠子宫内膜组织形态学改变。
五、石蜡切片免疫组化
将大鼠子宫内膜石蜡切片脱蜡、水化后进行高温抗原修复,将玻片置于3%H2O2中,湿盒孵育10 min,以消除内源性过氧化物酶的活性。PBS冲洗3 min×3次,采用超敏二步免疫组织化学方法检测大鼠子宫内膜孕激素受体的分布及表达。孕酮受体一抗(ab16661,Abcam,美国)按照1∶50 的比例稀释。同时,设置阴性对照组并在其中只加入广谱二抗(D-3004,上海长岛生物技术)和 DAB(FL-6001,上海长岛生物技术)显色。苏木素复染3 min,1%盐酸酒精分化,显微镜下观察,控制染色程度。自来水冲洗10 min,放入65℃烘箱中烘干水分。将玻片置于二甲苯中透明3 min×2次,中性树胶封片,放入65℃烘箱中15 min。光学显微镜下观察并拍照,计算阳性面积。
免疫组织化学结果判断与分析方法:定义细胞质内的棕黄色颗粒为PR的阳性产物。每例标本选取一张切片先于低倍镜下选择棕黄色颗粒表达密集的区域,后置入高倍镜下进行观察,每张切片随机选择3个视野,用Image-Pro 6.0分析阳性表达面积。取3次测量的平均值进行统计分析。
六、扫描电镜下观察胞饮突
将样本从戊二醛溶液中取出,注意不要损伤内膜面,用pH 7.4磷酸缓冲液洗3次,每次30 min左右。1%锇酸固定1.5 h。再次用磷酸缓冲液洗2次,每次5~10 min左右,再经梯度酒精脱水、真空干燥、喷金后在扫描电子显微镜(Philips XL-30,荷兰)下观察胞饮突形态。
七、数据统计
数据经SPSS 22.0统计软件进行统计学处理。计量资料符合正态分布用均数±标准差表示,多组之间比较用One-way ANOVA 方差分析,两两比较采用LSD 法,P<0.05 为差异有显著性。不符合正态分布用中位数(最大值,最小值)[M(min,max)]表示,组间比较采用KrusKal-Wallis H检验,多重比较采用Bonferroni法矫正α,P<0.05为差异有显著性。计数资料频数(构成比/率)表示,组间比较采用卡方检验及分割卡方检验多重比较,多重比较采用Bonferroni法矫正α,P<0.05为差异有显著性。
结 果
一、米非司酮溶剂的选择
将米非司酮片剂研磨成细颗粒后投入丙二醇,生理盐水、灭菌注射用水、橄榄油、食用麻油5种不同溶剂进行溶解,结果显示丙二醇、橄榄油、食用麻油溶剂中米非司酮溶解度较生理盐水及灭菌注射用水中高,且温度升高至40℃后5种溶液中米非司酮溶解度无改变。5种溶剂中溶质均未完全溶解,溶解度丙二醇>橄榄油>食用麻油>生理盐水>灭菌注射用水。其中仅有0.5 mg/ml的米非司酮+丙二醇溶液可见米非司酮片剂大部分溶解,液体透明,仅有少许颗粒状悬浮物,室温静置1 h后可见溶液底部析出少量颗粒状溶质。其余各组溶剂中均为混悬液,室温下静置1 h后可见大部分溶质沉淀在烧杯底部。根据以上结果本实验采用0.5 mg/ml米非司酮+丙二醇溶液皮下注射及1 mg/ml米非司酮+生理盐水混悬液灌胃方式进行造模,以探索大鼠胚胎着床障碍模型的最佳剂量及给药方式。
二、着床后大鼠子宫形态学观察
于PD8麻醉后处死大鼠,剖取双侧子宫观察。A组中10只大鼠均妊娠,子宫增大,子宫血管网增粗、血流丰富,胚胎着床点分布紧凑,胚胎着床位点处无明显出血;B组中10只大鼠妊娠1例,余9例均未妊娠,双侧子宫外观形态无异常,颜色略苍白,弹性较差;C组中8只大鼠妊娠,妊娠大鼠两侧子宫胚胎着床位点分布不规则,胚胎着床处无积血。D组中7只大鼠妊娠,妊娠大鼠双侧子宫见少量着床位点,胚胎体积较A组、C组偏小,多数胚胎粘附处可观察到明显出血点。妊娠大鼠未着床处子宫较细,未妊娠大鼠双侧子宫形态规则,颜色苍白,血供欠佳(图1)。
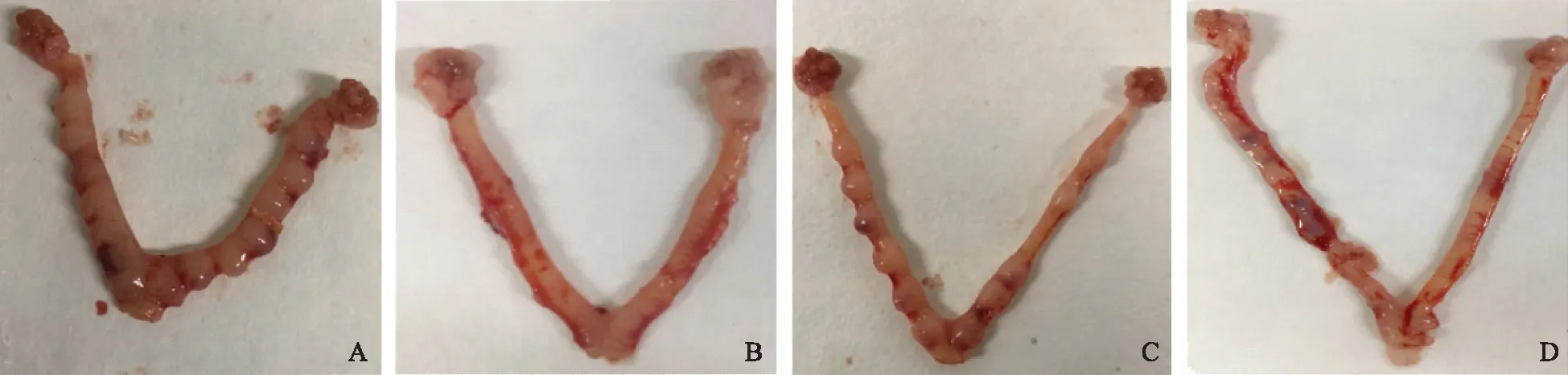
A:A组(2 mg/kg皮下),B:B组(4 mg/kg皮下),C:C组(4 mg/kg灌胃),D:D组(8 mg/kg灌胃)图1 各组大鼠PD8子宫大体形态观察
三、造模后各组妊娠率及着床位点比较
PD8各组大鼠妊娠率不同,差异有统计学意义(P<0.001),其中B组妊娠率显著低于A、C、D三组(P<0.01),A、C、D组妊娠率组间比较差异无统计学意义(P>0.05)。PD8各组大鼠平均着床位点组间比较差异有统计学意义(P<0.001),其中,B、D组着床位点数显著少于A组,B组着床位点数显著少于C组(P<0.05),其余各组间比较差异均无统计学意义(P>0.05)(表1)。
四、大鼠子宫内膜组织学结构观察
所有大鼠子宫组织均进行石蜡切片及HE染色后观察子宫内膜组织形态学改变。A组大鼠子宫内膜腔上皮细胞呈柱状排列,表面有纤毛覆盖,间质层见广泛蜕膜化反应,基质细胞胞浆中脂滴、糖原增多,胞核增大,间质疏松、水肿,腺体数量多,腺腔面积大,小血管增生,无明显充血。B组大鼠子宫内膜腔上皮细胞排列紊乱,子宫内膜基质细胞呈梭状,局部血管有充血表现。C组大鼠子宫内膜间质层广泛蜕膜化反应,腺体数量多,分泌旺盛。D组大鼠腔上皮有绒毛覆盖,内膜间质区蜕膜化面积少,腺体数量少,小血管内出现充血表现(图2)。
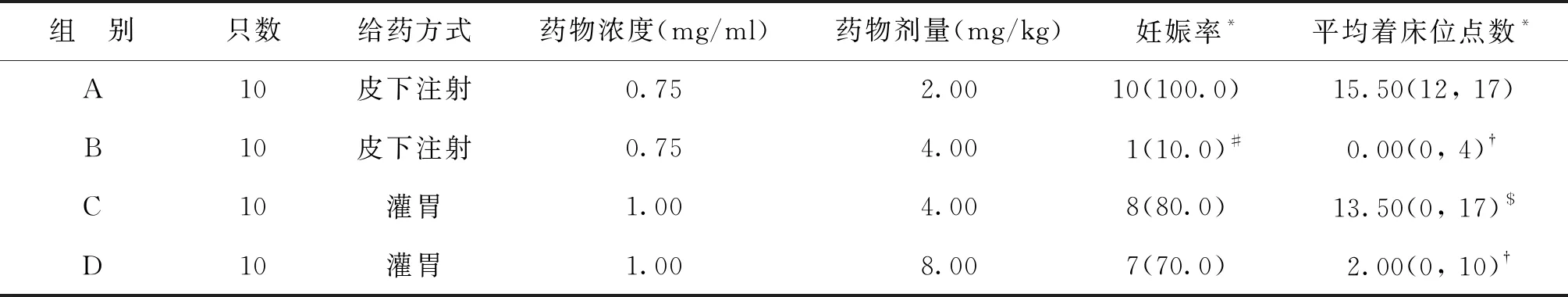
表1 各组大鼠妊娠率及着床位点数比较[n(%),M(min,max)]
注:各组间比较,*P<0.001;与其他各组比较,#P<0.01;与A组比较,†P<0.05;与B组比较,$P<0.05

A:A组(2 mg/kg皮下),B:B组(4 mg/kg皮下),C:C组(4 mg/kg灌胃),D:D组(8 mg/kg灌胃) :子宫内膜小血管;:腺体;:腺腔;★:小血管充血;bar=50 μm图2 各组大鼠造模后子宫内膜组织形态学观察(HE染色 ×200)
低倍镜下IMS图象分析系统测量各组大鼠造模后子宫内膜腔上皮厚度、腺体面积、腺腔面积。造模后B组腔上皮厚度、腺体面积、腺腔面积均显著低于A组、C组(P<0.05),D组腔上皮厚度、腺腔面积均显著低于A组、C组(P<0.05);A组与C组间比较腔上皮厚度、腺体面积、腺腔面积差异均无统计学意义(P>0.05),B组与D组间比较腔上皮厚度、腺体面积、腺腔面积差异均无统计学意义(P>0.05)(表2)。
五、大鼠子宫内膜组织内孕激素受体(PR)表达量比较
PR在大鼠子宫内膜功能层上皮及间质细胞中均有表达,其中,A组、D组中上皮层PR表达完整,形态规则;B组、C组中上皮层部分PR表达缺失(图3)。
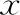
表2 各组大鼠子宫内膜组织形态学指标[(-±s),M(min,max)]
注:与A组比较,*P<0.05;与B组比较,#P<0.05;与C组比较,△P<0.05
A:A组(2 mg/kg皮下),B:B组(4 mg/kg皮下),C:C组(4 mg/kg灌胃),D:D组(8 mg/kg灌胃);bar=25 μm图3 各组大鼠造模后PD8子宫内膜组织中PR阳性表达情况(免疫组化 ×100)
通过显微镜拍照,采集分析样本相关部位,计算PR阳性面积。B组、D组大鼠造模后内膜组织中PR表达量显著低于A组、C组(P<0.05)。其余各组间比较差异均无统计学意义(P>0.05)(表3)。
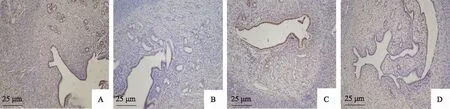
六、大鼠子宫内膜表面胞饮突形态的比较
扫描电子显微镜(SEM)下观察大鼠子宫内膜胞饮突形态。A组中见明显发育成熟的胞饮突,表面光滑,覆盖微绒毛;B组中内膜表面基本未见明显胞饮突;C组中胞饮突正在发育阶段,未完全成熟,表面粗糙;D组中胞饮突高度低于绒毛,发育程度差(图4)。
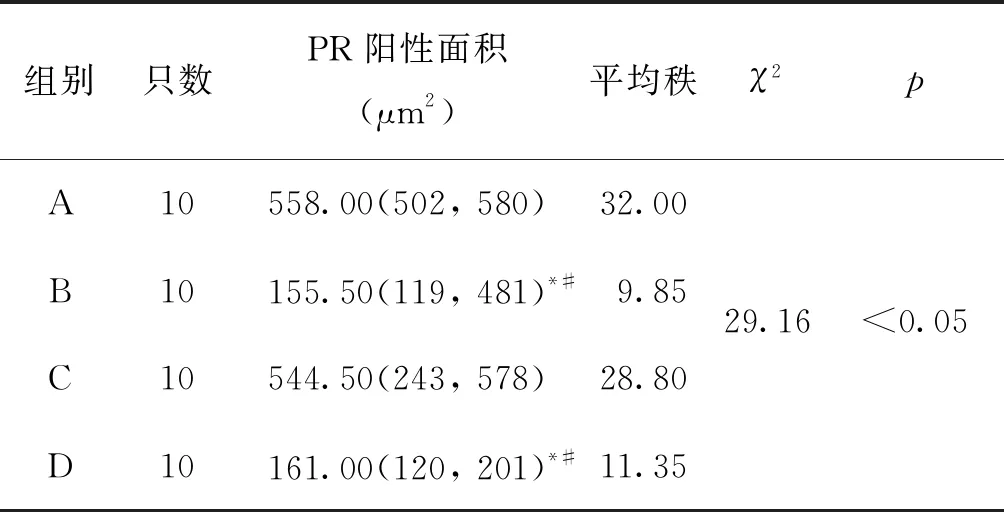
表3 大鼠子宫内膜PR阳性面积[M(min,max)]
注:与A组比较,*P<0.05;与C组比较,#P<0.05

A:A组(2 mg/kg皮下),B:B组(4 mg/kg皮下),C:C组(4 mg/kg灌胃),D:D组(8 mg/kg灌胃)图4 各组大鼠造模后子宫内膜胞饮突形态(SEM ×3 000)
讨 论
哺乳动物的胚胎着床是建立妊娠的关键步骤。在此过程中优质的胚胎、具有容受性的子宫内膜和它们之间精密复杂的对话三者缺一不可[10]。子宫内膜容受性是指子宫内膜在“种植窗”时期接受胚胎着床的能力。在着床开始前,卵巢中的黄体已经形成并开始分泌孕酮,孕酮通过与其特异性受体结合后促进下游靶基因转录,不仅帮助胚胎粘附于子宫内膜上皮层,还可以诱导子宫内膜基质细胞蜕膜化、内膜腺体发育、腺腔面积增大、螺旋动脉重塑管,为胚胎发育及胎盘形成提供营养物质及免疫豁免[11]。胞饮突是子宫内膜“种植窗”开放的重要标志物,分泌期胞饮突可出现在子宫内膜微绒毛细胞顶部,成熟的胞饮突呈蘑菇状凸起,表面光滑。其出现受到孕酮的调节作用,孕酮刺激其发育及成熟,成熟的胞饮突可增加胚胎与内膜的接触面积,促进其粘附及着床[12-13]。
米非司酮是炔诺酮的衍生物,可与孕酮竞争性结合孕酮受体,且其亲和力远高于孕酮,故常作为药物流产的经典用药。米非司酮可溶于有机溶剂酸水(pH<1.5),不溶于水,因此临床上普遍采用口服给药方式。其药代动力学显示米非司酮血药浓度与给药剂量呈正相关,经胃肠道吸收后于1~2 h血药浓度出现峰值,并在其后的24~48 h内有维持作用[14-15]。
SD大鼠胚胎着床过程与人类相似,在雌鼠与雄鼠合笼后的第1~2天为受精和胚胎发育的过程,第3~4天发育正常的胚泡已经移行到子宫腔,第5~8天为胚胎种植阶段[16]。早在20世纪90年代就有研究人员尝试应用米非司酮油溶液进行动物胚胎着床障碍的模型建立,但其溶解度较差,采用皮下注射造模后总体妊娠率偏低,平均着床数波动较大,模型不稳定。故本研究以不同浓度及不同给药方式对SD大鼠造模后的妊娠率、着床数、子宫内膜组织结构及PR表达量进行比较,以期获得更为稳定可复制的动物模型。
结果显示,米非司酮皮下注射组(A组与B组)见妊娠率及胚胎着床数相差明显,A组中10例大鼠均妊娠,B组中仅1例妊娠,镜下观察见A组子宫内膜腔上皮厚度、腺体面积、腺腔面积、PR阳性面积均明显高于B组。提示妊娠第3天大鼠皮下注射4 mg/kg米非司酮溶液造模后可能因为“种植窗”的完全关闭而导致胚胎无法正常植入。米非司酮灌胃组(C组与D组)妊娠率无明显差异,但在胚胎着床数、子宫内膜腔上皮厚度、腺腔面积、PR阳性面积方面D组均明显低于C组,且与B组无明显差异,提示妊娠第3天予米非司酮8 mg/kg灌胃造模后可能造成局部内膜组织发育异常,“种植窗”延迟,导致胚胎着床障碍。电镜下观察各组造模后胞饮突形态提示米非司酮可通过拮抗孕激素对上皮组织表面胞饮突形成及发育造成不利影响,其中B组与D组胞饮突数量及发育程度较差。子宫内膜组织中PR阳性面积表达B组与D组明显低于A组与C组,B与D组间无统计学差异,提示B组、D组造模已干扰了孕酮的正常作用,无法正常诱导子宫内膜蜕膜化,导致着床失败。本实验结果提示妊娠第3天予4 mg/kg皮下注射米非司酮+丙二醇溶液可致SD大鼠完全着床障碍,而8 mg/kg米非司酮混悬液灌胃可致胚胎不完全着床障碍。
胚胎着床障碍动物模型目前没有统一的判定标准,刘艳娟等[17]认为妊娠率及着床数显著减少可作为判断造模成功的标准。但是通过本实验结果可知胚胎着床障碍模型判断标准不能一概而论,大致可分为完全型和不完全型。完全型着床障碍可模拟人类疾病中的薄型子宫内膜或因重度内膜受损导致的不孕症,“种植窗”完全关闭,无分泌期子宫内膜表现而出现着床障碍;而不完全型胚胎着床障碍模型更符合反复移植失败或复发性流产的疾病特征,因子宫内膜与胚胎发育不同步,胚胎粘附或蜕膜化异常,“种植窗”开放滞后出现着床数减少或胚胎发育不良。因此,大鼠妊娠第3天予8 mg/kg米非司酮混悬液造模可能为研究反复移植失败提供更为稳定且易复制的动物模型。
子宫内膜容受性是决定胚胎成功着床的重要前提条件,本实验研究虽在妊娠率及着床率基础上重点探索了米非司酮造模后子宫内膜形态学及子宫内膜容受性重要标志产物胞饮突的改变,但未就其分子生物学变化做进一步研究。有待于下一步继续挖掘米非司酮造模法对子宫内膜局部组织细胞因子、激素受体及母胎免疫指标的变化。
