利巴韦林用于病毒感染性疾病国内外文献分析*
2020-05-21魏春燕
刘 颖,魏春燕,沈 超,苏 娜
(四川大学华西医院药剂科,四川 成都 610041)
新型冠状病毒肺炎(COVID-19)疫情目前已在全球蔓延。截至2020年3月11日24 时,国内现有确诊病例14 831 例(其中重症病例4 257 例),累计治愈出院病例62 793 例,累计死亡病例3 169 例[1]。2020年2月4日,国家卫生健康委员会(简称国家卫健委)《新型冠状病毒感染的肺炎诊疗方案》(简称《诊疗方案》)第五版开始推荐利巴韦林作为抗病毒药物,成人首剂量4 g,次日每8 h 1 次,每次1.2 g 或8 mg/kg,静脉给药[2]。2月8日,《诊疗方案》(试行第五版修正版),更改其用法为每次500 mg,每日2 至3 次,静脉输注[3]。2月18日,《诊疗方案》(试行第六版)建议其疗程不超过10 d,同时建议与干扰素或洛匹那韦/利托那韦联合应用[4]。利巴韦林作为合成的核苷类抗病毒药物,于20 世纪70年代在国外上市。国产利巴韦林于20 世纪80年代上市,其药品说明书推荐用于呼吸道合胞病毒引起的病毒性肺炎与支气管炎、皮肤疱疹病毒感染,临床用于病毒性肝炎的辅助治疗。疫情期间,利巴韦林作为主要的抗病毒药物用于病毒感染治疗属首次。本研究中检索了国内外利巴韦林治疗非药品说明书推荐的病毒感染性疾病相关研究,分析利巴韦林应用的有效性,以期为COVID-19的治疗提供参考。现报道如下。
1 资料与方法
1.1 文献纳入标准和排除标准
纳入标准:利巴韦林用于非药品说明书推荐的病毒感染性疾病的研究,语种限定为英文和中文。
排除标准:用于呼吸道合胞病毒引起的疾病治疗;用于皮肤疱疹病毒感染的治疗;用于病毒性肝炎的治疗;药动学研究;药物经济学研究;调查研究。
1.2 资料来源与检索策略
根据Cortellis 药物研发综合情报平台提供的《Disease Briefing:Coronaviruses》(2020年3月6日版)[5],制订RNA 病毒列表。根据病毒列表中病毒名称检索数据库,包括Ovid Medline,Ovid EMBase,CENTRAL,CNKI;检索时限为自建库至2020年3月10日;检索限定题名检索,手工检索有关利巴韦林治疗COVID-19 优先发表的文章。主要病毒名称见表1。
1.3 方法
由一人检索并筛选文献,另一人提取纳入文献数据,最后由2 人交叉核对。
2 结果
2.1 文献筛选
通过数据库检索获得文献392 篇,其中英文355篇、中文37 篇,查重后获得文献222 篇,阅读文题、摘要和全文后,排除药动学研究22 篇、药物经济学研究7篇、综述4 篇及其他研究21 篇,最终纳入文献99 篇。
2.2 纳入文献特征
对初检的222 篇文献发表时间进行分析,可见利巴韦林用于非常见病毒感染性疾病的文献研究始至1975年,主要集中于2000年后(n =139,62.61%),2004年最多(n =13,5.86%),可能与2003年的SARS 疫情有关。文献计量图见图1。纳入研究的文献类型及病毒特征见表1。
2.3 文献结果分析
2.3.1 流行性感冒(流感)
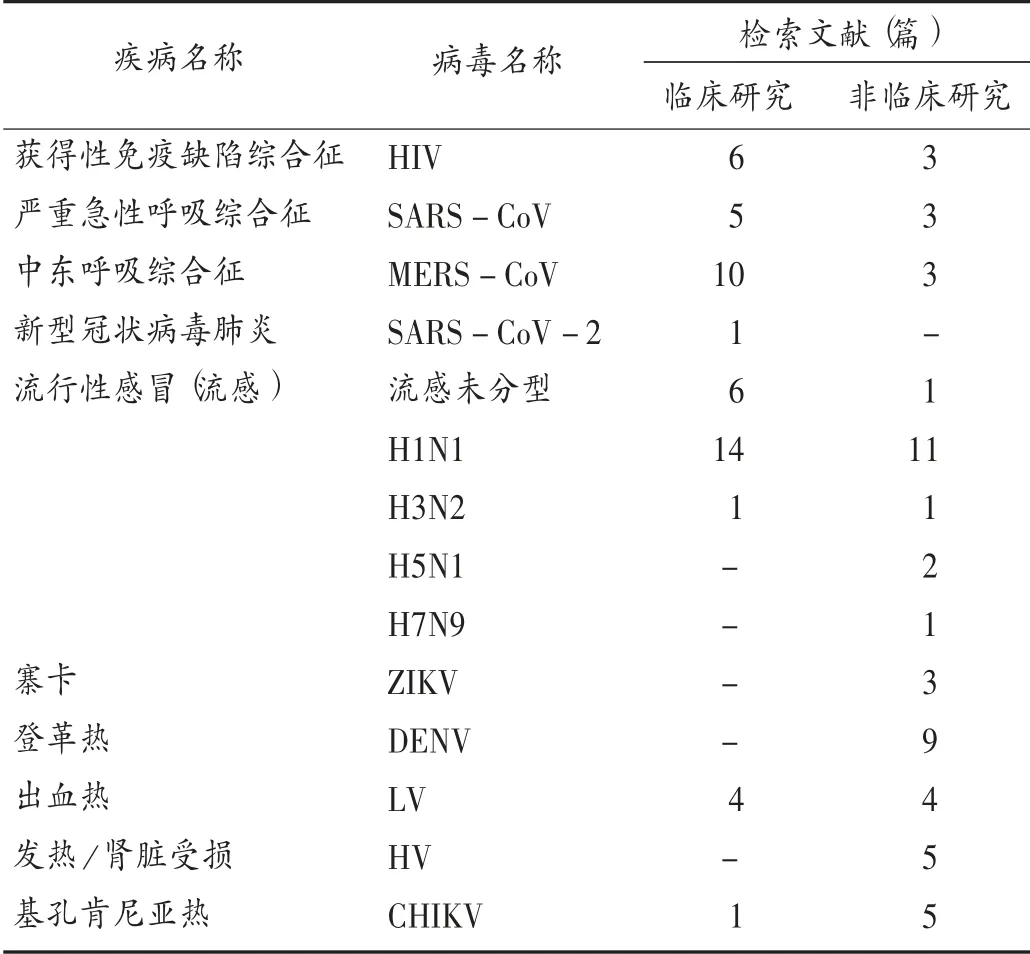
表1 纳入研究文献的病毒谱特征
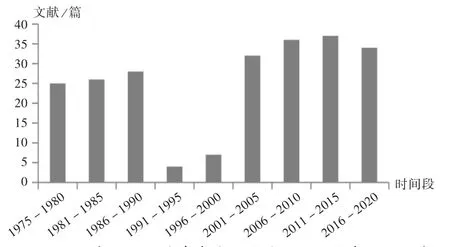
图1 利巴韦林用于病毒感染性疾病的文献发表时间分布
流感分型:流感是由流感病毒引起的一种急性呼吸道传染病,甲型和乙型流感每年呈季节性发作,其中甲型流感可引起全球大流行。流感病毒属于正黏病毒科,为单股、负链、分节段RNA 病毒,因核蛋白和基质蛋白不同,可分为甲(A)、乙(B)、丙(C)、丁(D)4 型。甲型流感病毒经常发生抗原变异,传染性强,传播迅速,极易发生大范围流行,对人类致病性高。迄今的研究发现,甲型流感病毒中能直接感染人的禽流感病毒亚型有甲型H1N1,H5N1,H7N1,H7N2,H7N3,H7N7,H7N9,H9N2和H10N8,其中H1,H5 及H7 亚型为高致病性,其中H1N1,H5N1 及H7N9 尤其值得关注。我国2019年版《流行性感冒诊疗方案》[6]指出,重症或有重症高危因素的患者应尽早给予经验性抗流感病毒治疗;非重症且无重症流感高危因素的患者,在发病48 h 内,充分评价风险和收益后,再考虑是否给予抗病毒治疗。该诊疗方案推荐的药物有神经氨酸酶抑制剂,如奥司他韦、扎那米韦、帕拉米韦;血凝素抑制剂,如阿比多尔,以及仅针对甲型流感的M2 离子通道阻滞剂金刚乙胺与金刚烷胺,未提及利巴韦林。本研究中共检索到利巴韦林治疗流感的文献37 篇,其中未分型的流感病毒7 篇,H1N1 25 篇,H3N2 2 篇,H5N1 2 篇,H7N9 1 篇。
流行性感冒(未分型):共检索到相关文献7 篇,其中动物实验1 篇。一项在美国进行的随机、双盲Ⅱ期的研究比较了利巴韦林联合其他抗病毒药物治疗流感的疗效,共纳入560 例大于18 岁且有较大流感并发症风险的流感患者,通过计算机随机分配为奥司他韦组(75 mg,2 次/日)、金刚烷胺组(100 mg,2 次/日)、利巴韦林和奥司他韦组(200 mg/75 mg,2 次/日),给药5 d,随访28 d;结果显示,抗病毒联合治疗组在第3 天出现了明显的病毒脱落,但这种差异与改善临床疗效无关[7]。一项双盲、多中心、安慰剂对照试验评价了雾化吸入利巴韦林对因流感住院的62 例儿童的疗效和安全性,利巴韦林组(27 例)体温≤38.3 ℃的患儿体温恢复正常时间为8.9 h,而安慰剂组(35 例)为22.6 h(P =0.04),其余结局指标如呼吸频率、脉搏率、咳嗽、意识水平两组差异无统计学意义[8]。可见,利巴韦林在体温恢复正常方面比安慰剂有效。
H1N1:共检索到相关文献25 篇,其中临床研究14 篇。李帅等[9]比较了磷酸奥司他韦与利巴韦林对100 例甲型H1N1 流感患儿的疗效及其对流感病毒转阴的影响,对照组(n =50)给予利巴韦林治疗,治疗组(n =50)在对照组基础上加用磷酸奥司他韦治疗。试验结果显示,治疗组患者总有效率为94.00%,显著高于对照组的78.00%(P <0.05);治疗3 d 和治疗5 d 的患者病毒转阴率分别为86.2%和100.0%,高于对照组(66.2%和86.2%,P <0.05);不良反应发生率为4.00%,明显低于对照组的16.00%(P <0.05)。可见,磷酸奥司他韦与利巴韦林联用治疗甲型H1N1 流感患儿的疗效较单用利巴韦林更好,可提高流感病毒转阴率,且安全性较高。郑怡[10]观察了利巴韦林联合复方甘草酸苷治疗甲型H1N1 流感患者64 例的临床效果,对照组(n =32)予利巴韦林治疗,治疗组(n =32)在对照组基础上联合复方甘草酸苷治疗。试验结果显示,治疗组总有效率高于对照组(93.75%比71.88%,P <0.05),患者体温恢复正常、咽部充血消失、血常规恢复正常及胸部X 线摄片恢复正常的时间均短于对照组(P <0.01),不良反应发生率低于对照组(9.38%比37.50%,P <0.01)。可见,利巴韦林联合复方甘草酸苷治疗甲型H1N1 流感,能加速患者康复,缩短病程,降低不良反应发生率。
H3N2:共检索到相关文献2 篇。ALBERT 等[11]比较了利巴韦林、盐酸金刚烷胺和安慰剂预防A 型人流感的临床疗效,纳入29 例血清培养阴性的男性患者,分为3 组,分别给予每天3 次利巴韦林胶囊(200 mg)、每天3 次安慰剂胶囊、每天2 次金刚烷胺胶囊(100 mg),于接种2×10450%组织培养感染剂量的马里兰大学/2/74(H3N2)流感病毒前2 d 开始用药8 d。试验结果显示,利巴韦林组和安慰剂组的抗体反应差异无统计学意义,利巴韦林组在降低血清抗体滴度和发热反应方面劣于金刚烷胺组。
H5N1:共检索到相关文献2 篇,分别为细胞研究和体内外研究。ILYUSHINA 等[12]开展了奥司他韦与利巴韦林联合治疗高致病性H5N1 流感病毒感染小鼠的研究,使用两种高致病性的H5N1 病毒(A/Vietnam/1203/04 与A/Turkey/15/06),接种前4 h 对BALB/c小鼠使用奥司他韦[1,10,50 或100 mg/(kg·d)]、利巴韦林[37.5,55 或75 mg/(kg·d)]或两药联用,共8 d。试验结果显示,37.5 mg/(kg·d)利巴韦林与1 mg/(kg·d)奥司他韦联合使用,以及37.5 mg/(kg·d)利巴韦林与10 mg/(kg·d)奥司他韦联合使用,对A/Vietnam/1203/04 和A/Turkey/15/06 病毒的抑制均有协同作用,认为联合治疗可能比单一治疗更有效。
H7N9:2013年首次发现H7N9 病毒,其对M2 离子通道阻滞剂(金刚烷胺和金刚乙胺)天然耐药[13]。共检索到相关文献1 篇[14]。该研究评价了利巴韦林对H7N9病毒的有效性,尤其是耐神经氨酸酶抑制剂的病毒突变体。采用体外培养人感染的H7N9 病毒,分别采用耐药(A/Anhui/1/2013)AHH7N9 和耐药SH-H7N9 两种病毒,以50%有效的病毒抑制浓度(EC50)评价利巴韦林的抗病毒作用。采用连续稀释2 倍的利巴韦林,分别在MadinDarby 犬肾脏(MDCK)上皮细胞上检测抗AH-H7N9 和SH-H7N9 的EC50,结果EC50为0.01 ~0.02 mg/mL,表明利巴韦林对两者均有效,提示利巴韦林既可用于耐AH-H 的H7N9 病毒,也可用于耐SHH7N9 病毒。此外,计算的EC50300 倍剂量的利巴韦林在体外也是安全的,无显著的细胞毒性。动物试验在小鼠模型上测试了利巴韦林对H7N9 感染的疗效,以14 d内动物的存活率、体质量变化百分比和临床症状为结局指标。结果发现,利巴韦林组和扎那米韦组小鼠的临床症状比安慰剂组更温和,利巴韦林或扎那米韦治疗的小鼠的LVTs 比无菌磷酸盐缓冲盐水(PBS)安慰剂组低10倍(P <0.5);与扎那米韦组相比,利巴韦林组小鼠的LVTs 较低,但差异无统计学意义(P >0.5)。可见,利巴韦林在体内外对H7N9 病毒感染的抗病毒活性与扎那米韦相当。
2.3.2 获得性免疫缺陷综合征
共检索到相关文献9 篇。1990年ANONYMOUS[15]开展了利巴韦林用于艾滋病(艾滋病患者和艾滋相关综合征患者各6 例)治疗,疗程为6 个月,口服给药,第1 周每日3 000 mg,第2 周每日2 000 mg,结束前每日1 000 mg。结果显示,6 例艾滋病患者用药后临床症状和实验室指标均无改善,而6 例艾滋相关综合征患者症状消失,平均增重约2.5 kg。
HARVIE 等[16]开展了利巴韦林对获得性免疫缺陷综合征小鼠模型的抗病毒作用及毒性研究。利巴韦林剂量6.25 ~200 mg/(kg·d),腹腔注射,每天2 次,持续6周。结果显示,利巴韦林剂量≥25 mg/kg 时对脾肿大和淋巴结病有显著的预防作用;以50 mg/kg 开始的剂量可保护机体免受高巨噬细胞球蛋白血症的侵袭,使脾脏CD8+T 细胞的损失最小化;在小鼠模型中,利巴韦林剂量≥50 mg/kg 时可保护小鼠免受逆转录病毒感染的影响,≥100 mg/kg 时可诱发严重的血液毒性。
2.3.3 严重急性呼吸综合征(SARS)
检索到相关文献8 篇。一项回顾性研究报道了高剂量利巴韦林治疗怀疑感染SARS 患儿13 例,一旦有明确接触史便开始口服利巴韦林,每天40 ~60 mg/kg,治疗后48 ~72 h 加用强的松0.5 ~1.0 mg /(kg·d);对于持续发热、临床症状持续恶化、胸部X 线摄片或胸部计算机断层扫描(CT)渐进性实变的患儿,静脉给予利巴韦林20 mg/(kg·d)和静脉冲击甲泼尼龙10 mg/(kg·d),持续2 ~3 d。随访6 周,患儿全部治愈,无后遗症,均未出现贫血症状,也未出现利巴韦林其他的不良反应,包括癫痫、乏力、低钙血症、高氨血症、高尿酸血症和皮疹[17]。
KOREN[18]报道,利巴韦林用于香港SARS 患者10例,经验性使用利巴韦林治疗,9 例静脉给药,8 mg/kg、每8 h 1 次,1 例口服利巴韦林1.2 g、每8 h 1 次,所有患者均给予糖皮质激素(氢化可的松或甲基强的松龙)治疗,在症状出现后3 ~22 d(平均12.5 d)开始治疗。结果8例患者治疗2 d 后发热缓解、心率减慢,另2 例患者死于呼吸衰竭。
2.3.4 中东呼吸综合征(MERS)
共检索到相关文献13 篇,其中利巴韦林联合干扰素治疗MERS 的回顾队列研究5 篇[19-23],均采用利巴韦林联合干扰素治疗,结果显示,利巴韦林与干扰素全身给药并未显著降低患者的死亡风险。
AL-TAWFIQ 等[24]回顾性分析了5 例MERSCoV 阳性患者采用利巴韦林联合干扰素治疗的效果。所有患者均为使用辅助糖皮质激素治疗的重症急性呼吸窘迫综合征患者,初始治疗时均处于机械通气状态,从入院到使用利巴韦林和干扰素治疗的中位时间为19 d(10 ~22 d)。结果所有患者对支持性或治疗性干预均无反应,均死于疾病。利巴韦林和干扰素可能对某些患者有效,但临床前数据显示有效的联合抗病毒治疗可能无法使病程中较晚被诊断为多种共病的危重症患者获益。
2.3.5 COVID-19
检索到相关文献1 篇[25],提到COVID-19 的抗病毒药物治疗推荐利巴韦林,同时也提到利巴韦林对高致病性冠状病毒呼吸综合征的患者疗效有限,建议利巴韦林与干扰素或洛匹那韦/利托那韦联用。
2.3.6 寨卡病毒(ZIKV)感染
检索到相关文献3 篇,其中2 篇为细胞研究。JIAE等[26]的研究使用了不同的细胞模型,包括人类神经元祖细胞(human neuronal progenitor cells,hNPCs)、人类皮肤成纤维细胞(human dermal fibroblasts,HDFs)、人类肺腺癌细胞(A549)和Vero 细胞,评估法维拉韦(T-705)和利巴韦林对亚洲和非洲菌株ZIKV 的抗病毒活性。采用法维拉韦或利巴韦林处理细胞,通过实时荧光定量PCR 和斑块实验测定其对ZIKV 复制的影响。结果显示,法维拉韦或利巴韦林处理均显著抑制ZIKV 的复制,且呈剂量依赖性。
2017年KAMIYAMA 等[27]的研究指出,利巴韦林在体外对ZIKV 复制和ZIKV 诱导的细胞死亡有抑制作用,但没有细胞毒性作用。缺乏I 型干扰素(IFN)信号转导的stat1 缺陷小鼠对ZIKV 感染高度敏感,并表现出致死结局,利巴韦林可治疗ZIKV 感染的stat1 缺陷小鼠的病毒血症。
2.3.7 登革热(dengue)
登革热是登革病毒经蚊媒传播引起的急性虫媒传染病。登革病毒为黄病毒科黄病毒属,是单股正链RNA病毒,目前已分离出4 个血清型,均有致病性。伊蚊(包括埃及伊蚊和白纹伊蚊)是登革热的主要宿主,患者和隐性感染者是主要传染源,患者发病1 d 至发病后3 d内传染性最强,少数患者热退后第3日还可从血液中分离到病毒。共检索到相关文献9 篇,均为动物研究或细胞研究。一项对感染登革热病毒的恒河猴进行的安慰剂对照研究[28]研究了利巴韦林对非人类灵长类动物感染黄病毒的预防效果,结果显示,利巴韦林组和安慰剂组均出现了病毒血症,病毒血症高峰出现在感染后第3 天至第9 天;安慰剂组和利巴韦林组在发病时间、病程和病毒血症水平上均无显著差异;利巴韦林可预测贫血和血小板增多症。该试验认为,从猴子模型中病毒血症的严重程度来看,利巴韦林作为预防登革1 型病毒感染的药物似乎是无效的。
2.3.8 拉沙病毒出血热(lassafever,LF)
LF 是发生在西非的一种病程1 ~4 周的急性疾病,相关症状首次于20 世纪50年代被描述,但直到1969年才确定拉沙病毒是引起该病的病毒。拉沙病毒是一种属于沙粒病毒科沙粒病毒属的单链RNA 病毒。共检索到相关文献8 篇,其中1 篇为利巴韦林治疗LF 的系统回顾和荟萃分析[29]。研究显示,利巴韦林用于天门冬氨酸氨基转移酶(AST)升高的患者可降低死亡率[ OR =0.41,95% CI(0.23,0.73)],而AST 未升高的患者死亡率则升高[ OR =2.37,95% CI(1.07,5.25)]。目前的治疗指南可能会因此而增加轻度LF 患者的死亡风险,故利巴韦林在LF 治疗中的作用需要紧急、重新评估。
2.3.9 汉坦病毒
汉坦病毒属布尼亚病毒科,是一种有包膜、分节段的负链RNA 病毒,可引发汉坦病毒肺综合征(HPS)和汉坦病毒肾综合征出血热(HFRS)。共检索到相关文献5 篇。一项研究[30]在感染了汉坦病毒的乳鼠模型上评价不同剂量利巴韦林的疗效,结果显示,治疗后2 d 内乳鼠血清、肝脏和脾脏病毒滴度降低;第18 天,除大脑外,利巴韦林处理过的乳鼠器官的病毒滴度比没处理的动物低100 倍;接受治疗的乳鼠器官中病毒滴度持续下降,且随访75 d 无疾病复发的迹象。
2.3.10 基孔肯尼亚病毒(CHIKV)
CHIKV 属于披膜病毒科甲病毒属的Semliki forest(SF)抗原复合群,病毒直径约为70 nm,有包膜,含有3个结构蛋白和4 个非结构蛋白,其基因组为不分节段的正链RNA。人与非人灵长类动物是CHIKV 的主要宿主。基孔肯尼亚热是由CHIKV 引起的,经伊蚊传播,以发热、皮疹及关节痛为主要特征的急性传染病。共检索到相关文献6 篇。一项研究对比了四环素及其衍生物、利巴韦林等常用抗病毒药物对CHIKV 的抗病毒作用,试验结果显示,四环素及其衍生物组中,多西环素在Vero 细胞中对CHIKV 复制的抑制作用最强;抗病毒药物组中,与多西环素相比,利巴韦林对CHIKV 的复制表现出较高的抑制作用;利巴韦林的抑制作用均高于四环素衍生物组;多西环素与利巴韦林的EC50 分 别 为(10.95±2.12)μmol/L 与(15.51±1.62)μmol/L,而多西环素与利巴韦林(1 ∶1)联合用药的EC50为(4.52±1.42)μmol/L[31]。
一项研究观察了利巴韦林对基孔肯亚热患者临床结果的影响,10 例发热后持续有下肢疼痛和关节炎的患者接受利巴韦林治疗(每天2 次,每次200 mg,连续服用7 d,随访4 周),选择同期10 例病情相似的患者作为对照,结果显示,利巴韦林组患者关节疼痛均有所改善,其中6 例能自由行走,软组织肿胀亦有8 例减轻,3 例活动后疼痛改善,提示利巴韦林可能对CHIKV 有直接的抗病毒作用,可更快地改善患者的关节和软组织症状[32]。
3 讨论
利巴韦林属于广谱抗病毒药物,其作用机制目前尚不完全明确。目前认为,利巴韦林进入病毒感染的细胞后迅速磷酸化,其产物作为病毒合成酶的竞争性抑制剂,通过抑制肌苷单磷酸脱氢酶、流感病毒RNA 多聚酶和mRNA 鸟苷转移酶,从而引起细胞内鸟苷三磷酸的减少,损害病毒RNA 和蛋白质合成,使病毒的复制和传播受抑制[33]。
文献综合分析发现,利巴韦林的抗病毒疗效确切,但需联合其他抗病毒药物,且联用的疗效一般优于单用,联用药物以奥司他韦居多。利巴韦林用于病毒感染的研究覆盖的病毒种类多,除了药品说明书和指南常规推荐的利巴韦林用于治疗呼吸道合胞病毒、皮肤疱疹病毒、肝炎病毒外,还检索到利巴韦林用于治疗高致病性的β 属 冠 状 病 毒,如SARS-CoV,MERS-CoV 和SARS-CoV-2。由于SARS-CoV-2 与前两种病毒同属,故《诊疗方案》(试行第六版)推荐利巴韦林作为COVID-19 的抗病毒治疗药物之一。关于利巴韦林的临床研究文献48 篇,非临床研究(动物或细胞)文献51篇,非临床研究偏多,特别是关于寨卡病毒、登革热病毒、汉坦病毒纳入的研究只有非临床研究。因此,对于利巴韦林在人体的抗病毒治疗效果,仅有限于HIV,SARS-CoV,MERS-CoV、汉坦病毒等病毒的感染研究,若将利巴韦林用于仅有非临床试验病毒的人体病毒感染的治疗,需特别谨慎。
此次COVID-19 疫情全球蔓延,有大量的感染病例,同时也可提供高质量的用药证据,期待今后研究者开展更多的大规模回顾性病例研究,特别是对于亟待解决的利巴韦林联合用药、剂量和安全性等问题。
