头孢噻肟或头孢他啶联合阿奇霉素改善未足月胎膜早破孕妇母婴结局效果评价*
2020-05-21王柯静吕宗杰
王柯静,陈 琳,吕宗杰,颜 宇,陈 真
(重庆市妇幼保健院,重庆 401147)
未足月胎膜早破(PPROM)是指发生在妊娠37 周前的胎膜破裂,常诱发绒毛膜羊膜炎、早产、胎儿宫内窘迫、新生儿肺炎等不良妊娠结局,是影响围产期母婴发病和死亡的重要原因[1]。感染与PPROM 互为因果,生殖道感染是PPROM 最常见的独立危险因素,胎膜破裂后病原体进一步上行侵入宫腔诱发绒毛膜羊膜炎和胎儿宫内感染[2-3]。破膜后预防性使用抗菌药物能减少母婴感染的风险并延长潜伏期,可减少早产相关的新生儿并发症,从而改善母婴结局[2-4]。目前最佳的抗菌药物方案尚未确定[3-5]。美国妇产科医师协会(ACOG)和加拿大妇产科医师协会(SOGC)推荐使用“氨苄西林/阿莫西林联用红霉素7 d”方案,其侧重点是B 族链球菌(GBS)和非典型病原体,兼顾大肠埃希菌[6-8]。
我院对胎膜早破孕产妇病原体分布及耐药情况进行多年追踪[6,9-10],发现国内PPROM 主要病原菌是以大肠埃希菌为代表的革兰阴性菌,对国外指南推荐的氨苄西林/阿莫西林的耐药率较高[10]。阿奇霉素因其疗效及药代动力学等方面的优势已取代红霉素成为治疗非典型病原体的一线药物[5]。我国《胎膜早破的诊断与处理指南(2015)》指出,由于我国抗菌药物耐药非常严重,在参考ACOG 推荐方案的前提下要依据个体情况选择用药和方案[3],并未推荐具体的替代方案,导致临床使用的抗菌药物方案多种多样,难以保证用药效果和母婴安全。我院临床药师与医师基于对国内胎膜早破病原学分布特点和细菌耐药形势的研究[6,9-11],参考法国国家妇产科医师协会2019年发布的《未足月胎膜早破指南》及UpToDate 网站2019年1月更新的未足月胎膜早破综述等循证医学证据[5,12],结合抗菌药物的抗菌谱和药代动力学特点,权衡妊娠期用药的安全性,共同制订第3 代头孢类抗菌药物联用阿奇霉素方案,为临床合理用药提供了依据。
1 资料与方法
1.1 一般资料
纳入标准:远足月(孕周28 ~33+6周)的胎膜早破孕妇;破膜时间不超过24 h;符合期待治疗条件,同时孕妇及其家属要求保胎。本研究方案经医院医学伦理委员会批准,孕妇自愿参与本研究并签署知情同意书。
排除标准:入院时已临产或出现胎儿宫内窘迫、胎盘早剥、脐带脱垂等不适宜期待治疗等;入院时有宫内感染、呼吸道感染、尿路感染等明确的其他组织器官感染;双胎妊娠、胎儿畸形、宫颈功能不全。
孕妇选择与分组:选取我院2018年3月至2019年5月分娩的PPROM 孕妇143 例,随机分为对照组(71 例)和观察组(72 例)。两组孕妇一般资料比较,差异无统计学意义(P >0.05),具有可比性。详见表1。
1.2 方法
观察组孕妇给予注射用头孢噻肟钠(华北制药河北华民药业有限责任公司,国药准字H10960279,规格为每支1 g)1 g 或注射用头孢他啶(葛兰素史克有限公司,进口药品注册证号H20171174,规格为每支1 g)1 g,每8 h 1 次;联合注射用阿奇霉素(东北制药集团沈阳第一制药有限公司,国药准字H20000197,规格为每支0.125 g)0.5 g 静脉滴注,每日1 次,连续3 d;头孢地尼分散片(天津市中央药业有限公司,国药准字H20060980,规格为每片50 mg)100 mg 口服,每日2 次,连续4 d;疗程共7 d。对照组孕妇按指南[3,7-8]推荐的药品品种并结合国内药品说明书推荐的用法用量给药:注射用氨苄西林钠(西南药业股份有限公司,国药准字H50020021,规格为每支0.5 g)2 g +注射用乳糖酸红霉素(美罗药业股份有限公司,国药准字H21021678,规格为每支0.25 g)0.5 g,每8 h 1 次,静脉滴注3 d;阿莫西林胶囊(中诺药业石家庄有限公司,国药准字H13021770,规格为每片0.5 g)0.5 g +红霉素肠溶片(西安利君制药有限公司,国药准字H61021632,规格为每片0.125 g)0.25 g,每6 h 1 次,连续口服4 d;疗程共7 d。改为口服的时机由医师和临床药师根据孕妇具体情况而定,待阴道分泌物培养结果、药物感性试验结果和治疗效果确定后再决定是否换用抗菌药物。期待治疗至孕期≥34 周,胎儿肺发育成熟后予以引产。一旦出现绒毛膜羊膜炎、胎儿宫内窘迫、中重度胎盘早剥、脐带脱垂等情况立即终止妊娠;一旦诊断为绒毛膜羊膜炎,抗菌药物方案应立即调整为治疗用药方案。
1.3 观察指标
潜伏期:胎膜破裂至临产前的时间。
炎性标志物及胎膜培养结果:孕妇分娩前体温、血常规(日本Sysmex 公司,XN -100 型全自动血细胞分析仪)、C 反应蛋白(CRP,奥普生物医药有限公司,OTTOMAN-1000 型全自动特定蛋白即时检测仪,免疫比浊法)和降钙素原(PCT,梅里埃VIDAS30 型全自动免疫分析仪,酶联免疫荧光法)出现异常的发生率。根据临床绒毛膜羊膜炎的诊断标准及各检查指标的参考值[1,3],以孕妇体温2 次≥37.8 ℃、白细胞计数>15×109/L、CRP>10 mg/L 及PCT >0.05 ng/mL 作为异常。
孕产妇的妊娠结局:临床绒毛膜羊膜炎、组织学绒毛膜羊膜炎(即胎膜培养阳性)、产后出血和产褥感染的发生率。
胎儿和新生儿结局:胎儿宫内窘迫的发生率;新生儿体质量,新生儿肺炎、新生儿早发性败血症及坏死性小肠结肠炎(NEC)的发生率;新生儿出生后分别在1,5,10 min 进行Apgar 评分(包括肌张力、脉搏、对刺激的反应、肤色、呼吸5 项),满分为10 分[1]。
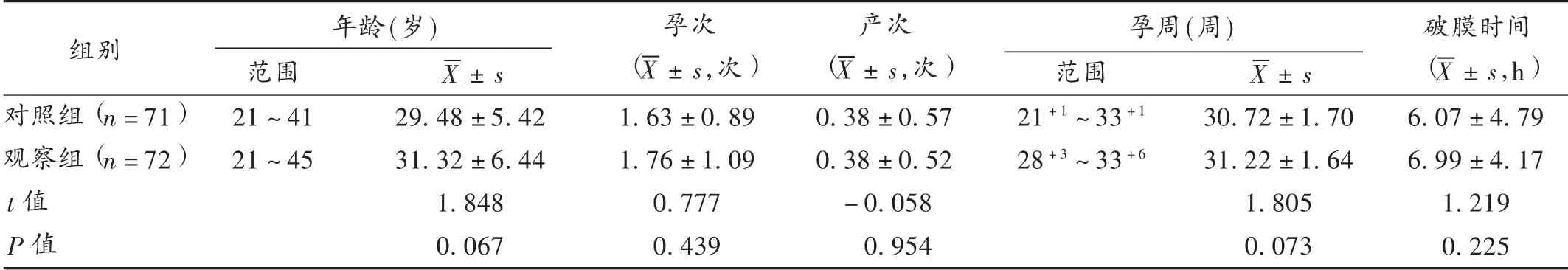
表1 两组孕妇一般资料比较
孕产妇的症状和体征:一旦出现过敏等药品不良反应,及时记录并做相应处理。
1.4 统计学处理
采用SPSS 19.0 统计学软件分析。计量资料以表示,行t检验;计数资料以率(% )表示,行χ2检验。P <0.05 为差异有统计学意义。
2 结果
结果见表2 至表4。两组胎儿宫内窘迫的发生率及两组新生儿1 min Apgar 评分无显著差异(P>0.05),两组新生儿5,10 min 的Apgar 评分均为满分(10 分)。两组新生儿体质量及新生儿肺炎的发生率差异显著(P <0.05)。两组新生儿早发性败血症、NEC 无显著差异(P >0.05)。
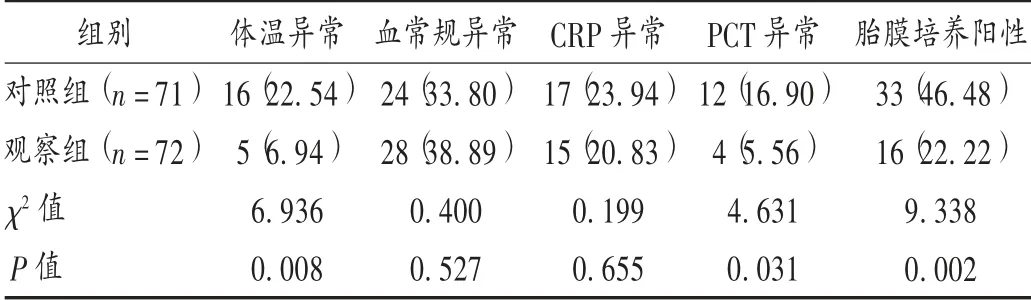
表2 两组孕妇分娩前炎性标志物异常及培养结果比较[例(%)]
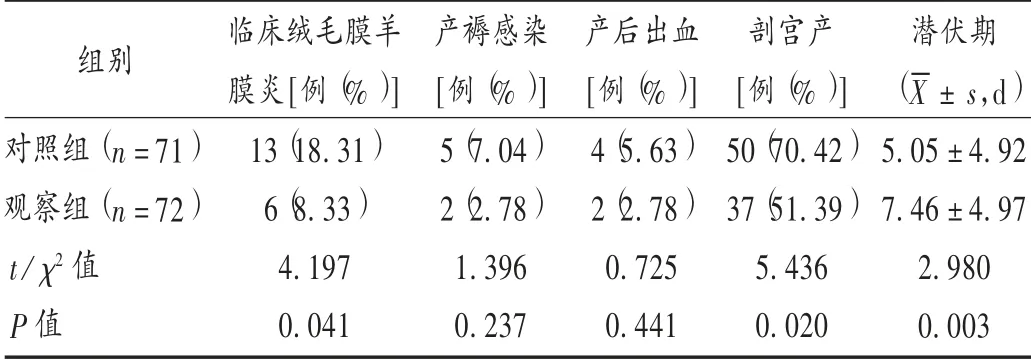
表3 两组孕妇妊娠结局比较
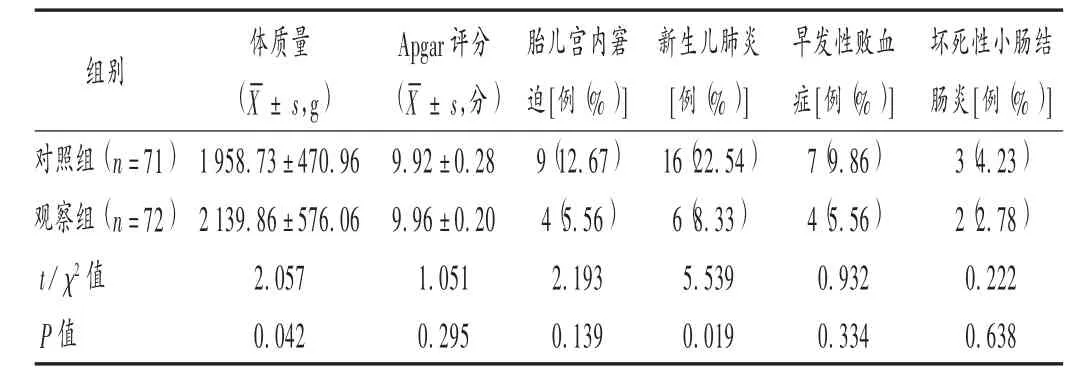
表4 两组胎儿及新生儿结局比较
3 讨论
PPROM 是指发生在妊娠37 周前的胎膜破裂,其中远足月(妊娠24 ~34 周)因胎儿尚未发育成熟,国内外指南[3,8-7]均推荐期待治疗,但应权衡母婴感染风险。
感染与未足月胎膜早破具有明确的相关性,亚临床宫内感染和近宫颈处胎膜的局部炎症是未足月胎膜早破的主要原因[2-8]。胎膜破裂后,胎膜屏障作用消失,病原体进一步上行侵入宫腔,30%的胎膜早破早产孕妇存在微生物入侵羊膜腔(MIAC)现象[13]。国内外指南均推荐,PPROM 孕妇在期待治疗期间尽早预防使用抗菌药物,以减少母婴感染的风险[3,7-8]。此外,预防性使用抗菌药物还有利于延长潜伏期[2,7],减少早产及早产相关并发症。
全球PPROM 感染多为革兰阴性杆菌、革兰阳性菌、非典型病原体及厌氧菌等微生物的混合感染[4,14]。非典型病原体是培养证实的绒毛膜羊膜炎病例中最常见的微生物[14-15]。美国和加拿大与PPROM 相关的主要病原体为GBS,绒毛膜羊膜炎孕妇羊水中GBS 的分离率为15%,而革兰阴性菌包括大肠埃希菌的分离率 仅 为8%[7-8,14]。基 于 此,ACOG 和SOGC 制 订 的PPROM 指南推荐方案其防治的侧重点是GBS 和非典型病原体,兼顾大肠埃希菌,但我国病原菌的分布与国外存在差异。1980年至2012年,中国6 个地区3 782 例胎膜早破孕妇分离出的1 706 株微生物,集中于葡萄球菌和大肠埃希菌,进一步亚群分析表明,中国6 个地区的微生物分布存在差异[6]。我院对重庆地区胎膜早破孕产妇病原体分布及耐药性情况进行多年的追踪[9-10],研究表明,重庆地区以大肠埃希菌为代表的革兰阴性杆菌为主,大肠埃希菌在分离菌中占绝对优势;常检出的革兰阳性菌包括金黄色葡萄球菌、表皮葡萄球菌、腐生葡萄球菌、粪肠球菌、B 族链球菌等多种革兰阳性球菌,无某一种阳性菌的分离率占绝对优势。除孕妇所携带致病原菌分布的差异外,国内的细菌耐药物形势更严峻。2018年发布的《2017年CHINET 中国细菌耐药性监测》[11]显示,大肠埃希菌对氨苄西林的耐药率达85.9%。中国《胎膜早破的诊断与处理指南(R015)》并未推荐具体的药物[3]。故有必要探索适合我国的未足月胎膜早破抗菌药物预防用药方案。我国预防用药方案应选择广谱抗菌药物联用,侧重于以大肠埃希菌为代表的肠杆菌科细菌和非典型病原体,兼顾革兰阳性菌。参考法国国家妇产科医师协会(CNGOF)2019年的指南及其他循证医学证据,本研究中选择第3 代头孢类抗菌药物联用阿奇霉素方案[5,12,16]。第3 代头孢类抗菌药物抗菌谱广,能覆盖主要的革兰阴性菌和革兰阳性菌,对β -内酰胺酶包括青霉素酶和头孢菌素酶稳定性较高。其中,头孢噻肟和头孢他啶主流的第3 代头孢类抗菌药物,头孢噻肟对以大肠埃希菌为代表的肠杆菌科细菌的作用是第3 代头孢中最强的[17],大肠埃希菌对头孢他啶的耐药率保持在较低水平[9,11]。此外,第3 代头孢类抗菌药物对肾脏、肝脏无明显毒性,引起过敏反应特别是过敏性休克的发生率明显低于青霉素类[17]。
非典型病原体无细胞壁,对阻碍细胞壁合成的抗菌药物无效,但对影响蛋白质合成的大环内酯类敏感。阿奇霉素为第2 代大环内酯类药物[18],其作用机制与红霉素相同,抗菌活性更强,增强了对革兰阴性菌及厌氧菌的作用,减轻了红霉素的胃肠道反应和肝毒性,对生殖道支原体感染仍保持较高的敏感性。UpToDate 网站2019年更新的PPROM 系统综述中推荐单剂量阿奇霉素替代经典方案中的红霉素[5]。研究表明,阿奇霉素能显著延长潜伏期,并减少新生儿感染和早产相关并发症的风险[19]。由于阿奇霉素半衰期达35 ~48 h,具有典型的抗菌药物后效应,停药后药物在组织的治疗浓度仍可维持5 ~7 d[18],本研究中采用静脉注射阿奇霉素3 d 即停药,可避免药物在体内的蓄积。
PPROM 的抗菌药物选择,除考虑病原体分布和药物敏感性试验结果外,最重要的是考虑抗菌药物在妊娠期使用的安全性。头孢噻肟、头孢他定及阿奇霉素均为美国食品药物管理局(FDA)妊娠药物分级体系中的B 级药物;《妊娠期和哺乳期用药(第7 版)》[20]和REPROTOX等妊娠期药物资讯网站均认为,基于动物试验和人类研究,妊娠期使用头孢噻肟、头孢他定及阿奇霉素不会增加先天性畸形的风险。
本研究结果显示,与指南推荐的方案相比,第3 代头孢类抗菌药物联合阿奇霉素方案能有效延长破膜后的潜伏期,可为使用地塞米松促胎肺成熟、使用硫酸镁保护胎儿神经发育等措施争取时间,提高了新生儿的体质量,减少了新生儿肺炎的发生率,降低早产及早产相关并发症的风险。感染是期待治疗期间最主要的风险,观察组孕妇分娩前体温和PCT 异常的发生率低于对照组,分娩后胎膜培养阳性率和临床绒毛膜羊膜炎低于对照组,表明观察组抗菌药物方案有利于减少破膜后羊膜腔的细菌入侵,一定程度上减少了因绒毛膜羊膜炎或胎儿宫内窘迫紧急实施剖宫产的概率,有效地改善母婴的妊娠结局。
综上所述,国内PPROM 孕妇病原体分布和细菌耐药形势与西方国家差异较大,不宜照搬国外指南所推荐的用药方案。我国胎膜早破的防治策略应选择广谱抗菌药物,侧重于以大肠埃希菌为代表的肠杆菌科细菌和非典型病原体并兼顾革兰阳性球菌,合理选择对母婴安全的药物。第3 代头孢类抗菌药物联用阿奇霉素方案用于未足月胎膜早破安全有效,可为特殊人群合理使用抗菌药物提供依据,但本研究中未能进行头孢噻肟和头孢他定分别联用阿奇霉素的有效性研究,后续应作进一步深入研究。
