猪microRNA-206新靶基因G6PD的鉴定及表达模式分析
2020-05-18姜爱文陈禹均张增凯刘红林吴望军
姜爱文,陈禹均,董 超,张增凯,刘红林,吴望军
(南京农业大学 动物科技学院,江苏 南京 210095)
miR-206是一种骨骼肌特异性miRNA,它的表达具有骨骼肌组织特异性以及分化时序性[1-2]。它通过与下游靶基因形成沉默复合体(RISC),调控靶基因mRNA或蛋白水平,从而影响各个生命活动,如细胞增殖、细胞分化以及细胞凋亡[3-5]。RAO等[6]和KOUTALIANOS等[7]的研究发现miR-206是肌分化标志基因MyOD和MyOG的下游,对骨骼肌分化起正向调节作用。随着研究的深入,其下游靶基因被广泛验证,如CDK4、cyclingD1、connexin43等都是它的靶基因,且它能通过下调这些基因的表达使细胞周期发生阻滞、影响肌细胞分化[1,8-9]。除此之外,miR-206可以通过调控Smad3、TGF-teta1、HDAC4等基因的表达促进骨骼肌修复,加速成肌形成[10],这对骨骼肌相关疾病的治疗具有极大的意义。
骨骼肌纤维根据其结构、代谢和收缩特点的不同被分成快肌纤维和慢肌纤维两大类[11-12]。其中,由于慢肌当中富含氧气、线粒体和肌红蛋白,代谢过程以氧化还原反应占主导地位,因此颜色比快肌深,呈红色,而快肌纤维则以无氧代谢为主,颜色呈白色[12]。研究表明,miR-206除了参与骨骼肌细胞的分化过程,也可调控骨骼肌肌纤维类型转化的过程。Lee等人发现miR-206的单核苷酸多态性(single nucleotide polymorphism,SNPs)会影响不同肌纤维类型在骨骼肌中的占比[13],WILLIAMS等[14]发现,miR-206在慢肌中表达量极显著高于快肌,暗示miR-206参与调节肌纤维类型的转换。能量代谢的变化,是肌纤维类型转化的重要环节。为了研究miR-206能否通过调控能量代谢过程影响肌纤维类型的转化,本试验通过生物信息学软件Targetscan(Release 3.1)筛选到了与能量代谢密切相关的、miR-206新的下游靶基因—G6PD,通过双荧光素酶报告基因载体确定两者的靶标关系,并研究miR-206及G6PD在不同骨骼肌纤维中的表达模式,为进一步分析miR-206调控骨骼肌纤维提供理论依据。
1 材料与方法
1.1 试验动物以48头二元商品猪杜洛克×梅山为研究群体,选取肌纤维类型肉色差异极显著的个体3头(31,36,39),利用其组织及骨骼肌样品进行定量分析。以279头四元商品猪皮特兰×杜洛克×长白×大白为研究群体,根据本实验室前期工作[15],选取肌内脂肪含量极高或极低的个体各8头,进行定量分析。宰前禁食24 h,自由饮水。所有处理均符合南京农业大学动物管理协会处理办法。
1.2 RNA提取与qRT-PCR测定总RNA的提取按Trizol试剂盒说明书进行。使用miRNA反转录试剂盒(638313,TaKaRa,大连,中国)对miR-206进行反转录,使用反转录试剂盒(RR036A,TaKaRa)对G6PD mRNA进行反转录,采用SYBR Green 荧光实时定量PCR(RR820A,TaKaRa)检测miR-206及G6PD的相对表达量。miR-206的表达以miR-17为内参,mRNA的表达以HPRT为内参。引物均由金唯智生物科技有限公司(苏州,江苏,中国)合成,相关序列参见表1。

表1 相关引物序列
1.3 细胞培养双荧光素酶报告基因载体的转染使用293T细胞,293T细胞接种于T25中,用含有10%胎牛血清(FBS,Sigma-Aldrich,St.Louis,MO,USA)的高糖DMEM培养基(Hyclone Laboratories,Logan,UT,USA)进行生长培养。所有细胞放于37℃、5%CO2的培养箱中培养。细胞经胰酶37℃消化处理2 min后,立即加入完全培养基终止消化,1 000 r/min离心5 min后弃上清,收集细胞沉淀。
1.4 转染转染使用LipofectamineTM3000试剂(Invitrogen,Carlsbad,CA,USA),将miR-206过表达质粒(PSP-206)及其阴性对照(PSP-U1),脂质体分别使用按照六孔板每孔125 μL Optin培养基稀释,将稀释好的脂质体与质粒混合后静置5 min后转染细胞,具体操作按说明书进行。
1.5 双荧光素酶分析5种PmirGLO双荧光素酶报告基因载体由捷瑞公司(上海,中国)合成,内含猪G6PD基因野生型或突变型3′非翻译区 (3′UTR) 的300个碱基对。结合位点的序列由ACATTCC突变为ATAATGC。 其中,G6PD-M1为突变miR-206与G6PD的第1个结合位点,G6PD-M2为突变miR-206与G6PD的第2个结合位点,G6PD-M3为突变miR-206与G6PD的第3个结合位点,G6PD-M4是将miR-206与G6PD的3个结合位点全部突变。293T细胞接种到24孔板中,转染后48小时使用双荧光素酶分析试剂盒(Promega,Madison,WI,USA)进行荧光测定。

2 结果
2.1 miR-206候选靶基因预测使用DNAMAN8.0对不同物种miR-206的序列进行比对,结果表明,miR-206在人、小鼠与猪等3个物种间序列非常保守,3个物种miR-206成熟序列主要来源于前体序列的3′端,在3个物种的成熟体序列中,人与小鼠的完全一致,猪与人、小鼠的序列仅最后1个碱基存在差异(图1A)。通过Targetscan对miR-206的新靶基因进行预测,并选择与miR-206种子序列至少有7个碱基的结合,且结合处序列在人、小鼠与猪等3个物种间完全保守的基因作为候选靶基因,最终确定了6个基因作为miR-206调控肌纤维形成的关键候选靶基因,包括FNDC3B基因、G6PD基因、Notch3基因、PDCD4基因、Smyd4基因与TNPO2基因。
由于不同类型肌纤维的主要差异在于其能量代谢方式的不同[12],在该6个候选靶基因中,只有G6PD与能量代谢密切相关,因此我们接下来分析了miR-206与G6PD的结合特点,结果显示miR-206种子序列与猪G6PD在3′UTR区存在3个结合位点(图1B)。其次,利用RNAHybrid软件对miR-206与G6PD结合的结构稳定性进行了预测,最小自由能(mfe)分析结果显示,miR-206与G6PD的3′UTR结合形成二聚体后最小自由能的绝对值大于83.736×103J/mol(图1C)。
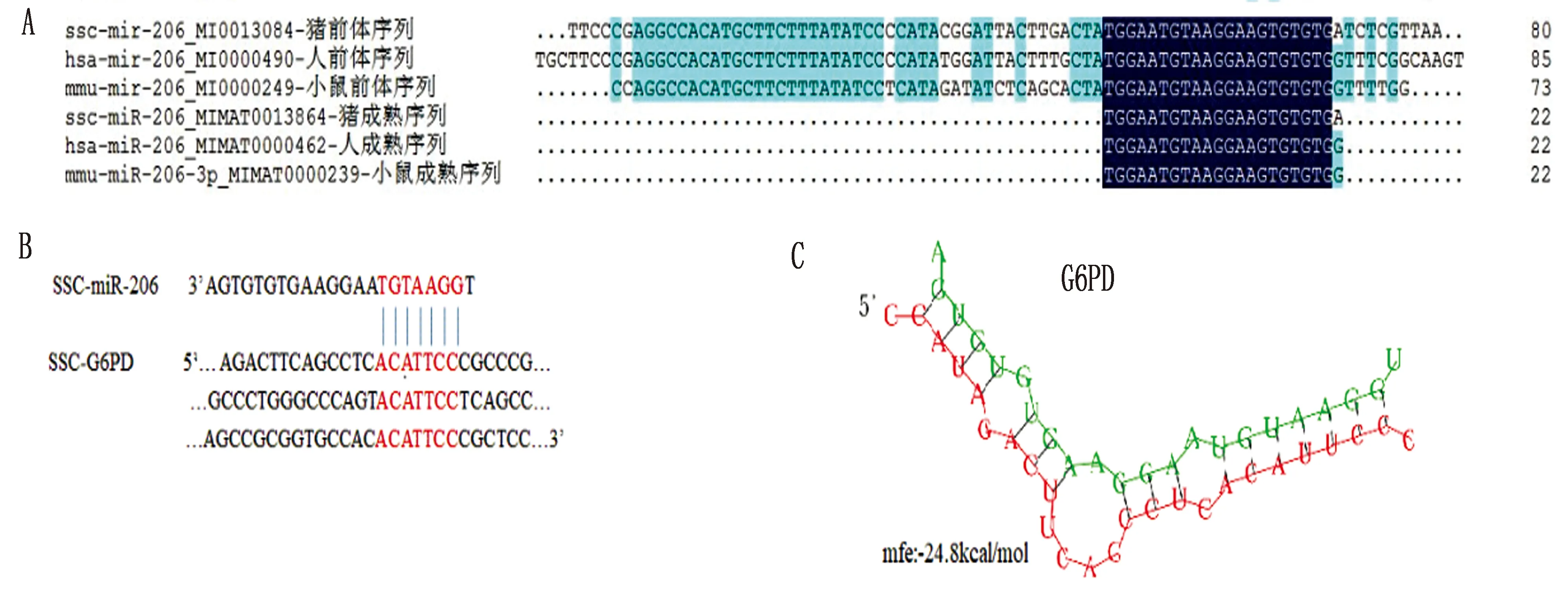
图1 miR-206候选靶基因预测 A.人、猪及小鼠中miR-206前体及成熟序列对比分析;B.猪中miR-206与G6PD位点结合分析;C.猪miR-206与G6PD结合后最小自由能分析
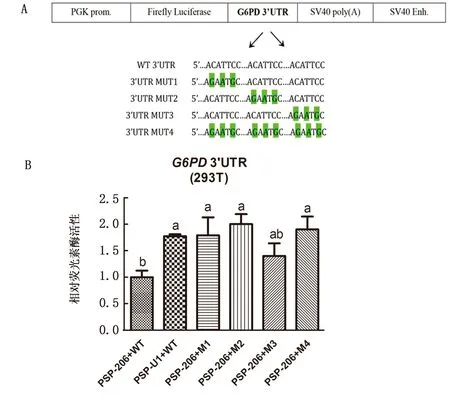
图2 G6PD是miR-206的靶基因 1.A为猪野生型及突变型G6PD双荧光酶报告基因载体构建图;2.B为miR-206与G6PD双荧光素酶验证分析;3.字母相同表示差异不显著(P>0.05),字母不同表示差异显著(P<0.05)
2.2 miR-206靶向G6PD为验证miR-206是否参与调控G6PD,以及miR-206与G6PD间3个结合位点是否具有调控效果,在构建野生型G6PD双荧光素酶报告基因载体的同时,构建3个结合位点依次突变的突变型载体MUT1、MUT2和MUT3,以及3个位点全部突变的突变型载体MUT4(图2A),将 miR-206过表达载体与野生型、突变型G6PD质粒共转染后检测293T细胞内双荧光素酶活性,结果如图2B所示,与对照组相比(PSP-U1),miR-206过表达质粒和野生型G6PD共转染进293T细胞后显著降低了G6PD载体的双荧光素酶活性(P<0.05),即miR-206下调G6PD的表达;与miR-206和野生型G6PD质粒的共转染相比,miR-206与G6PD的M1、M2及M4质粒共转染后显著地提高了G6PD双荧光酶报告基因载体的荧光活性(P<0.05),但miR-206与G6PD的M3质粒共转染后G6PD双荧光酶报告基因载体的荧光活性无显著差异(P>0.05),即突变了第1、第2以及全部结合位点后,miR-206对G6PD表达的抑制效果减弱,但突变第3个结合位点后miR-206对G6PD表达的抑制效果未发生显著变化,这说明miR-206通过前2个结合位点调控G6PD的表达,两者的第3个结合位点属于无效位点。
2.3 miR-206在猪的不同组织和肌肉中表达模式分析检测miR-206在猪的不同组织中表达水平,结果显示miR-206在猪的心脏、肝脏、脾脏、肺脏、肾脏、胃及脂肪组织中均不表达,而只在背最长肌中特异性表达(图3A)。分离猪的不同肌纤维类型的骨骼肌,包括2种慢肌肌肉—咬肌、比目鱼肌,以及2种快肌肌肉—背最长肌和股二头肌,并利用qRT-PCR检测快慢肌纤维标志基因MyHC-1,MyHC-2b及Myob的表达水平,结果显示在以慢肌纤维为主的咬肌和比目鱼肌中,慢肌纤维标志基因MyHC-1和Myob的表达水平普遍高于以快肌纤维为主的背最长肌和股二头肌,而快肌纤维标志基因MyHC-2b的表达水平则普遍低于以快肌纤维为主的背最长肌和股二头肌(图2B~D),以上结果表明,咬肌和比目鱼肌是典型的慢肌,背最长肌和股二头肌则为快肌。
通过对以上4种肌肉中miR-206表达水平的检测,结果显示miR-206在咬肌中的表达水平极显著高于其在背最长肌和股二头肌中的表达量(P<0.01),在比目鱼肌中的表达水平显著高于其在背最长肌和股二头肌中的表达水平(P<0.05)(图3E),即miR-206在慢肌中的表达水平显著高于快肌。
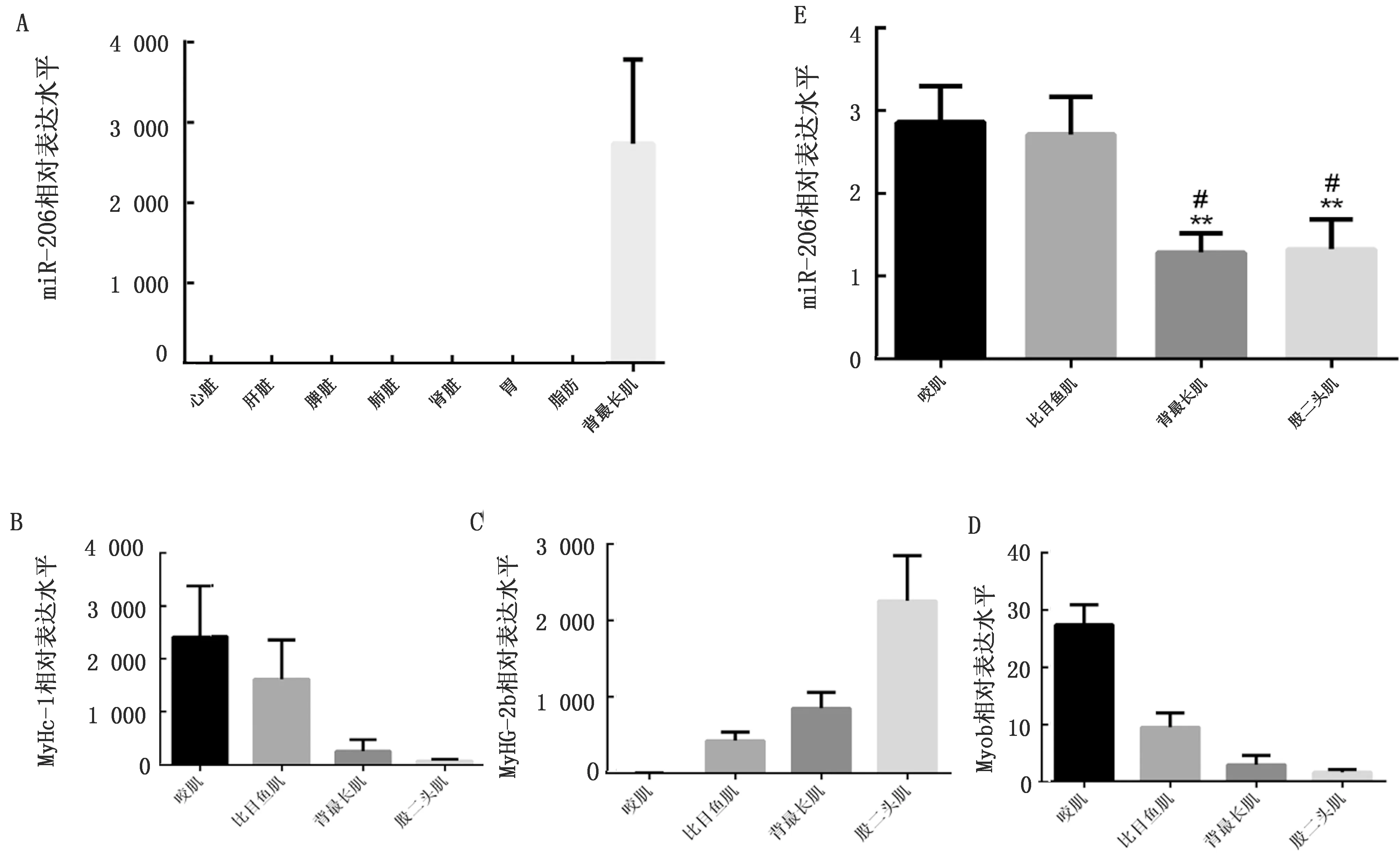
图3 猪miR-206不同组织及骨骼肌中表达模式分析 1.A为miR-206在猪的不同组织中的表达模式;2.B~D为MyHC-1,MyHC-2b及Myob在不同肌纤维类型肌肉中的表达鉴定;3.E为miR-206在不同肌纤维类型肌肉中的表达模式;4.*表示与咬肌相比存在显著差异(P<0.05),**表示与咬肌相比存在极显著差异(P< 0.01),#表示与比目鱼肌相比存在显著差异
2.4 G6PD在猪的不同组织和肌肉中表达模式分析qRT-PCR检测G6PD在猪的不同组织及骨骼肌中的表达模式,结果显示G6PD在猪脂肪组织中表达量普遍高于其在其他组织中的表达量,除心脏外,在背最长肌中表达最低,但其在咬肌和比目鱼肌中的表达量与其在背最长肌和股二头肌中的表达量无显著差异(P>0.05)(图4)。
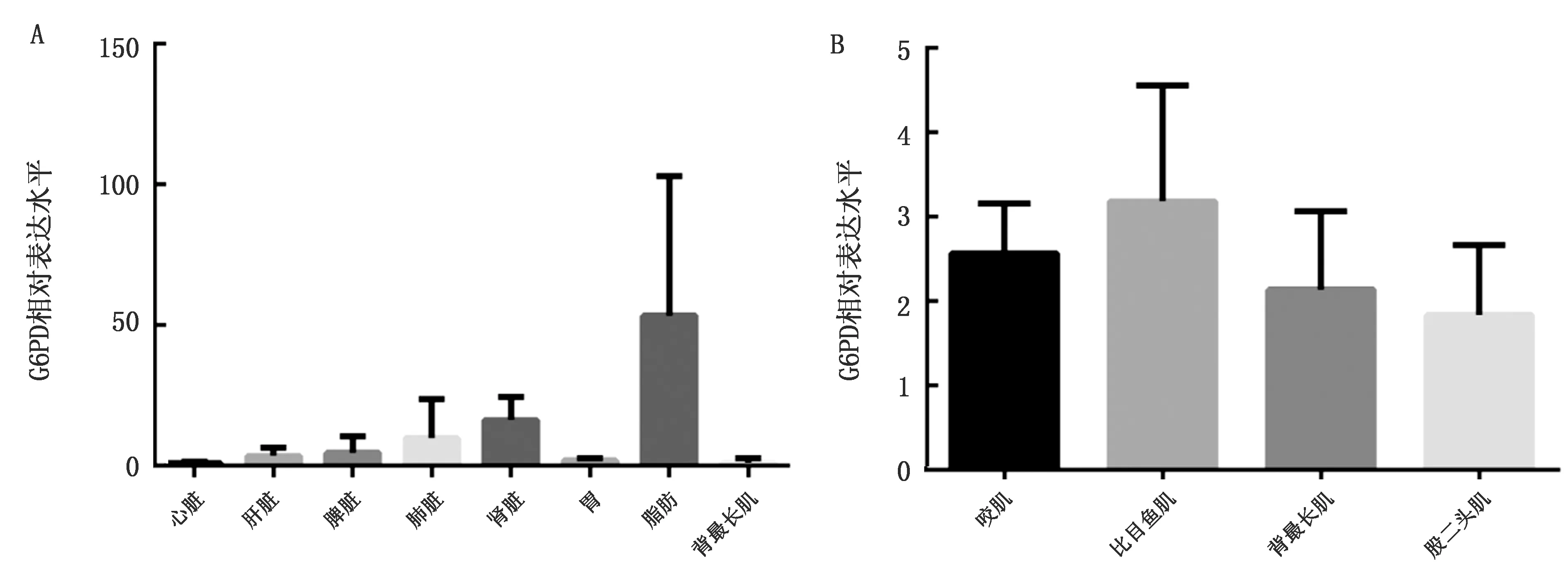
图4 猪G6PD不同组织及骨骼肌中表达模式分析 A.G6PD在猪不同组织中的表达模式;B.G6PD在猪不同骨骼肌中的表达模式
2.5 miR-206和G6PD在高低组肌内脂肪中表达模式分析鉴于G6PD在脂肪组织中的高表达,且BONNET等[16]的研究表明G6PD与肌内脂肪含量密切相关,因此我们使用qRT-PCR检测miR-206和G6PD在猪高、低组肌内脂肪中的表达模式,结果显示miR-206在高组、低组肌内脂肪中的表达水平无显著差异(P>0.05),而G6PD在肌内脂肪含量高的样品中表达水平略高于肌内脂肪含量低的样品,但也未到达显著差异(P>0.05)(图5)。
图5 miR-206和G6PD在高低组肌内脂肪中表达水平 A.miR-206在高低组肌内脂肪中的表达水平;B.G6PD在高低组肌内脂肪中的表达水平
3 讨论
杨飞云等[17]的研究表明,慢肌纤维含量高的肌肉瘦肉率高、脂肪沉积少、肉质肥美,而快肌纤维和慢肌纤维的不同除体现在颜色、收缩特点外,还有能量代谢的差异,慢肌主要进行有氧呼吸,而快肌主要进行无氧呼吸。G6PD是磷酸戊糖途径(PPP)中的第1个关键酶,它能催化6-磷酸葡萄糖(glucose hexaphosphate)脱氢,形成6-磷酸葡萄糖酸(6-phosphogluconic acid,6PG)。因此,在miR-206预测的6个靶基因中,我们选择G6PD作为miR-206的候选靶基因,并使用肉色差异最明显的3头个体猪,检测G6PD在不同类型肌肉中的表达水平。
mfe分析方法在许多miRNA验证靶基因的过程中被使用,是辅助验证靶基因的方法之一,通常认为,最小自由能的绝对值越高,则结合越稳定。miRNA与靶基因结合后形成的二聚体结构,其mfe的绝对值大于83.736×103J/mol时,该靶基因才能用于后续分析。我们发现miR-206与G6PD的mfe为-103.833 J/mol,说明两者之间结合稳定,G6PD可作为miR-206的候选靶基因进行研究。miR-206的转染可显著降低野生型G6PD的荧光活性,这说明miR-206能下调G6PD的表达,但与野生型G6PD相比,第1、第2个结合位点的突变能显著提高G6PD报告基因载体的荧光活性,而只有第3个结合位点突变后不能改变G6PD的荧光活性,因此,miR-206可以通过前2个结合位点调控G6PD的表达,而第3位点则不起调控作用。miR-206在骨骼肌组织中特异表达,而G6PD在骨骼肌组织中表达量处于较低水平,两者相反的表达模式进一步证明了G6PD是miR-206的靶基因。
通过对快慢肌纤维标志基因的检测,我们确定咬肌和比目鱼肌是慢肌,背最长肌和股二头肌是快肌,即使用以上4种肌肉对快慢肌纤维的差异基因进行检测是可靠的。尽管在猪的骨骼肌中,miR-206可以调控G6PD,且miR-206的表达量在快肌和慢肌中也存在显著差异,但G6PD的表达在快慢肌中却无显著差异,这说明G6PD不是miR-206调控肌纤维类型的候选基因。研究发现,G6PD与不同品种猪的大理石花纹有关,且我们的试验结果也表明G6PD在脂肪组织中表达最高,为进一步研究在猪骨骼肌中miR-206调控G6PD所引起的生物学效应,我们检测了高肌内脂肪含量组和低肌内脂肪含量组中miR-206与G6PD的表达水平,结果表明miR-206与G6PD在高低组肌内脂肪中均无显著差异,即miR-206和G6PD与猪骨骼肌中肌内脂肪含量的高低无关,因此G6PD在骨骼肌中的功能,以及miR-206调控骨骼肌纤维的靶基因仍需进一步研究。
miR-206在不同物种间高度保守,且在骨骼肌组织中特异表达。G6PD是miR-206的靶基因,尽管miR-206通过前2个结合位点下调G6PD表达,但G6PD不能影响肌纤维类型的转化和脂肪沉积。
