猪德尔塔冠状病毒变异株CHN-GX01-2018株全基因序列分析
2020-05-18张世亨黄海鑫尹彦文施开创孙文超鲁会军金宁一
张世亨,黄海鑫,尹彦文,施开创,郑 敏,汪 伟,4,曹 亮,孙文超,鲁会军 *,金宁一*
(1.温州大学 病毒学研究所,浙江 温州 325035; 2.吉林农业大学 动物科学技术学院,吉林 长春,130118; 3.广西壮族自治区动物疫病预防控制中心,广西 南宁 530001;4.军事医学研究院 军事兽医研究所,吉林 长春 130122)
猪德尔塔冠状病毒(porcine deltacoronavirus,PDCoV)是国内新发现的一种致病性肠道冠状病毒,该病毒主要经消化道感染,进而侵害猪的小肠,特别是空肠与回肠,发病突然,传播迅速[1]。PDCoV可引起5~15日龄的哺乳仔猪发生腹泻和呕吐、迅速脱水、衰竭而死亡,死亡率高达 50%~80%[2]。与猪传染性胃肠炎病毒(TGEV)和猪流行性腹泻病毒(PEDV)比较,PDCoV感染引起的仔猪表现出腹泻症状轻微和死亡率低[3-4]。
PDCoV为有囊膜的单股正链RNA病毒,该病毒属于冠状病毒科(Coronaviridae),冠状病毒亚科(Coronavirinae),德尔塔冠状病毒属(Deltacoronavirus)成员,基因结构与PEDV相似,约为25.4 kb[5]。PDCoV基因结构包含5′和3′非翻译区及至少7个开放性阅读框,分别编码多聚酶蛋白 (polymerase protein)1a/1b、纤突(spike,S)蛋白、小膜(envelope,E)蛋白、膜(Membrane,M)蛋白、核衣壳(Nucleocapsid,N)蛋白、非结构蛋白6(nonstructural protein 6,NS6)及非结构蛋白7(nonstructuralprotein 7,NS7)[6]。其中,S蛋白在PDCoV与受体的识别、结合、融合和侵入宿主细胞等方面起到重要的作用;并能诱导机体产生针对该病原的中和抗体[7-9]。
该病毒于2012年在中国香港被首次报道,随后该病原在美国、韩国、中国、泰国也相继被报道[5,10-11]。本试验从中国广西地区PDCoV阳性样品中扩增1株PDCoV的全基因组序列,分析其进化关系及其核苷酸同源性,为下一步的PDCoV病毒的致病基因及遗传进化的研究提供参考。
1 材料与方法
1.1 样品来源2018年由广西壮族自治区动物疾控中心采集发病仔猪腹泻小肠内容物及粪便,将样品储存在-80℃。
1.2 试剂、菌株和载体UNIQ-10柱式Trizol RNA提取试剂盒购自生工生物工程(上海)股份有限公司;TaKaRa RNA PCR Kit(AMV) Ver.3.0试剂盒购自宝生物工程(大连)有限公司;
2×Vazyme LAmp Master Mix (Dye Plus)购自诺唯赞生物科技有限公司;限制性内切酶购于NEB有限公司;感受态细胞购自天根科技有限公司。
1.3 病料检测利用针对PDCoV基因的特异性检测引物F1:5′-ACCAACCAACACCGTCCTTTA -3′和R1:5′-AGAACCACGAGACTGTAAGCA -3′,进行PCR扩增,预期扩增片段长度1 100 bp。
1.4 引物的设计与合成根据GenBank中登录的PDCoV CHN-AH-2004株基因序列(登录号:KP757890.1),针对全基因分别设计25对特异性引物,引物序列见表1。

表1 用于扩增PDCoV基因组的引物
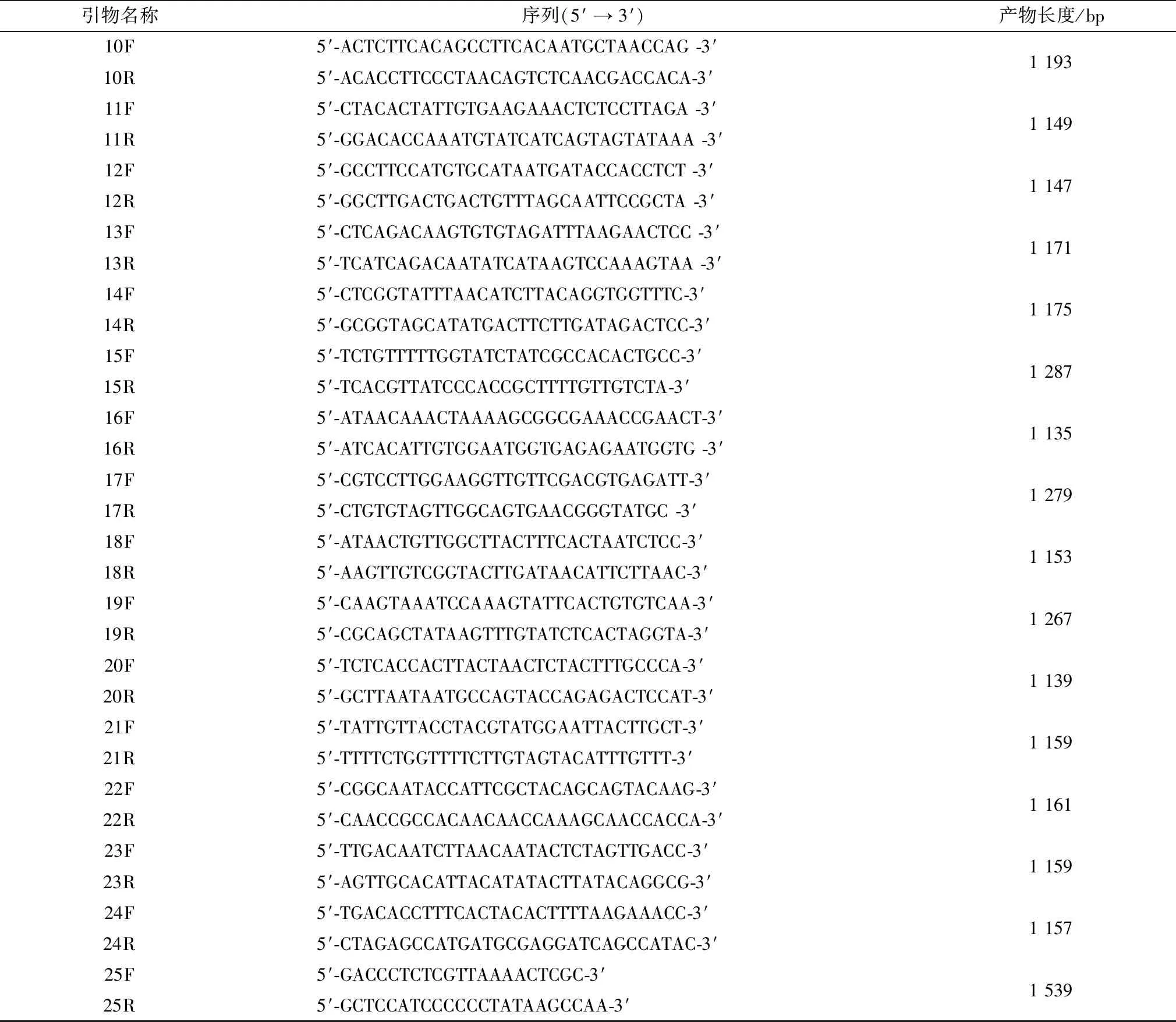
续表1
1.5 PDCoV 全基因克隆及序列分析
1.5.1样本处理及RNA提取 取PDCoV阳性病料,按照UNIQ-10柱式Trizol RNA提取试剂盒说明书抽提PDCoV阳性病料RNA,将所得RNA溶液放于-80℃冰箱保存备用。
1.5.2PDCoV 全基因克隆鉴定 以提取的RNA为模板,进行RT-PCR扩增。PCR反应体系25 μL:模板1 μL,上、下游引物各2 μL,2×Vazyme LAmp Master Mix 12.5 μL,ddH2O 7.5 μL。RT-PCR反应条件:50℃反转录30 min;98℃预变性2 min;98℃变性10 s,60~65℃退火30 s,72℃延伸1 min,共35个循环;72℃延伸10 min。
1.5.3PDCoV重组质粒构建与鉴定 将RT-PCR扩增产物与载体连接,鉴定为阳性的产物送生工生物工程(上海)股份有限公司进行序列测定。将全基因与GenBank PDCoV流行毒株进行序列比较分析。
2 结果
2.1 PDCoV 全基因的RT-PCR 扩增结果利用检测引物F1/R1临床病料进行RT-PCR检测,结果2018年从广西各地4个猪场采集的10份疑似组织病料中检出PDCoV阳性1份(图1)。
2.2 PDCoV 全基因的鉴定与测序结果目的片段与载体连接,对所得质粒进行酶切鉴定。选取2018年采集的1份阳性病料,利用25对特异性测序引物分段扩增病毒基因。回收PCR目的产物,经测序和拼接,获得全长为25 407 bp的病毒全基因组序列,并命名为CHN-GX01-2018,GenBank 登录号为MK359104。
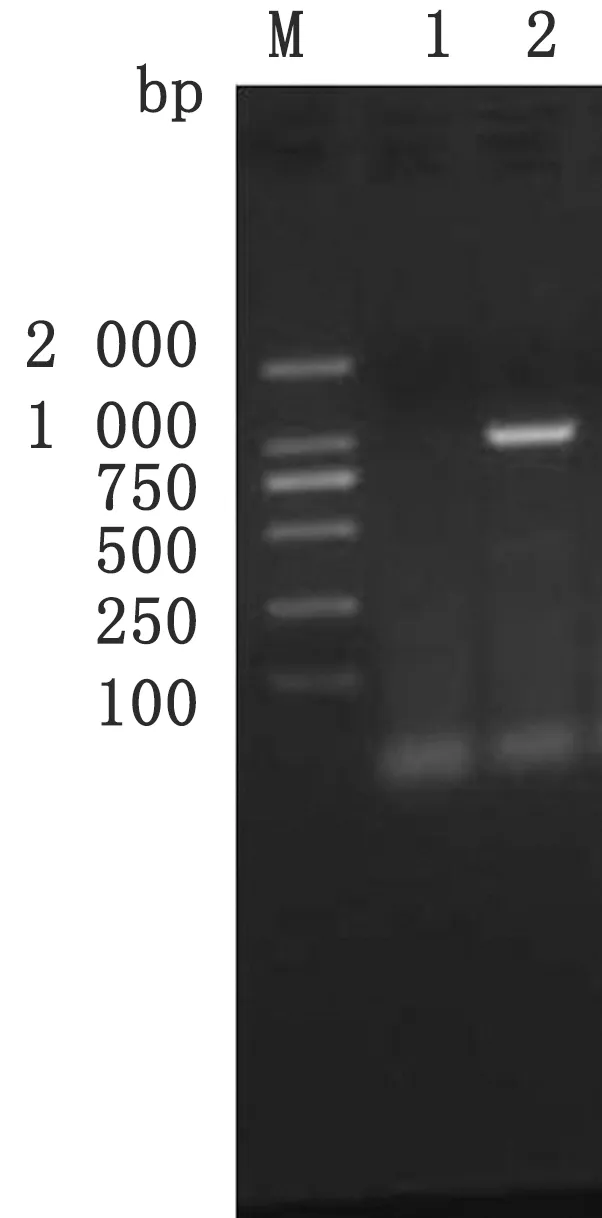
图1 猪腹泻病料PDCoV RT-PCR 检测结果 M.DNA分子质量标准;1.阳性对照;2.阴性对照
2.3 PDCoV全基因的序列分析本研究中获得CHN-GX01-2018全基因全长为25 406 bp。基因结构包含1个539 bp 5′UTR,ORF1a在第540~11 399 bp 位置,ORF1b在11 399~19 327 bp,S基因大小为3 480 nt(19 309~22 788 bp),E基因大小为252 bp (22 782~23 033 bp),M基因大小为654 bp(23 026~23 679 bp),NS6大小为285 bp(23 679~23 963 bp),N基因大小为1 029 bp(23 984~25 012 bp),NS7基因大小为603 bp(24 078~24 680 bp)和3′UTR 大小395 bp。
ORF1a/1b编码2个多聚蛋白pp1a和pp1ab,主要是与病毒复制转录有关的蛋白酶。本研究发现 CHN-GX01-2018株与美国8734-USA-IA-2014株及部分中国CHN-AH-2004株比较在其第400~402位置存在3个氨基酸缺失(图2),第756~759位置存在4个氨基酸缺失(图3)。S基因编码的S蛋白是存在于 PDCoV表面上最大的蛋白,S蛋白中都存在 Spike 切割位点(RRSRR),随后被切割产生2个的蛋白 S1 和 S2。本研究发现 CHN-GX01-2018株与大部分中国毒株一样存在第52位氨基酸缺失(图4),表明中国毒株与美国流行毒株存在差异,表明该类型毒株已经成为中国PDCoV的优势毒株。然而研究发现CH/jiangsu/2014毒株与美国流行毒株在S基因第52位置保持一致,表明国内PDCoV毒株在不同地域可能存在一定的差异性。
2.4 PDCoV全基因组、S和N基因的同源性分析全基因组同源性分析表明,CHN-GX01-2018株与中国国内代表毒株安徽CHN-AH-2004株、广东GD株、湖南CH-Hunan-2014株、山东SD株、江苏CH-Jiangsu-2014株、四川CH-Sichuan-S27-2012株、河北CHN-HB-2014株核苷酸同源性为98.0%~98.8%;CHN-GX01-2018株与美国8734-USA-IA-2014株同源性为98.2%;与东亚韩国KNU14-04株、日本YMG-JPN-2014株核苷酸同源性为98.0%~98.2%;与东南亚的越南Vietnam-Binh21-2015株、老挝BTL_0115-PDCoV-2016-Lao株、泰国Thailand-S5015L-2015株核苷酸同源性分别为97.7%~98.1%。
在结构蛋白中,PDCoV变异较大,大小为3 480~3 483 个碱基,并且S蛋白表面具有抗原决定簇,决定病毒毒力,且能与病毒的特异性受体结合,促进细胞膜的融合,是PDCoV主要的保护性抗原蛋白,因此成为研究的重点。CHN-GX01-2018株与国内代表毒株安徽CHN-AH-2004株、广东GD株、湖南CH-Hunan-2014株、山东SD株、江苏CH-Jiangsu-2014株、四川CH-Sichuan-S27-2012株、河北CHN-HB-2014株核苷酸同源性分别为97.4%,97.6%,98.0%,98.2%,97.8%,98.4%和98.2%;CHN-GX01-2018株与国外代表毒株美国8734-USA-IA-2014株、韩国KNU14-04株、日本YMG-JPN-2014株、越南Vietnam-Binh21-2015株、老挝BTL_0115-PDCoV-2016-Lao株、泰国Thailand-S5015L-2015株核苷酸同源性分别为97.9%,97.9%,97.9%,96.4%,96.2%和96.0%。
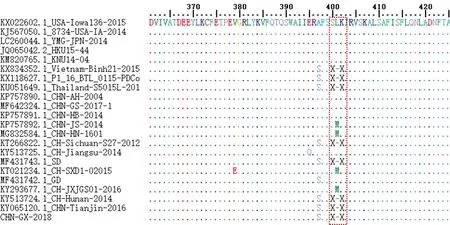
图2 PDCoV ORF1a/1b 第400~403位氨基酸分析

图3 PDCoV ORF1a/1b 第756~759位氨基酸分析

图4 PDCoV S基因氨基酸分析
在结构蛋白中,N蛋白相对保守,并且是PDCoV主要的保护性抗原蛋白。CHN-GX01-2018株与国内代表毒株安徽CHN-AH-2004株、广东GD株、湖南CH-Hunan-2014株、山东SD株、江苏CH-Jiangsu-2014株、四川CH-Sichuan-S27-2012株、河北CHN-HB-2014株核苷酸同源性分别为98.0%,98.0%,98.7%,98.2%,98.1%,98.8%和98.8%;CHN-GX01-2018株与国外代表毒株美国8734-USA-IA-2014株、韩国KNU14-04株、日本YMG-JPN-2014株、越南Vietnam-Binh21-2015株、老挝BTL_0115-PDCoV-2016-Lao株、泰国Thailand-S5015L-2015株核苷酸同源性分别为98.5%,98.7%,98.4%,98.5%,97.9%和97.6%。对CHN-GX01-2018株全基因组、S基因和N基因同源性分析表明,当前PDCoV流行毒株出现较大的遗传变异。
2.5 PDCoV 全基因的系统进化树分析基于病毒全基因组(图5)以及S基因(图6)、N基因(图7)核苷酸序列绘制遗传进化树。全基因组以及S基因进化分析表明,东南亚地区毒株越南Vietnam-Binh21-2015株、老挝BTL_0115-PDCoV-2016-Lao株、泰国Thailand-S5015L-2015株处于同一进化分支,亲缘关系较近。美国8734-USA-IA-2014株、韩国KNU14-04株、日本YMG-JPN-2014株毒株处于同一进化分支。而CHN-GX01-2018株与四川CH-Sichuan-S27-2012株同源关系较近。研究发现中国PDCoV毒株的安徽CHN-AH-2004株、广东GD株、湖南CH-Hunan-2014株、山东SD株、江苏CH-Jiangsu-2014株、四川CH-Sichuan-S27-2012株、河北CHN-HB-2014株等参考毒株处于不同进化分支,推测它们可能有不同的来源,也提示我们当前中国PDCoV毒株正处于不断进化状态。N基因与S基因核苷酸序列进化树呈现不一致性,提示PDCoV不同结构蛋白进化速率也呈现不一致性。
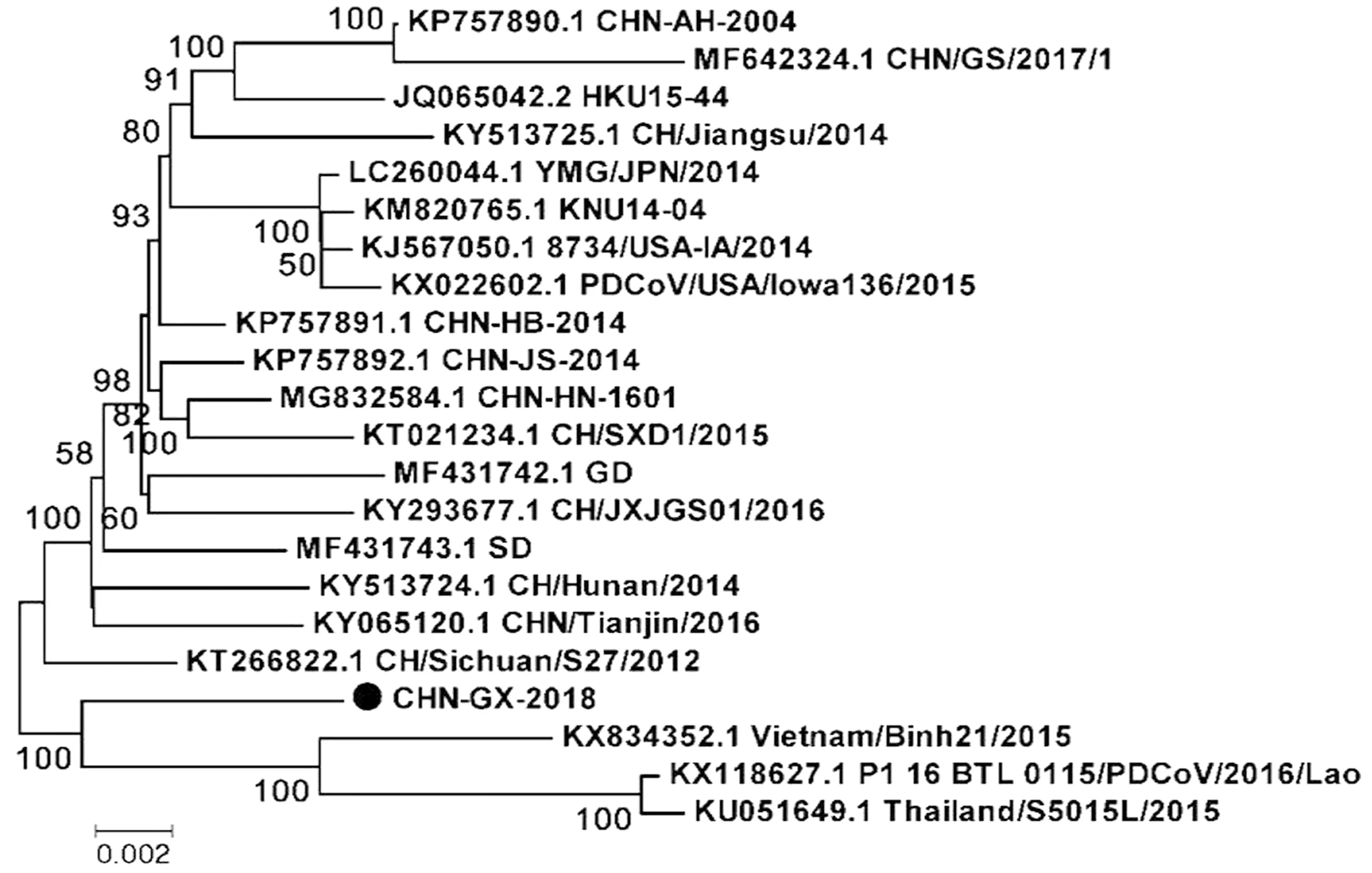
图5 PDCoV全长进化分析

图6 PDCoV S基因遗传进化分析
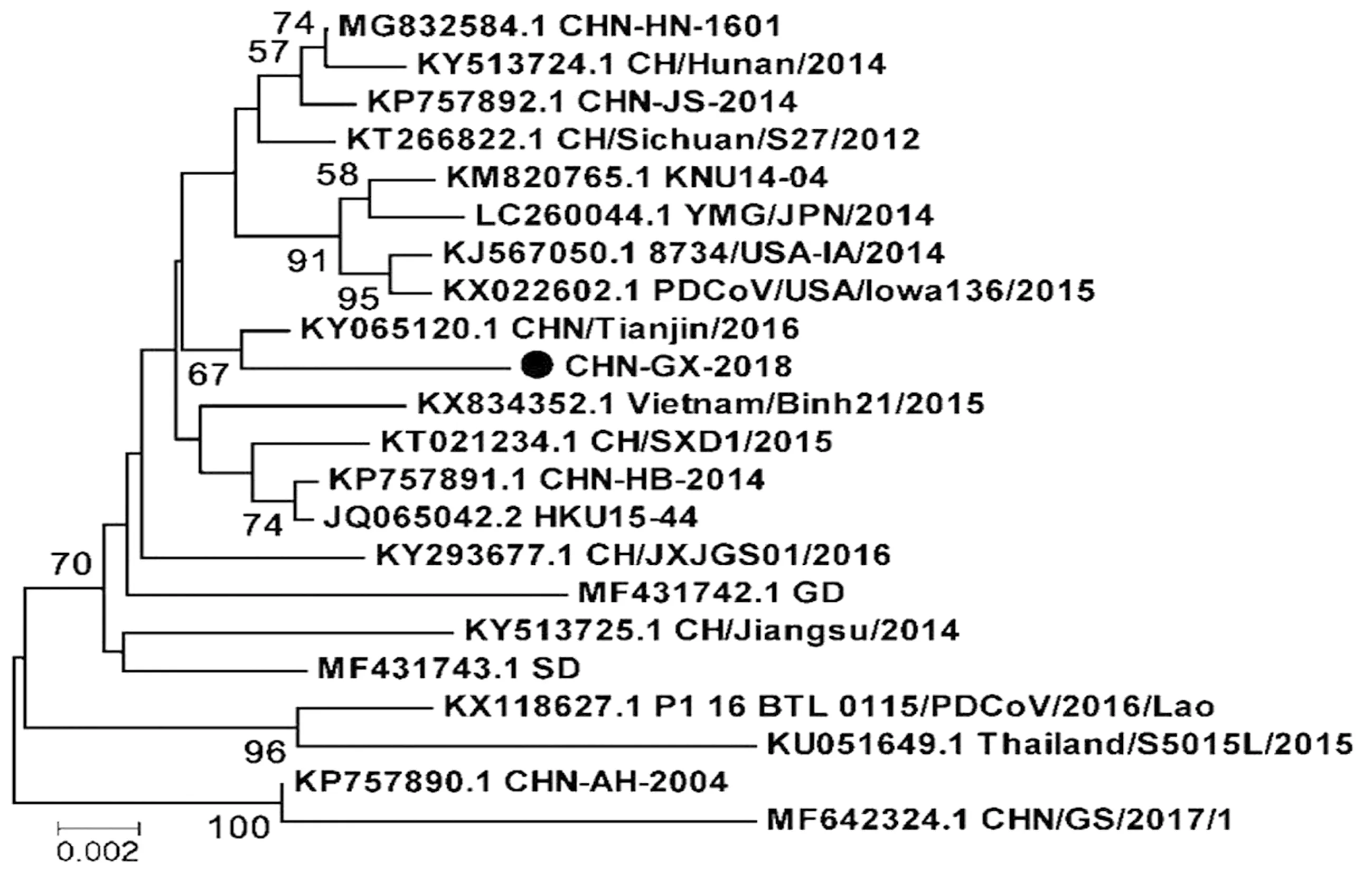
图7 PDCoV N基因遗传进化分析
3 讨论
2012年在中国香港首次发现PDCoV,直到2014年在美国腹泻仔猪中首次成功分离,并证明其致病性[4]。2014年至今,中国大陆对 PDCoV 流行报道日趋增多,国内多所大学的科研团队开展PDCoV的研究。DONG等[2]2013-2014年首次证实PDCoV 在中国猪场中存在,阳性率为14.3%。
JANETANAKIT等[12]报道,在泰国东部省份养猪场暴发母猪急性水样腹泻,食欲不振和无乳症,仔猪发热、水样腹泻和严重的脱水,母猪死亡率为27.63%(829/3 000),仔猪占64.27%(2 892/4 500)。腹泻样品经检测为PDCoV感染,2株PDCoV的序列与中国安徽株同源性98.43%。SUZUKI等[13]研究发现,日本PDCoV毒株全基因组与美国、韩国毒株同源性为99.7%~100%,与中国毒株(包括香港毒株)同源性为98.6%~99.3%,与泰国、越南和老挝毒株同源性为97.4%~97.8%。
针对PDCoV病原学、流行病学、致病性、培养与检测等陆续研究已经展开。华中农业大学肖少波团队等开展PDCoV病毒分离、致病性、受体等研究工作,证实在5日龄和21日龄仔猪中证实CHN-HN-2014的致病性,分别研究NS6、Nsp5在病毒复制及与宿主相互作用[14-16]。据报道,在开展PDCoV NH 株的分离及其致病性的研究中发现pAPN受体在病毒感染中的作用[17-18]。据报道,PDCoV受体及开展病毒致病机制试验,证实PDCoV侵染LLC-PK1细胞时诱导细胞自噬[19]。
S蛋白的变异会导致PDCoV毒力、组织细胞的培养及宿主范围发生改变。然而目前对S蛋白氨基酸缺失对PDCoV毒力改变,是否会造成强弱毒株的改变目前还没有定论。S基因常被作为PDCoV变异的标志,揭示PDCoV病毒进化的特征,本研究通过对地方流行株的S基因进行序列分析,可及时了解当地流行株的变化趋势。同源性分析表明,CHN-GX01-2018株S基因序列与所有PDCoV毒株核苷酸同源性>96%。遗传进化分析表明,CHN-GX01-2018株与四川CH-Sichuan-S27-2012株,同源性较近,可能存在从同一祖先进化而来。CHN-GX01-2018株S、N基因的遗传进化分析不一致,表明PDCoV各结构基因进化速率存在不一致性。
总之,我们的研究结果丰富了PDCoV在中国的流行病学数据。PDCoV作为一种新出现的冠状病毒,其在中国及世界各地的爆发频率日渐增加。然而,PDCoV的流行病学和病毒演化规律、发病机制,对公共卫生健康的影响等仍然知之甚少,有必要加强中国猪群的流行病学调查,并探索其致病机理。
