猪细小病毒7型广西分离株全基因组序列分析
2020-05-18孙文超田明尧郭丹丹刘云霞钱爱东鲁会军金宁一
曹 亮,孙文超,汪 伟,田明尧,郭丹丹,刘云霞,郑 敏,钱爱东,鲁会军*,金宁一,*
(1.吉林农业大学 动物科学技术学院,吉林 长春 130118; 2.军事科学院 军事兽医研究所,吉林 长春 130122;3.温州大学 病毒学研究所,浙江 温州 325035; 4.广西大学 动物科学技术学院,广西 南宁530004;5.广西动物疫病预防控制中心,广西 南宁530001)
猪细小病毒(porcine parvovirus,PPV)为无囊膜的单链DNA病毒[1-2]。该病毒于1965年在德国被首次检测到,并确定是造成怀孕母猪产死胎、木乃伊胎及胚胎早期死亡,造成猪生殖障碍的主要原因[3-5]。近10年间,陆续发现不同基因型猪细小病毒PPV2~PPV6。2016年,美国首次检测到新的细小病毒基因型PPV7[6]。这些细小病毒在分类学上共分为4个属,其中PPV1属于Protoparvovirus属,PPV2与PPV3属于Tetraparvovirus属,PPV4~PPV6属于Copiparvovirus属,而PPV7属于Chapparvovirus属[6-7]。尽管近年来年陆续发现PPV2-PPV7不同基因型的细小病毒,同时也证实它们在猪群中的感染相当普遍,但是由于缺少相关临床报道及感染的无明显症状,以致它们所引起的临床症状仍不清楚。
猪圆环病毒2型(porcine circovirus 2)属于圆环病毒科圆环病毒属,是引起断奶仔猪多系统衰竭综合征(postweaning multisystemic wasting syndrome,PMWS)的主要病原之一。研究表明,PPV可与PCV2协同致病[8]。为了进一步了解PPV7在猪群中的流行情况及是否与PCV2共感染,本试验对2017年广西部分地区PPV7流行及与PCV2共感染作为流行病学调查内容。
1 材料与方法
1.1 样品采集样品为2017年采集于广西南宁、博白、玉林、东兴等城市的健康及患病猪共计247份样品,包括血液及内脏组织器官(肺、脾、肝、肾及腹股沟淋巴结)样品。
1.2 主要试剂和仪器大肠杆菌Trans5α、平末端连接载体pEASYR-Bluent Zero Cloning Kit,E.coliDH5α购自于北京全式金生物公司;2×pfu Master Mix(Dye)购自于江苏康维生物有限公司;血液/细胞/组织DNA提取试剂盒购自于天根生物技术有限公司;胶回收试剂盒购自于杭州博日科技有限公司;TS系列多样品组织研磨机购自于上海净信实业发展有限公司。
1.3 病毒DNA的提取将采集猪组织样品置于2 mL EP管内,并加入1 mL PBS(pH7.4)缓冲液后置于组织振荡器内,70 Hz频率振荡研磨10 min。将研磨好的样品于-20℃冰箱冻融3次,取出200 μL样品参照血液/细胞/病毒基因组DNA提取试剂盒操作提取总DNA,置于-20℃冰箱贮存。
1.4 引物设计及合成参照GenBank登录的PPV7及PCV2全基因组序列,应用MEGA 7.0软件进行分析,筛选出高度保守的核苷酸区域,利用Primer 5.0软件设计合成用于扩增PPV7全基因组引物及PCV2检测引物(表1),并将引物序列由吉林库美生物技术公司合成。
1.5 PCR检测利用提取的组织和血液DNA,采用引物进行PCR扩增,检测感染情况,PCR反应体系为25 μL:2×pfu Master Mix(Dye) 12.5 μL,每组各0.5 μL(20 μmol/ L),基因组模板1 μL,无菌去离子水补足。反应条件:预变性94℃、5 min,变性94℃、30 s,退火30 s,退火温度和延伸时间按照表1进行,35个循环后72℃、10 min。产物经1%琼脂糖凝胶电泳鉴定,并按照胶回收试剂盒说明纯化。
1.6 基因克隆回收纯化后连接pEASYR-Bluent Zero Cloning Kit载体,并转化至Trans5α,涂布在含有氨苄青霉素的LB平皿培养12 h。挑取单菌落至含氨苄青霉素的LB液体培养基中,37℃、220 r/min振荡培养12 h后少量提取质粒送吉林省库美生物有限公司测序。
1.7 序列分析应用MEGA7.0软件将测序结果与GenBank中登录的PPV7参考株序列进行遗传进化分析,并以LG+G+I算法1 000步展值生成系统进化树,分析基因分群。

表1 PPV7和PCV2基因扩增引物
2 结果
2.1 PPV7及PCV2感染情况PCR检测结果在采集的172份健康猪样品及75份患病猪样品中,PPV7感染率高达71.66%(177/247)(表2)。而在所有阳性样品中,有63份样品来自患病猪(63/75,84%),114份样品来自健康猪(114/172,66.2%)。在所采集的样品中PCV2感染率为86.6%,在247份样品中共有214份检测为PCV2阳性,其中65份阳性样品来自于患病猪(65/75,86.67%),149份样品来自于健康猪(149/172,86.62%)。在患病猪样品中PCV2与PPV7共感染率为77.33%(58/75),而健康猪两者共感染率为51.74(89/172)。
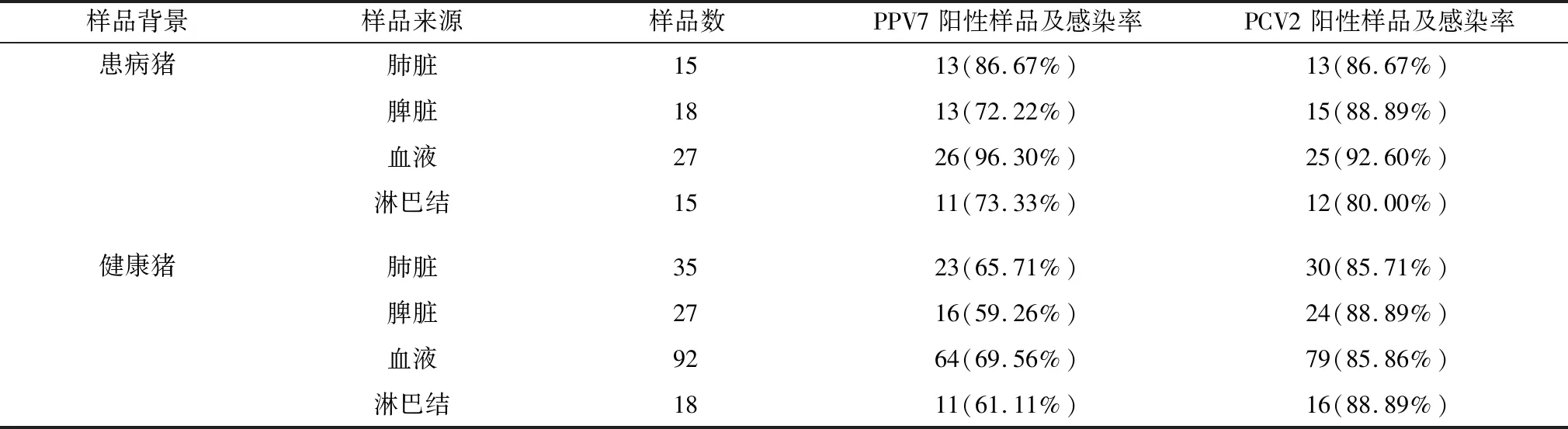
表2 样品来源及检测结果
2.2 PPV7基因同源性分析随机选取3株PPV7阳性样品进行主要结构基因组测序。结果显示PPV7基因组序列包含2个开放阅读框ORF1和ORF2,分别编码非结构蛋白NS1及Cap蛋白。3株PPV7全部编码区基因同源性为94.1%~99.6%,NS1基因同源性为96.0%~100%,cap基因同源性为93.9%~97.6%。通过与PPV7参考序列PPV7 42株分析,本试验3株PPV7其NS1基因序列同源性为94.9%~96.6%,cap基因序列同源性为89.6%~95.0%。与中国的3株PPV7分离株GD2014-1,GD2014-2及GD2014-3分析显示其NS1基因同源性为94.2%~97.6%,而cap基因同源性为87.4%~94.6%。结果显示无论与国外的PPV7参考株还是国内分离株比较,本试验所检测的PPV7其cap基因均存在较大差异。
2.3 PPV7cap基因序列分析通过对参考株及中国分离株序列分析显示,PPV7cap基因全长为1 410 nt或1 425 nt。而本试验发现的3株PPV7中,其cap基因长度为分别为1 425 nt,1 413 nt和1410 nt。本试验所测序的3株PPV7基因中,有2株在其cap基因中间增加3个或15个核苷酸序列(图1A)。
通过对4株参考株及3株分离株Cap蛋白氨基酸序列分析显示:本研究的PPV7其Cap蛋白在182~187位aa较参考株增加1个或5个氨基酸残基,以及在编码的氨基酸序列中存在2个变异区域(图1B):296~299aa及439~443aa。而PPV7 Cap蛋白氨基酸序列突变的发现可能对其遗传演变提供一定的参考价值。

图1 PPV7 cap基因核苷酸(A)及氨基酸序列(B)分析
2.4 PPV7遗传进化分析将所扩增的3株PPV7 NS1氨基酸序列与33株细小病毒科成员应用生物学软件MEGA7.0以最大似然法构建系统发育树,结果显示所扩增的3株PPV7与参考株均属于Chapparvovirus属(图2)。
3 讨论
20世纪60年代,通过对猪的流产、死胎病原学研究发现,猪细小病毒是引起这些临床症状的病原体之一。而后陆续在欧洲、美洲及亚洲等多国家均检测到该病原的存在[8]。目前,猪细小病毒感染存在与世界各大猪养殖场内,给养猪业带来巨大的损失。研究表明,PPV1在猪场的感染率为25.8%~71.88%,且PPV1与PCV2常以混合感染的形式存在[9]。PPV7于2016年在成年猪肠拭子中被首次检测到,且常与PPV2及PCV1混合感染。以往的研究显示,PPV7在美国养殖场采集的血液及肺脏样品中感染率为2.1% (2/95)和17.2% (5/29),在中国养殖场采集的血液样品感染率为65.5% (19/29)[6,10]。而本试验检测发现,PPV7在血液及肺脏样品中感染率显著高于以往的研究,这表明PPV7可能在广西猪养殖场有较高的感染率。由于本研究所采集的样品数量有限,对于PPV7实际的感染情况仍需更为详尽的调查研究。
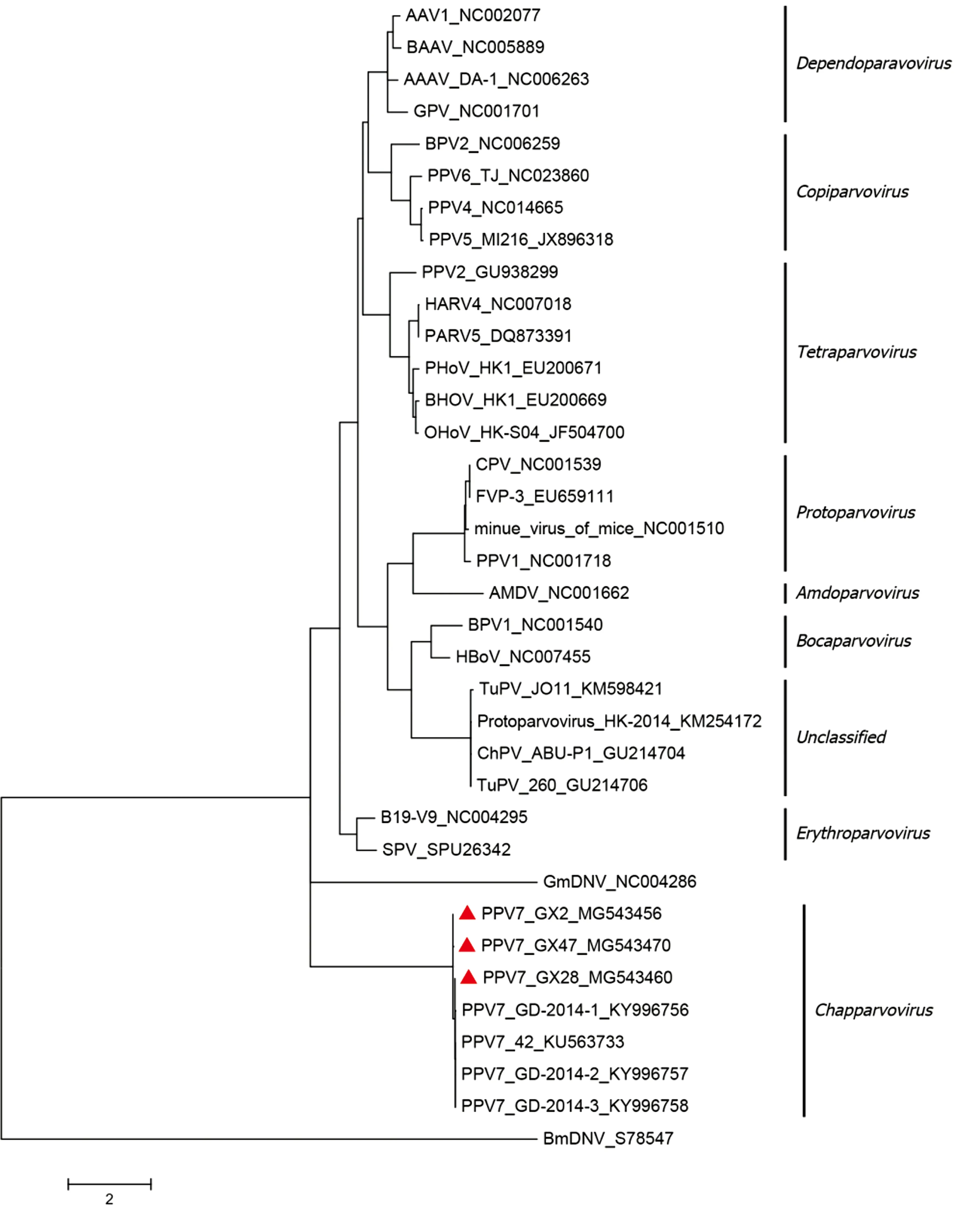
图2 PPV7进化分析
PCV2是引起PMWS的主要病原,且PCV2与其他病毒(如PPV、PRRSV等)病原在其诱导的淋巴细胞耗竭后引起继发感染[11]。同时研究也发现,与单独感染PCV2相比,共感染PCV2和PPV的猪会发生更严重的疾病及病变[12]。本试验发现,PPV7与PCV2高度共感染率,表明PPV7可能是PCV2病毒所引起疾病的重要辅助因子,但是仍然需要进一步的证明。
本研究团队自2015年以来就开始关注新型猪细小病毒的研究,陆续建立针对新型细小病毒的检测方法,展开对新型细小病毒的流行病学调查,关注新型细小病毒对猪群的健康的影响,对新型猪细小病毒的疫苗及预防提供积极有效的预防和诊断手段[13-14]。本试验发现,PPV7与PCV2存在较高的共感染情况,同时对广西地区PPV7流行毒株遗传进化分析,发现本试验的3株PPV7毒株与以往中国所报道的参考株其cap基因存在较大差异。
