通过计算方法预测甜菊糖苷的甜味和苦味
2020-05-18王海军夏咏梅
李 伟 , 王海军 , 夏咏梅 *
(1.食品科学与技术国家重点实验室,江南大学,江苏 无锡 214122;2.江南大学 化学与材料工程学院,江苏 无锡214122)
甜菊糖苷(steviol glycoside),是甜叶菊的叶子中所含的二萜糖苷类物质。该类物质具有相同的骨架和不同的位于C-13和C-19位上的糖基,结构如图1所示。与传统的蔗糖和人造甜味剂不同,甜菊糖苷对人体更加安全,对人体健康的副作用更小[1]。甜菊叶中含有质量分数6%~10%的斯替夫苷(Stevioside),2%~4%的莱鲍迪苷 A(Rebaudioside A)和1%~2%的其他次要糖苷,它们具有各自独特的结构和风味,一些主要的天然甜菊糖苷的结构和甜度如表1所示。其中,Rebaudioside A的甜度约为蔗糖的350倍,味感也最相近于蔗糖,有较高的应用价值。Stevioside在C-13位置上比Rebaudioside A少一个葡萄糖残基,甜度为蔗糖的约250倍,虽然含量更高,但更强的后苦味降低了它的应用价值[2]。Rebaudioside D在C-19位上比Rebaudioside A多一个葡萄糖残基,甜度虽降至约250倍蔗糖,但后苦味也更弱,因此综合味感更好。由此可见甜菊糖苷上的糖基对其风味的重要影响[3]。目前已发现64种甜菊糖苷,但大部分由于含量较低,缺乏相关甜味数据。此外为了改善甜菊糖苷的风味,研究人员使用了许多生物或化学方法来修饰其结构[4-7],但产品中多种物质混杂,难以彻底分离以验证不同组分的甜度[8]。因此,如果能够建立一种准确且省时省力的方法来预测甜菊糖苷的甜味和苦味,那么将有助于指导新型甜菊糖苷的设计和改性,从而获得更优质的甜味剂。

图1 甜菊糖苷分子结构式Fig.1 Molecule structure of steviol glycosides

表1 几种天然甜菊糖苷的结构及甜度Table 1 Structure and sweetness of several natural steviol glycosides
在人体感知味觉的过程中,味觉受体起着关键作用。人体甜味受体 (human sweet taste receptor,hSTR)是由两个亚基hT1R2和hT1R3组成的异二聚体蛋白,属于C类G蛋白偶联受体(C-GPCR)家族[11]。hT1R2和hT1R3结构包括氨基末端结构域(ATD)、半胱氨酸富集结构域(CRD)和7个跨膜螺旋结构域(TMD)[12],其ATD部分由两片以大间隙分隔的叶片构成,是与甜味剂发生结合的主要活性部位[13]。如糖(葡萄糖,蔗糖等)、二肽甜味剂(阿斯巴甜,阿力甜等)、甜蛋白(Thaumatin,Monellin 等)等物质都可以在该部分与甜味受体发生结合[14-15]。而人体苦味受体(human bitter taste receptor,hBTR)同样属于G蛋白偶联受体,人体中苦味的感知主要依赖hTAS2R家族中的25种受体[16],其中hTAS2R4(hT2R4)被发现在甜菊糖苷的苦味感知中起主要作用[17]。这些味觉受体通过不同的结合方式,与外来分子结合并被激活,引起一系列信号传导反应,如G蛋白的激活,细胞内钙释放,细胞去极化和激活突触等。最终产生特征性的味觉信号传递至大脑并引起人体对味觉的感知[18]。
作者通过计算方法,模拟味觉受体与甜菊糖苷之间的结合,从而预测甜菊糖苷的风味。目前,味觉受体的晶体结构尚未被解析,因此我们首先通过同源建模,建立了有高可信度的甜味受体hT1R2,hT1R3和苦味受体hT2R4的三维结构模型。接下来将天然甜菊糖苷作为配体,与味觉受体间进行分子对接,寻找计算结果与其甜味和苦味之间的关系,建立起用于预测甜菊糖苷风味的计算方法,并分析了甜菊糖苷结构的变化对其风味的影响。最后,通过这种方法,根据改性甜菊糖苷的结构预测其甜味和苦味,并挑选出可能的优质甜味剂。本研究有助于人们理解甜菊糖苷的结构与其风味之间的关系,明确设计或改性新型甜菊糖苷的思路,从而事半功倍地获取新型甜味剂,扩展甜菊糖苷在食品药物等领域中的应用。
1 材料与方法
1.1 使用软件
Discovery Studio 2.5:美国BIOVIA公司产品;Chemdraw 15:美国CambridgeSoft公司产品。
1.2 计算与实验方法
1.2.1 配体的准备 通过Chemdraw 15绘制一系列甜菊糖苷的分子结构(见表1和表4),并导入至Discovery Studio 2.5软件中,通过Prepare Ligands工具进行对配体的预处理,改变离子化状态,优化其构型。产生配体的3D模型,用于后续分子对接计算。
1.2.2 甜味受体的同源建模 在NCBI数据库中检索目标甜味受体hT1R2和hT1R3的氨基酸序列(ID:NP_689418.2,NP_689414.1)[19]。 并 对 其 进 行BLAST搜索,在PDB蛋白质数据库中搜索对目标序列有较高一致性的模板蛋白。在Discovery Studio 2.5中导入目标和模板序列,生成目标-模板序列比对结果。随后使用Build Homology Model工具,根据比对结果构建hT1R2和hT1R3的同源模型。通过Prepare Protein工具对受体模型进行优化,施加CHARMm力场并使其能量最小化。使用Ramachandran图和Verify 3D分数评估模型的可靠性。
1.2.3 苦味受体的同源建模 对苦味受体hT2R4同样进行上文中的检索,结果发现与hT2R4间序列一致性最高的模板也仅有14%的序列一致性,这不足以生成有高可靠性的同源模型。作者使用ITASSER在线建模服务器[20]来进行建模工作。在提交hT2R4的氨基酸序列(Q9NYW5.1)后,I-TASSER从PDB数据库中搜索具有一定相似性的模板,并从中切割出有较高相似性的片段,然后通过蒙特卡洛模拟对这些片段进行结构预测并组装成完整蛋白模型。之后通过将模型调整到低自由能状态,消除空间碰撞,优化氢键网络等处理,确定最终生成的同源模型[21]。通过I-TASSER的TM-score,以及Ramachandran图对模型的可靠性进行了检测。
1.2.4 分子对接 使用Discovery Studio 2.5中的Define and Edit Binding Site工具对受体模型进行处理,筛选出可能存在的结合位点,并生成活性域以定义可能发生分子对接的区域。选择CDOCKER半柔性对接方法对甜菊糖苷配体与味觉受体间进行分子对接计算,这种对接方法将大分子受体模型固定,而允许小分子配体模型的构象在合理范围内发生改变,在保证计算准确性的同时减少了计算量[22]。CDOCKER方法计算了配体-受体间相互作用能,根据能量筛选结合位置以确定最终的对接构象,对接过程中相互作用能的值越高,受体和配体之间的结合越稳定[23]。
2 结果与讨论
2.1 甜味受体的同源建模
通过BLAST搜索来寻找与甜味受体hT1R2和hT1R3间有较高相似性的模板。该方法基于模板与目标序列间的序列一致性和E值来进行选择,序列一致性越高且E值越低,模板与目标序列间相似性越高,更适合用于同源建模[19]。搜索结果显示青鳉鱼味觉受体T1R2-T1R3配体结合域晶体结构的B链(PDB ID:5X2M_B)与 hT1R2和 hT1R3受体间最为相似。与此前研究者们用于甜味受体同源建模的模板 3LMK_A[19]、2E4U_A[24]、1EWK_A[25]相 比 , 它 与hT1R2和hT1R3间有最高的序列一致性和最低的E值,如表2所示。因此,选用5X2M_B作为构建甜味受体同源模型的理想模板。

表2 用于甜味受体同源建模的不同模板的比较Table 2 Comparison of different templates used for homology modeling of sweet taste receptors
使用Discovery Studio 2.5的Build Homology Model工具构建同源模型(图2(a))。可见所建模型对应于甜味受体的ATD部分,主要由两个大叶片构成,中间存在较大空隙(图中亮绿色部分),这里也是甜味受体与配体间主要发生结合的位点所在[26]。Ramachandran 图(图 2(a))表明,对 hT1R2 而言,96.5%的氨基酸残基处于合理区域 (蓝线范围内绿点),2.0%处于允许区域(蓝线到粉线范围间绿点),1.5%处于异常区域 (粉线外红点)。而对hT1R3而言,这个比例则是94.5%、3.3%、2.2%。在此前的研究中,所构建的甜味受体同源模型中最多也只有90%的氨基酸残基处于合理区域[19,24]。Verify 3D分数对模型结构的可靠性进行了打分(图2(b),蓝色部分为高分区,可靠性高;红色部分为低分区,可靠性低),对 hT1R2为 0.65,对 hT1R3为 0.95,该值越接近1,模型质量越好。在此前的研究中,甜味受体的Verify 3D分数处于0.4至0.8的范围内[27]。以上分析证明,hT1R2和hT1R3甜味受体模型的绝大部分氨基酸残基都处于合理构象,模型的评价结果较好,可靠性较高,可用于后续分子对接计算。

图2 同源模型结构Fig.2 Homology models
2.2 苦味受体的同源建模
对于苦味受体hT2R4,I-TASSER建模服务器共 选 择 了 8 个 模 板 (4GRV,5TJV,4N6H,5ZBH,5G1H,4DJH,4BUO和5HAS),它们与目标序列的一致性在9%~13%之间。虽然这些模板的整体相似性较低,但I-TASSER切割出模板中与目标序列有较高相似性的片段并对其进行结构预测,然后组装成完整的苦味受体模型,从而保证模型整体的可靠性[21]。
如图2(c)所示,hT2R4同源模型由多根氨基酸螺旋构成,结合位点位于螺旋中央的空隙处。ITASSER使用TM-Score来评价建模质量,TMScore>0.5则代表模型与天然蛋白质结构较为相似[20]。最终得到的hT2R4同源模型的TM-Score为0.70±0.12,处于较高水平,证明建模结果具有较高的可信度。此外,hT2R4的Ramachandran图 (图2(c))显示,有93.0%的氨基酸残基处于合理区域,5.3%处于允许区域,1.7%处于异常区域,这也与过去研究的结果相似[28],证明大部分氨基酸残基都处于合理构象,模型可靠性较高。
2.3 天然甜菊糖苷分子对接计算结果
将上述同源模型用于与天然甜菊糖苷之间的分子对接计算,以探究计算结果与甜菊糖苷的甜味和苦味之间的关系。在此前的研究中,人们发现甜菊糖苷与甜味受体hT1R2和hT1R3之间的相互作用能(Interaction Energy,IE)与其甜度密切相关[29],hT1R2和hT1R3能够分别触发彼此独立的甜味信号,由两个亚基的累积效应引起甜味感知,因此可以通过将hT1R2和hT1R3与某种甜菊糖苷间的相互作用能(IEhT1R2,IEhT1R3)相加,以得到该甜菊糖苷与甜味受体间的总相互作用能(IEs)[19];同时用hT2R4与甜菊糖苷间的相互作用能(IEhT2R4)来代表甜菊糖苷与苦味受体间的总相互作用能(IEb)[28]。计算结果如表3所示,发现甜菊糖苷的IEs与其甜度之间存在明显的正相关趋势,两者的大小排序大致相同,高甜度的甜菊糖苷通常具有较高的IEs。对苦味受体也有同样的结论,Rubusoside和Stevioside等具有较强苦味的甜菊糖苷,其IEb都超过了45 kJ/mol。而苦味较弱的甜菊糖苷(Rebaudioside A、D、M)的IEb都低于40 kJ/mol。
结果表明,甜菊糖苷与味觉受体间的相互作用能可以在一定程度上反映其引发的相应味觉的强弱。因此,可通过计算找到与甜味受体间相互作用能(IEs)较高而与苦味受体间相互作用能(IEb)较低的甜菊糖苷,其最有可能使人感受到更强的甜味和更弱的苦味,从而产生较好的风味。

表3 天然甜菊糖苷与hT1R2,hT1R3和hT2R4间的相互作用能和产生相互作用的氨基酸残基Table 3 Interaction energy (IE) and residues involved in protein–ligand interactions of hT1R2,hT1R3 and hT2R4 with natural steviol glycosides
2.4 甜菊糖苷结构的改变对其风味的影响
分析上述对接结果可以发现,在甜菊糖苷的C-13和C-19位上仅有葡萄糖基的情况下,其与味觉受体间的相互作用能和其葡萄糖基数量间存在着一定的变化规律。当C-19位上糖基保持不变时,随着C-13位上葡萄糖基数量的增加 (Rubusoside<Stevioside<Rebaudioside A),甜菊糖苷与甜味受体间相互作用能(IEs)升高,与苦味受体间相互作用能(IEb)下降。而当C-13位上糖基不变时,随着C-19位上葡萄糖基数量增加 (Rebaudioside A<Rebaudioside D<Rebaudioside M),甜菊糖苷的IEs和IEb都在降低。即C-13位上葡萄糖基数量的增加导致甜菊糖苷的甜味增强,苦味减弱,C-19位上葡萄糖基数量的增加导致甜味和苦味都减弱。
通过分析甜菊糖苷与味觉受体之间的相互作用模式可以解释上述现象。甜菊糖苷 (图3,以Rebaudioside A为例)与味觉受体间的主要相互作用为受体的氨基酸残基与甜菊糖苷葡萄糖基上羟基之间的氢键作用。而C-13和C-19位上葡萄糖基数量的改变对甜菊糖苷风味造成的不同影响,可能是由于甜味和苦味受体的结合位点的空间差异所引起的。一方面,甜味受体的结合位点(图2(a),亮绿色部分)位于氨基末端结构域的两个叶片之间的大间隙中,具有较大的空间,配体进入结合位点时所受空间限制较小。另一方面,苦味受体的结合位点(图2(c),亮绿色部分)位于数根氨基酸螺旋之间的空隙中,空间较小,配体进入结合位点时所受空间限制较大。因此甜菊糖苷从体积较大的C-13糖基一侧进入甜味受体位点,从体积较小的C-19糖基一侧进入苦味受体位点。Rubusoside、Rebaudioside A、Rebaudioside M与味觉受体间的对接构象(图4)也证明了这一点。

图3 Rebaudioside A(RA)与 hT1R2,hT1R3和 hT2R4间相互作用模式图Fig.3 Interaction patterns of Rebaudioside A (RA)with hT1R2,hT1R3 and hT2R4
所以当C-13位上葡萄糖基数量增加时 (图4,从Rubusoside到Rebaudioside A),甜菊糖苷依然可以从该侧较轻松地进入空间较大的甜味受体的结合位点中。更多的糖基有利于与氨基酸残基间产生更强的相互作用和更高的IEs,从而激发更强烈的甜味信号。而在与苦味受体结合时,由于位点的空间较小,只有C-19位上的糖基能够进入位点,C-13位上较大的糖基不但由于距离较远难以与氨基酸残基间产生相互作用,并且会影响苦味受体与甜菊糖苷间结合构象的稳定性,使其IEb下降,导致苦味减弱。而当C-19位上葡萄糖基数量增加时(图4,从Rebaudioside A到Rebaudioside M),甜菊糖苷仍旧从C-13位方向与甜味受体结合,C-19位上的糖基在另一侧难以进入位点,仅会影响结合构象的稳定性。在与苦味受体结合时,C-19位上的糖基由于体积增大,也无法深入空间较小的结合位点,使得甜菊糖苷与苦味受体间的结合稳定性变差,因此导致IEs与IEb都降低,表现出甜味与苦味都在减弱。

图4 Rubusoside (Ru),Rebaudioside A (RA),Rebaudioside M(RM)与 hT1R2,hT1R3,hT2R4 间的对接构象Fig.4 Docking poses of Rubusoside(Ru),Rebaudioside A(RA) and Rebaudioside M (RM) docked on hT1R2,hT1R3 and hT2R4
2.5 预测改性甜菊糖苷的风味
根据以上的分析,作者预测在C-13位上有较多葡萄糖基的甜菊糖苷可能具有较强的甜味和较弱的苦味,能够成为优质甜味剂。在此前的研究中,许多研究者通过生物或化学改性方法,对甜菊中含量最高的Stevioside或Rebaudioside A进行改性,在C-13位上增加葡萄糖基从而得到新型甜菊糖苷。但是由于产品组分混杂,分离困难,难以验证其风味。因此我们在此选择了8种改性甜菊糖苷,其结构如表4所示[30-33]。通过计算方法来预测其风味,计算结果如表5所示。
分析以上计算结果可以发现,相比C-13位上有 3 个葡萄糖基(编号 1、2、3、4),有 4 个葡萄糖基(编号 5、6、7、8) 的改性甜菊糖苷通常具有更高的IEs和更低的IEb,即甜味更强且苦味更弱,这与之前分析天然甜菊糖苷计算结果得出的结论相符。相比天然甜菊糖苷中有最高甜度与应用价值的Rebaudioside A,在这8种改性甜菊糖苷中,编号5、6、8预测有更强的甜味和更弱的苦味,其中6号被预测为甜味最强而苦味最弱,可能有作为优质甜味剂投入应用的潜力。
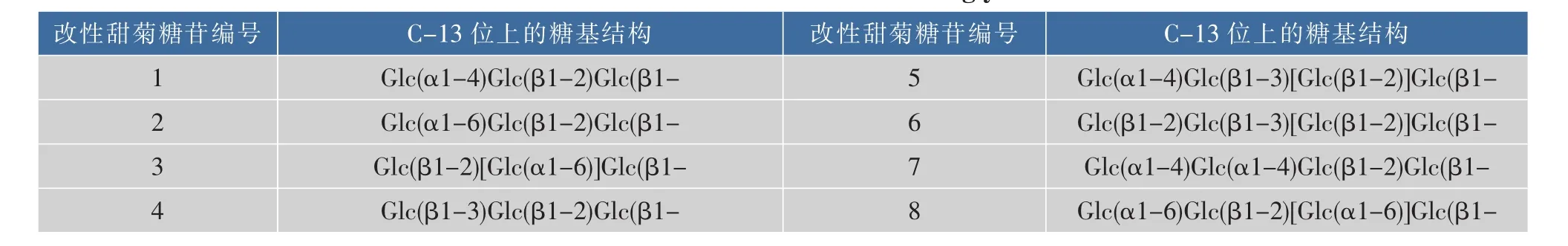
表4 改性甜菊糖苷的结构Table 4 Structures of modified steviol glycosides

表5 改性甜菊糖苷与hT1R2,hT1R3和hT2R4间的相互作用能和产生相互作用的氨基酸残基Table 5 Interaction energy (IE) and residues involved in protein–ligand interactions of hT1R2,hT1R3 and hT2R4 with modified steviol glycosides
不同的甜菊糖苷与味觉受体结合时,都有各自独特的相互作用模式,能够与味觉受体的不同组合氨基酸残基间产生相互作用。分析表3和表5可知,分别有24、21和17个氨基酸残基参与了甜菊糖苷与hT1R2、hT1R3和hT2R4间产生氢键的相互作 用 中 。 其 中 ,Ser290 (hT1R2),Glu131,Glu284(hT1R3)和 Ser263(hT2R4)可分别与 11,7,6 种甜菊糖苷间产生氢键,是与甜菊糖苷间产生氢键最频繁的氨基酸残基,在甜味和苦味的感知过程中起到重要作用。与其他甜菊糖苷相比,每种甜菊糖苷都具有各自独特的风味,这是由于甜菊糖苷的C-13和C-19位上具有不同结构的糖基。这些糖基与味觉受体中的众多氨基酸残基以不同组合的方式发生相互作用,并激发有各自特征性的味觉信号,信号传递到大脑最终使人感受到不同的风味。
3 结语
通过合适的模板,构建起具有高可靠性的甜味(hT1R2,hT1R3)和苦味(hT2R4)受体的同源模型,并与一系列甜菊糖苷之间进行分子对接研究。发现计算得到的受体-配体间相互作用能与甜菊糖苷的风味高度相关,与甜味受体间有高相互作用能且与苦味受体间有低相互作用能的甜菊糖苷最有可能具有较强的甜味和较弱的苦味。通过该方法,还预测了改性甜菊糖苷的风味并筛选出可能的优质甜味剂。通过分析计算结果和相互作用模式,我们发现C-13位上葡萄糖基的增多会导致甜菊糖苷的甜味增强而苦味减弱,C-19位上葡萄糖基的增多会导致甜味和苦味都减弱。这些不同的变化趋势是由甜味和苦味受体间的结构不同所引起的。甜菊糖苷通过C-13和C-19位上的糖基,与味觉受体中不同组合的氨基酸残基间发生相互作用,从而激发特征性的味觉信号并使人感知到不同的风味。通过这种计算方法,可以更好的理解甜菊糖苷的结构与其风味之间的联系,预测具有新设计结构的甜菊糖苷的风味,从而判断它是否是合适的甜味剂。这为进一步通过生物或化学改性方法改善甜菊糖苷的风味指明了方向,为新型甜味剂的预测和设计提供了新的途径。
