基于适配体识别的侧向层析法快速检测单核细胞增生李斯特氏菌
2020-05-18卢春霞李红敏孙凤霞康立超任江涛马朝阳
卢春霞, 李红敏, 孙凤霞, 康立超, 陈 亚, 任江涛*, 马朝阳
(1.长江师范学院 生命科学与技术学院,重庆 408100;2.新疆农垦科学院 分析测试中心,新疆 石河子 832000;3.重庆市涪陵食品药品检验所,重庆408100;4.江南大学 食品学院,江苏 无锡 214122)
单核细胞增生李斯特氏菌(Listeria monocytogenes,LM)简称单增李斯特菌,为革兰氏阳性无芽孢杆菌,是一种重要的人畜共患病的病原菌,可引起人和多种动物的疾病[1],致死率为20%~30%。该菌分布范围广,危害性大,环境耐受性较强,被世界卫生组织列为食品中四大食源性致病菌之一[2]。因此,发展快速、准确、操作简便的的单核细胞增生李斯特氏菌检测方法是预防食源性疾病发生的重要手段,对保证食品安全具有重要意义。
目前,针对该菌的鉴定和检测方法主要有3种:1)微生物培养法;2)特异性 DNA 杂交;3)免疫分析技术。其中,传统的微生物培养法耗时长、效率低,无法满足快速检测需求。基于特异性DNA杂交的PCR技术和核酸探针技术具有较高的灵敏度,但对工作人员和检测设备的要求较高,在基层不易推广应用。基于免疫分析原理的EEISA和胶体金试纸条检测技术虽然具有操作简便、检测时间短等优点,但抗体的制备需要免疫动物、成本高、抗体易失活。因此,迫切需要发展高灵敏、成本低、实用性强的食源性致病菌快速检测技术。
近年来,核酸适配体(Aptamer)作为一种新型的识别分子逐渐成为研究热点,其本质是一段单链寡核苷酸可折叠成发夹、茎环、假结体及G-四链体等二级或三级结构,通过氢键、范德华力等与靶分子相互作用而形成稳定的复合物,其空间结构的多样性几乎可以与所有种类的靶分子(细胞因子[3]、蛋白[4]、生物毒素[5]、金属离子[6]、小分子物质[7]、细胞[8]、微生物[9]等)发生结合。与传统的抗体相比,核酸适配体具有应用范围广,制备简单,变性与复性可逆,易于标记和保存等优点。因此,适配体作为一种新型识别分子在分析领域成为人们关注的焦点[10]。
目前,针对食源性致病菌的快速检测方法中,试纸条由于操作简单、快速、低成本,肉眼可见结果等优点,非常适用于大量样品的初筛及食品安全监督等领域的现场检测。目前,已有采用适配体试纸条检测微生物[11-12]、抗生素[13-14]、生物毒素[15-16]、小分子物质[17]、金属离子[18]的文献报道,但鲜有针对单核细胞增生李斯特氏菌检测方法的研究报道。因此,作者以该病原菌的核酸适配体为识别分子,以纳米金为检测信号,构建快速、简便的适配体检测试纸条,为单核细胞增生李斯特氏菌的快速检测提供技术支撑。
1 材料与方法
1.1 材料与试剂
金黄色葡萄球菌 (Staphylococcus aureus)ATCC6538-1、大肠埃希氏菌 (Escherichia coli)O157:H7 ATCC25922、鼠伤寒沙门氏菌(Salmonella typhimurium)ATCC14028、单核细胞增生李斯特菌(Listeria monocytogenes)ATCC19155、 阪崎肠杆 菌(Bntorobater sakazakii)ATCC29544: 新疆农垦科学院分析测试中心提供。
氯金酸(HACl4·3H2O):购自百灵威科技有限公司;磷酸三(2-氯乙基)酯(TCEP)、吐温-20、4-羟乙基哌嗪乙磺酸(Hepes)、聚乙二醇(PEG-20000)、链霉亲和素、三羟甲基氨基甲烷(Tris)、十六烧基三甲基漠化胺(CTAB)、三磷酸脱氧腺苷(dATP)、曲拉通X-100(Triton-100)、牛血清白蛋白(BSA)、琼脂糖等购自生物工程(上海)股份有限公司;柠檬酸三钠、浓盐酸、硝酸、庶糖等分析纯试剂:购于国药集团化学试剂有限公司;实验用水为超纯水(≥18.2 MΩ·cm);玻璃纤维膜(8906)、硝酸纤维素膜(CN140),吸水纸(H-1)、PVC 底板(J-B6):购自上海捷宁生物科技有限公司;Milipere Amicon Ultra-0.5超滤离心管(UFC5030 BK):购自上海康稳生物科技有限公司。
单核细胞增生李斯特氏菌核酸适配体[19]:上海生工生物技术有限公司合成。适配体和探针的具体序 列 如下:apt 1:5′-SH-C6-TAC TAT CGC GGA GAC AGC GCG GGA GGC ACC GGG GA-3′;apt 2:5′-Bio-TAG CGT GGG TAA CCG TGT TGG GGG GTG CCA CGG TC-3′;apt 1 互补 DNA:5′-Bio-TC CCC GGT GCC TCC CGC GCT GTC TCC GCG ATA GTA-5′和 3′。
1.2 仪器与设备
FEI Tecnai G2 F20场发射透射电子显微镜:美国FEI公司产品;紫外可见分光光度计(UV-2800):尤尼柯(上海)仪器有限公司产品;HM3030/HM3035 XYZ三维划膜喷金仪、GD300滚动式手动裁纸刀、ZQ4200数控感应斩切机:上海金标生物科技有限公司产品;5424R台式冷冻离心机:德国艾本德公司产品;SA224S-CW天平:德国 Sartorius公司产品;MS3 basic涡旋混合器:德国IKA公司产品;优普超纯水制造系统:成都超纯科技有限公司产品;ZK-82B真空干燥箱:上海市实验仪器厂产品;RCT basic package1磁力加热搅拌器:德国IKA公司产品;Powerpac 300电泳仪:美国BIO-RAD公司产品;Gel Doc XR System凝胶成像系统:美国BIORAD公司产品;pH计:上海 Metller Toledo公司产品;BSD-100振荡培养箱:上海博迅医疗生物仪器股份有限公司产品。
1.3 方法
1.3.1 试剂配制 0.01 mol/L PBS磷酸盐缓冲液(pH 7.4):称取 KCl 0.2 g,NaCl 8 g,KH2PO40.24 g,Na2HPO41.44 g,超纯水定容至 1 L;重悬液:0.01mol/L Tris-HCl(pH 8.0)溶液中包含质量分数5%BSA、0.25%吐温-20、10%蔗糖;适配体稀释液:50 mmol/L Tris-HCl(pH 7.5)溶液中包含 5 mmol/L KCl、100 mmol/L NaCl、1 mmol/L MgCl2;玻璃纤维膜处理液:0.1 mol/L Tris-HCl溶液中包含质量分数1%NaCl、0.5%吐温-20、1%BSA、2%蔗糖和 1%曲拉通X-100。
1.3.2 菌株活化与处理 将鼠伤寒沙门氏菌,金黄色葡萄球菌、大肠埃希氏菌O157:H7、单核细胞增生李斯特氏菌分别接种到经过高压灭菌的LB液体培养基中,置于37℃震荡培养箱中培养至对数生长期,收集菌液于3 000 r/min,4℃下离心5 min,去除上清液,用无菌0.01 mol/L PBS缓冲液(pH 7.4)清洗2次,去除多余的培养基,然后无菌PBS缓冲液重新悬浮,通过平板计数法得出食源性致病菌的浓度,4℃保存备用[20]。
1.3.3 胶体金的制备与表征 根据柠檬酸还原法[21],向锥形瓶(王水浸泡24 h)中加入质量分数0.01%氯金酸溶液100 mL,置于磁力加热搅拌器上加热至沸腾后持续2 min,迅速加入2 mL质量分数1%的柠檬酸三钠水溶液,继续搅拌加热,直到溶液变成透亮的酒红色,继续加热10 min后停止加热,搅拌使其冷却,4℃保存备用。并采用紫外可见光光度计和透射电镜对胶体金质量进行鉴定。
1.3.4 纳米金-适配体复合物(AuNPs-apt 1)的制备将 13 μL 10 μmol/L 的适配体加入 2 μL 1 mmol/L的TCEP溶液,常温避光活化1 h。取制备好的胶体金1 mL,用K2CO3溶液调pH值至7.4,10 000 r/min,4 ℃离心 10 min,弃去 900 μL 上清,剩于 100 μL 体系加入到活化体系中,涡旋混匀,常温下偶联反应2 h。反应结束后,加入 9 μL 100 μmol/L 的 dATP 溶液,室温反应1 h。封闭结束后,加入10 uL 1 mol/L NaCl溶液,老化30 min,置于4℃继续老化过夜。将偶联物1 000 r/min,4℃离心10 min,弃上清,用100 μL重悬液复溶,4℃保存备用。
1.3.5 试纸条的制备 玻璃纤维膜的处理:将玻璃纤维膜按规格裁成条状,在处理液中浸泡2 h,37℃烘箱中烘干,分别作为结合垫和样品垫,用三维平面点膜喷金仪将AuNPs-apt 1复合探针均匀的喷涂到结合垫上,25℃烘箱烘干备用;捕获探针和质控探针的制备:将75 μL 10 μmol/L的生物素化apt 2与25 μL 1 mg/mL链霉亲和素溶液混合,室温反应2小时,反应溶液移到超滤离心管,6 000 r/min,4℃离心20 min,除去没有反应的核酸。用0.01 mol/L PBS缓冲液洗涂2次。收集超滤管内的溶液,用PBS定容至原体积,4℃保存备用。同样的方法处理互补DNA探针,即得到捕获测探针和质控探针;T、C线的制备:利用喷金仪将制备好的检测和质控探针以0.7 μL/cm的喷速喷到NC膜上,分别作为T线(检测线)和C线(质控线),25℃烘箱中烘干备用;试纸条的组装:将处理好的样品垫、结合垫、NC膜和吸水垫依次图1黏贴于PVC底板上,相邻粘贴物之间的重叠部分长度为2 mm,T线与C线间隔距离为7mm,用切条机切成 4 mm宽的试纸条,与干燥剂一起装于铝箔袋中密封保存备用。
1.4 试纸条性能测定
1.4.1 试纸条检测限 用无菌PBS缓冲液(0.01mol/L,pH 7.4)将单核细胞增生李斯特氏菌梯度稀释成系列浓度,以无菌PBS缓冲液设空白对照,将制备好的试纸条插入到待测溶液中,5 min后观察结果,实验重复3次,将T线(检测线)消失前的菌液浓度定为检测限。
1.4.2 特异性测试 将单核细胞增生李斯特氏菌、鼠伤寒沙门氏菌、金黄色葡萄球菌、大肠埃希氏菌O157:H7、阪崎肠杆菌用无菌PBS缓冲液(0.01 mol/L,pH 7.4)分别稀释成浓度为4×106cfu/mL的菌液,用试纸条进行检测,测试试纸条的特异性。每个实验3个重复。
1.4.3 样品检测 样品增菌参照GB 4789.30-2010执行[22],无菌操作取样 25 g(mL)加入到均质袋中,然后加入225 mL的LB 1增菌液,充分均质,置于(30±1)℃培养 24 h,混匀。 增菌完成后,取1 mL增菌液于 9 mL LB 2增菌液中,(30±1)℃培养 24 h。取200 μL菌液到酶标板中,将试纸条插入菌液,5 min后判读结果。同时采用GB 4789.30-2010进行验证[22]。
2 结果与分析
2.1 检测原理
试纸条检测原理如图1,以固定在结合垫上AuNPs-apt 1为识别分子,T线上的链霉亲和素-生物素化apt 2为捕获探针,利用双适配体夹心模式检测样品中单核细胞增生李斯特氏菌。当样品中有待测目标物时,目标物和结合垫上的AuNPs-apt 1复合探针特异结合,随着毛细管作用层析到硝酸纤维素膜上,再与T线上的apt 2发生特异性结合,形成双适配体夹心模式,在检测线上显现出红色沉淀线;多余的AuNPs-apt 1继续向前,与质控线上包被的互补DNA链发生结合,纳米材料富集使C控线显色。如果样品中无目标物,AuNPs-apt 1在T线上不产生富集,继续层析迁移与C线上的互补DNA链发生结合,试纸条T线不显色,而C线显色。
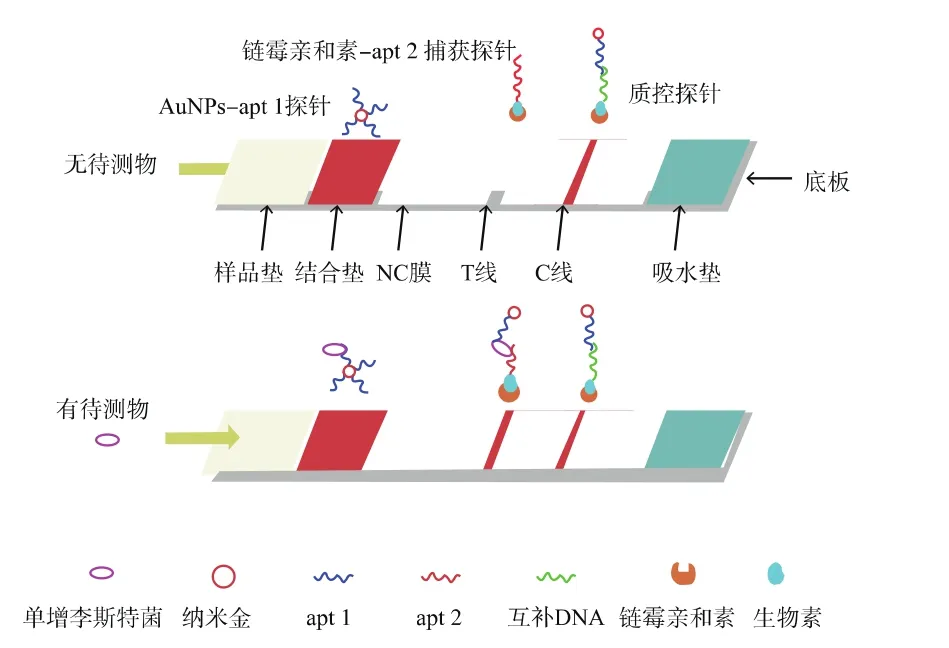
图1 纳米探针标记-适配体识别的试纸条检测原理图Fig.1 Schematic illustration of aptamer-based lateral flow strip for detection of targets
2.2 纳米金质量鉴定
有研究表明,纳米金(AuNPs)的大小及形貌对偶联核酸的效率和检测灵敏度至关重要,球形AuNPs偶联核酸的效率最高,试纸条的颜色是由金粒子聚集到一定程度时形成肉眼可见的信号。如果其粒径过小,产生的颜色较淡,影响试纸条灵敏度;粒径过大,不稳定,AuNPs容易聚集成蓝色,且会因位阻效应影响其在NC膜上的流动性,通常15~30 nm的AuNPs是最合适的[23-24]。作者制备的AuNPs最大吸收峰波长为 520 nm(图2a),为胶体金的特征吸收峰,吸收峰尖锐无杂峰,可说明所制AuNPs粒径均一。通过透射电镜表征结果显示 (图2b),AuNPs粒径约为20 nm,形貌为球型,分散性良好,粒径均一。以上结果表明制备的AuNPs大小适中,适合核酸适配体的标记。
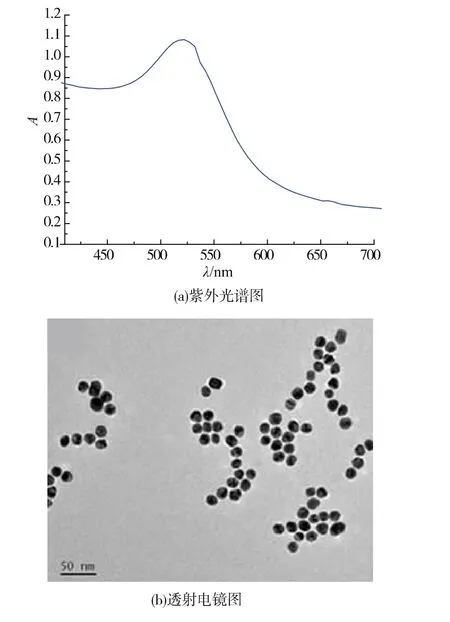
图2 纳米金紫外光谱图和透射电镜图Fig.2 Absorption spectrum and TEM images of the synthesized nanogold
2.3 纳米金与适配体的偶联
为了验证巯基化的apt 1成功修饰到纳米金表面,设计了琼脂糖凝胶电泳实验,如图3所示,泳道1出现了38 bp的清晰条带,为单增李斯特菌 apt 1,泳道 2为AuNPs-apt1复合物的条带,可以看出AuNPs-apt 1复合物的迁移率较之apt 1迟缓较多,金标记核酸适配体后相对分子质量增大,因此,适配体的迁移的速率远远高于AuNPs-apt复合物。综合以上,可初步判断巯基化的apt 1成功偶联到AuNPs表面。

图3 适配体1和AuNPs-apt 1琼脂糖电泳图Fig.3 The agarose electrophoresis of the apt 1 and AuNPs-apt 1
2.4 条件优化

图4 纳米金溶液pH值优化结果Fig.4 Determination of the optimal pH value for goldaptamer
2.4.1 纳米金标记适配体体最佳pH值的确定 纳米金有一个标记核酸适体的最佳pH值,在加入一定量的核酸适体后,不同pH条件下,稳定性不同[25]。纳米金标记适配体最佳pH值的测定结果如图4所示,当标记所用纳米金溶液pH在7.0~8.0时,金溶液颜色未变化,说明在该pH范围内形成的金标适配体复合物最稳定。因此,作者选择pH 7.4为纳米金标记适配体的最佳pH。
2.4.2 纳米金表面适配体浓度优化 纳米金溶液对离子强度的变化比较敏感,当有NaCl存在时,纳米金粒子表面离子的静电排斥被屏蔽,金颗粒将立即发生不可逆的沉聚,溶液由红色变为蓝色(如图5空白对照CK)。如果金溶液中加入巯基(-SH)修饰的适配体,通过巯基与纳米金之间形成的Au-S共价键,使其适配体牢固结合在纳米金表面,纳米金颗粒在溶液中的稳定性提高,即使加入盐溶液,胶体金也不会聚集变色。因此,合适的适配体浓度对提高金溶液稳定性和检测灵敏度较为重要,浓度过低,金溶液不稳定会变蓝色,且捕获的目标物较少;若浓度过高,金表面适配体过量,则造成浪费。本研究固定NaCl终浓度为80 mmol/L[26],采用目测法确定适配体最佳浓度。实验结果见图5,当适配体终浓度为0.5 μmol/L时,胶体金发生聚集,此时的适配体浓度不足以稳定胶体金;当适配体终浓度≥1 μmol/L时,胶体金溶液保持红色不变,说明此时纳米金-适配体体系稳定,且基本达到饱和状态。因此,选择1 μmol/L为稳定纳米金溶液的最小适配体浓度。

图5 适配体浓度优化结果Fig.5 Optimum of aptamer concentration by visual inspection
2.4.3 AuNPs-apt 1复合物最佳包被量 AuNPsapt 1包被量过多,容易造成浪费,也会使得背景信号提高,包被量太少,在高浓度的待测靶标条件下很容易饱和,影响响应信号的显示。作者将AuNPsapt 1 探针分别稀释 0×、2×、4×、6×,固定体积喷于结合垫上,检测浓度为4×106cfu/mL的单增李斯特菌溶液,比较试纸条的T线显色情况。结果如图6所示,当AuNPs-apt 1以原浓度包被时,T线显色较明显,随着AuNPs-apt 1浓度的减小,T线显色逐渐减弱或者消失。
2.4.4 T线最佳包被量 将生物素化apt 2-链霉亲和素用PBS缓冲液分别稀释0、2、4、6倍,按0.7 uL/cm喷于NC膜上,37℃烘箱中烘干2 h,制备成试纸条。检测浓度为4×106cfu/mL的单核细胞增生李斯特氏菌溶液,比较T线显色情况。从图7种可以看出,当apt 2-链霉亲和素稀释超过2×,T线显色明显减弱或者消失,因此,apt 2-链霉亲和素复合物稀释倍数选择为2。

图6 AuNPs-apt 1包被量对T线显色的影响Fig.6 Visual color changes at the test lines with different concentrations of AuNP-apt

图7 Apt 2-链霉亲和素包被浓度对T线显色的影响Fig.7 Visual color changes at the test lines with different concentrations of apt 2-streptavidin
2.5 试纸条检测性能
2.5.1 试纸条检测限 通过对系列浓度的单核细胞增生李斯特氏菌溶液进行检测,观察不同试纸条的显色信号,确定试纸条检测限。结果如图8所示,随着菌液浓度的降低,试纸条上的检测信号逐渐减弱。当浓度为 4×103cfu/mL时,检测线颜色明显变弱,低于4×102cfu/mL时,检测线肉眼完全不可见。因此,试纸条对单核细胞增生李斯特氏菌的裸眼可视检测限为4×103cfu/mL。
2.5.2 试纸条特异性 对试纸条进行交叉反应实验,以确定其对单核细胞增生李斯特氏菌的特异性,结果如图9所示,当浓度为4×106cfu/mL的单核细胞增生李斯特氏菌检测后,试纸条为阳性,其余的食源性致病菌检测结果为阴性,表明该试纸条对单核细胞增生李斯特氏菌具有很好的特异性。

图8 试纸条检测不同浓度的单核细胞增生李斯特氏菌Fig.8 Sensitivity of the aptamer-based lateral flow strip for Listeria monocytogenes

图9 试纸条特异性测试结果Fig.9 Specificity of the aptamer-based lateral flow strip for Listeria monocytogenes
2.5.3 实际样品检测 将制备的试纸条用于定性检测不同食品中的单核细胞增生李斯特氏菌,然后与国标法[22]相对比。检测结果表明,作者研究制备适配体试纸条检测结果与国标方法一致(表1)。该方法检测速度快、操作简单、结果准确,适用于大批量样品中单核细胞增生李斯特氏菌的快速定性检测。
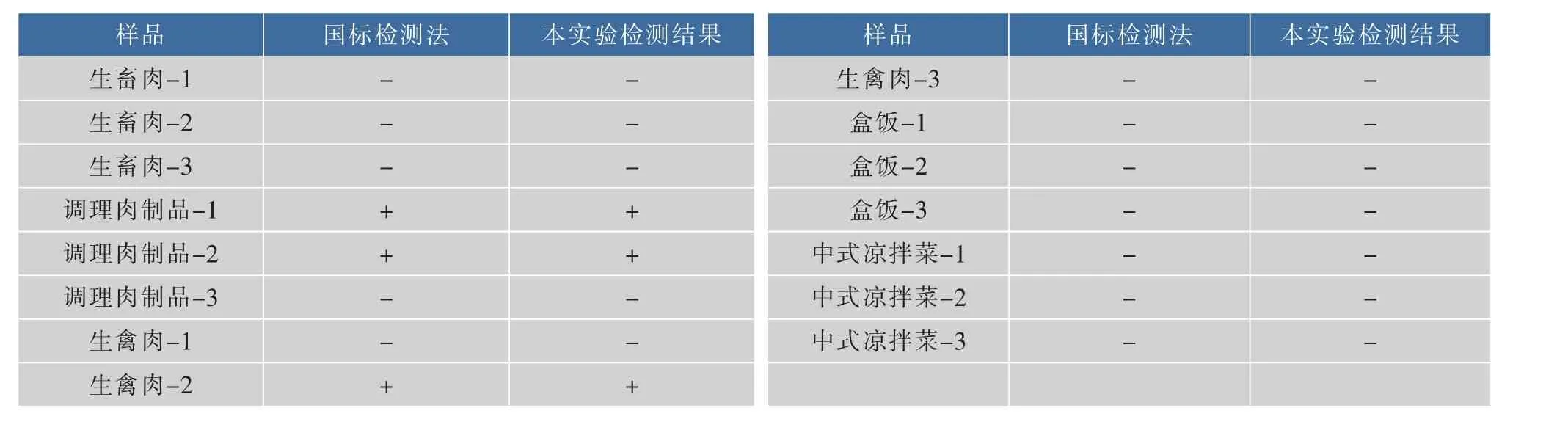
表1 与国家标准方法对样品中单核细胞增生李斯特氏菌检测结果对比Table 1 Listeria monocytogenes detected in real samples by proposed method and national standard method
3 结语
构建了一种基于双适配体夹心模式的层析试纸条,该试纸条具检测速度快,特异性好、结果准确可靠等特点,与传统的胶体金试纸条比较,成本更低,并成功用于食品中单核细胞增生性李斯特氏菌的检测,为批量样品的初筛和食品安全监管提供了技术支撑。
