槲皮素脂质体制备工艺研究
2020-05-18李雨荷陈小钰贾宁昊朱文明王海翔
李雨荷,陈小钰,黄 妮,徐 熙,贾宁昊,朱文明,王海翔
(1.中国药科大学工学院,江苏南京 211198;2.浙江海正药业股份有限公司,浙江台州 318000)
槲皮素(Quercetin) 是一种天然的黄酮类化合物,化学名为3,3",4",5,7-五羟基黄酮,广泛分布于蔬菜、水果、干果、饮料及中草药之中,具有扩张冠状动脉、降血脂、抗炎、抗过敏、抗糖尿病并发症等多种药理作用[1],近年已经发现槲皮素对肿瘤具有预防及治疗作用[2]。相关研究将槲皮素制成脂质体制剂,以便有效调整药物的体内分布和释放特征,起到靶向作用,提高药物疗效[3-4]。然而,由于槲皮素的水溶性非常小、口服吸收不好、生物利用度低、化学稳定性差,极大地限制了其在食品、医药和化工等领域的应用。因此,为了改善槲皮素的生物利用度、提高槲皮素的稳定性,试验将脂质体技术应用于槲皮素中,进行槲皮素脂质体的制备。采用薄膜分散法制备槲皮素脂质体,采用离心法进行包封率测定,并采用响应面法进行处方优化筛选。
1 仪器与试剂
KH-100B型超声波清洗器,昆山禾创超声仪器有限公司产品;RE52CS-1型旋转蒸发仪,上海亚荣生化仪器厂产品;TCL-16G型台式离心机,上海安亭科学仪器厂产品;LC-15C型高效液相色谱仪,日本岛津公司产品;ECLIPSE E100型荧光倒置显微镜,日本尼康产品。
槲皮素(含量98%),上海阿拉丁生物科技有限公司提供;胆固醇、无水乙醇(均为分析纯),国药集团化学试剂有限公司提供;大豆磷脂,江苏富盛德生物工程有限公司提供;甲醇(色谱纯),上海星可高纯溶剂有限公司提供;一水合葡萄糖(分析纯),南京化学试剂股份有限公司提供。
2 方法与结果
2.1 槲皮素脂质体的制备
称取适量槲皮素、胆固醇、大豆磷脂于250 mL的茄形瓶中,加入无水乙醇溶解。置于旋转蒸发仪,设定适合的水浴温度,无水乙醇完全回收后,茄形瓶内壁形成一层淡黄色均匀薄膜。加入5%的葡萄糖缓冲液50 mL,摇晃至均匀混合,于40℃下水浴加热旋转30 min,将溶液转移至烧杯中,超声分散5 min,得到浅黄绿色的均一溶液,过0.45 μm微孔滤膜,得到槲皮素脂质体,于4℃下保存[5]。
2.2 脂质体中槲皮素含量测定方法建立
2.2.1 色谱条件
采用月旭Ultimate LP-C18型(4.6 mm×250 mm,5 μm) 色谱柱,流动相:甲醇∶0.4%磷酸=55∶45,检测波长360 nm,流速1 mL/min,进样量10 μL。采用外标法。
2.2.2 对照品溶液的制备
精密称取槲皮素10 mg,置于10 mL棕色量瓶中,用甲醇溶液定容,得到1 mg/mL的槲皮素溶液,梯度稀释为0.1,0.01,0.001,0.000 1 mg/mL的对照品溶液。
2.2.3 线性范围考查
按照2.2.2处理对照品溶液,在2.2.1的色谱条件下,测定槲皮素的峰面积,以峰面积Y为纵坐标,质量浓度X(mg/mL)为横坐标进行线性回归,得到方程为Y=6.076 97×107X-14 293.084 55,R2=0.999 6,线性范围为0.000 1~0.1 mg/mL。
2.3 建立槲皮素脂质体包封率测定方法
将配置的槲皮素脂质体溶液离心,取上层清液0.2 mL,甲醇定容至10 mL,超声处理5 min破乳,利用高效液相色谱法检测药物。
根据包封率(EE)的计算公式,计算槲皮素脂质体的包封率。
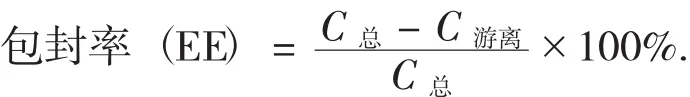
2.4 单因素考查筛选处方
2.4.1 胆固醇和大豆磷脂质量比的考查
固定药脂比为1∶16,5%的葡萄糖溶液作为水化液,即槲皮素含量10 mg,胆固醇和大豆磷脂的总量为160 mg,水化温度为40℃。设置胆固醇与大豆磷脂质量比为1∶6,1∶10,1∶12,按2.3方法分别测定脂质体的包封率及载药量。
不同胆固醇与大豆磷脂质量比处方包封率及载药量见表1。
结果显示,其余制备条件不变,随着大豆磷脂和胆固醇比例的改变,脂质体的包封率和载药量有明显变化。当胆固醇与大豆磷脂质量比为1∶6时,制备的脂质体包封率和载药量最大。
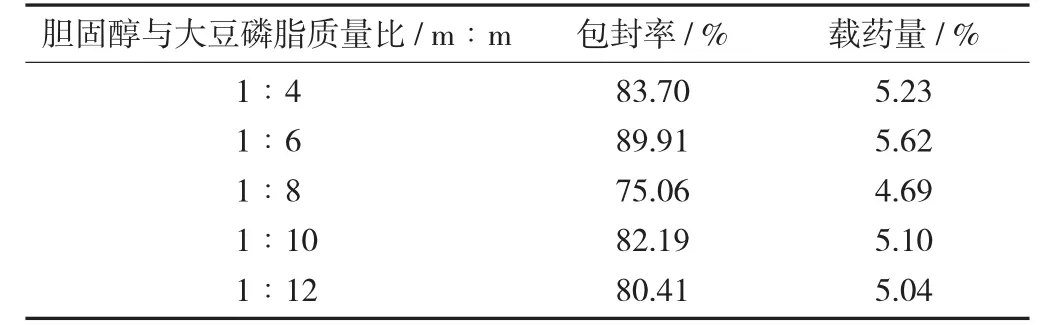
表1 不同胆固醇与大豆磷脂质量比处方包封率及载药量
2.4.2 药脂比的考查
固定胆固醇与大豆磷脂质量比为1∶8,5%的葡萄糖溶液作为水化液,槲皮素含量为10 mg,设置药脂比为1∶16,1∶24,1∶32,1∶40,根据药脂比及胆固醇与大豆磷脂质量比,按2.3方法分别测定脂质体的包封率及载药量。
不同药脂比处方包封率及载药量见表2。
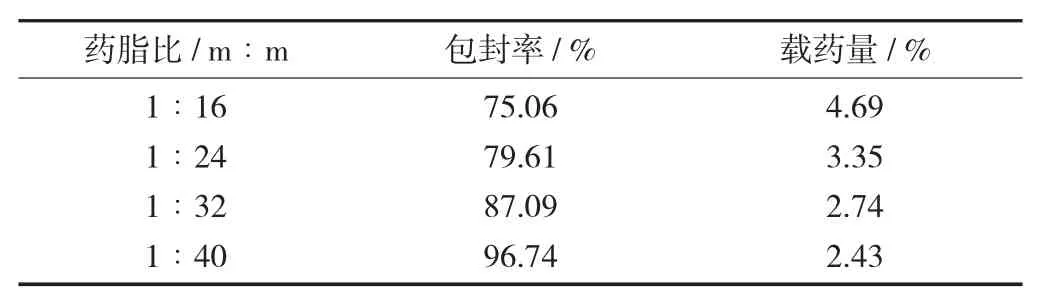
表2 不同药脂比处方包封率及载药量
结果显示,其余制备条件不变,随着药脂比的改变,脂质体的包封率和载药量有明显变化。随着药脂比的增加,包封率不断增大,但是载药量随之降低。
2.4.3 水化温度的考查
固定胆固醇与大豆磷脂质量比为1∶8,药脂比为1∶16,5%的葡萄糖溶液作为水化液,即槲皮素10 mg,胆固醇17.78 mg,大豆磷脂142.22 mg,改变水化温度分别为30,40,50℃,按2.3方法分别测定脂质体的包封率及载药量。
不同水化温度包封率及载药量见表3。
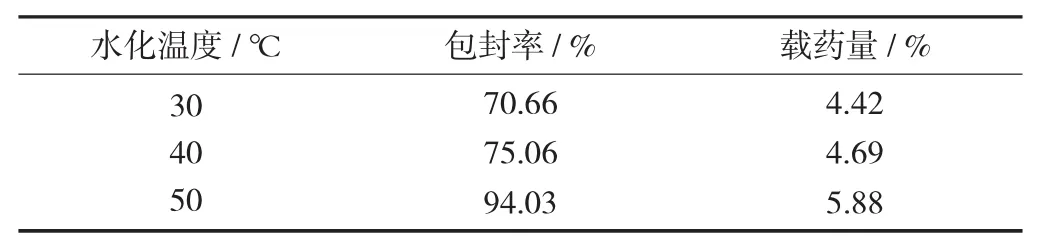
表2 不同药脂比处方包封率及载药量
结果显示,随着水化温度改变,在相同制备条件下,不同水化温度下脂质体的包封率和载药量有明显变化,当水化温度为50℃时,制备的脂质体的包封率和载药量最大。2.4.4 水化液的考查
固定胆固醇与大豆磷脂质量比为1∶8,药脂比为1∶16,水化温度为40℃,即槲皮素10 mg,胆固醇17.78 mg,大豆磷脂142.22 mg,改变水化液分别为5%的葡萄糖溶液、生理盐水、pH值7.4的PBS、pH值6.34的PBS。
除了5%的葡萄糖溶液外,其余3种水化液水化后得到的溶液均产生较多的沉淀和泡沫,不考虑采用。
2.5 响应曲面法优化处方
通过单因素考查,确定主要影响制备的因素为药脂比(A)、胆固醇与大豆磷脂质量比(B)、水化温度(C),以槲皮素脂质体的包封率及载药量为参考指标,每个因素设计3个水平,进行响应曲面试验。
因素与水平设计见表4。

表4 因素与水平设计
以包封率与载药量权重各50%进行综合评分,综合评分的公式为R=50%A+50%B(A为包封率,B为载药量)。用Design Expert软件进行数据处理,结果显示,R与A,B,C呈显著线性关系(p<0.01)。R=42.83+3.87×A+3.45×B+1.33×C。
单因素影响见图1,响应曲面法试验结果见表5。
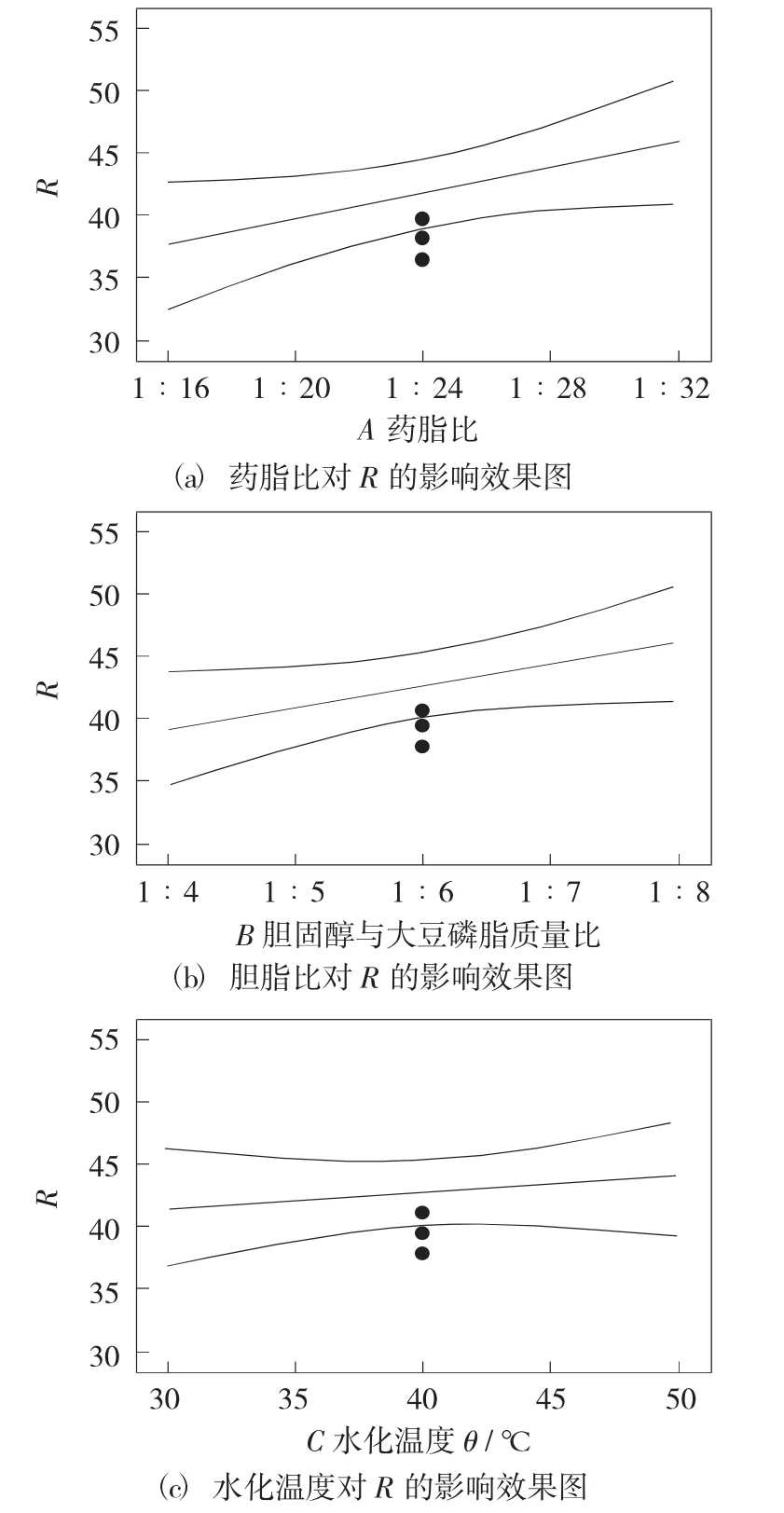
图1 单因素影响
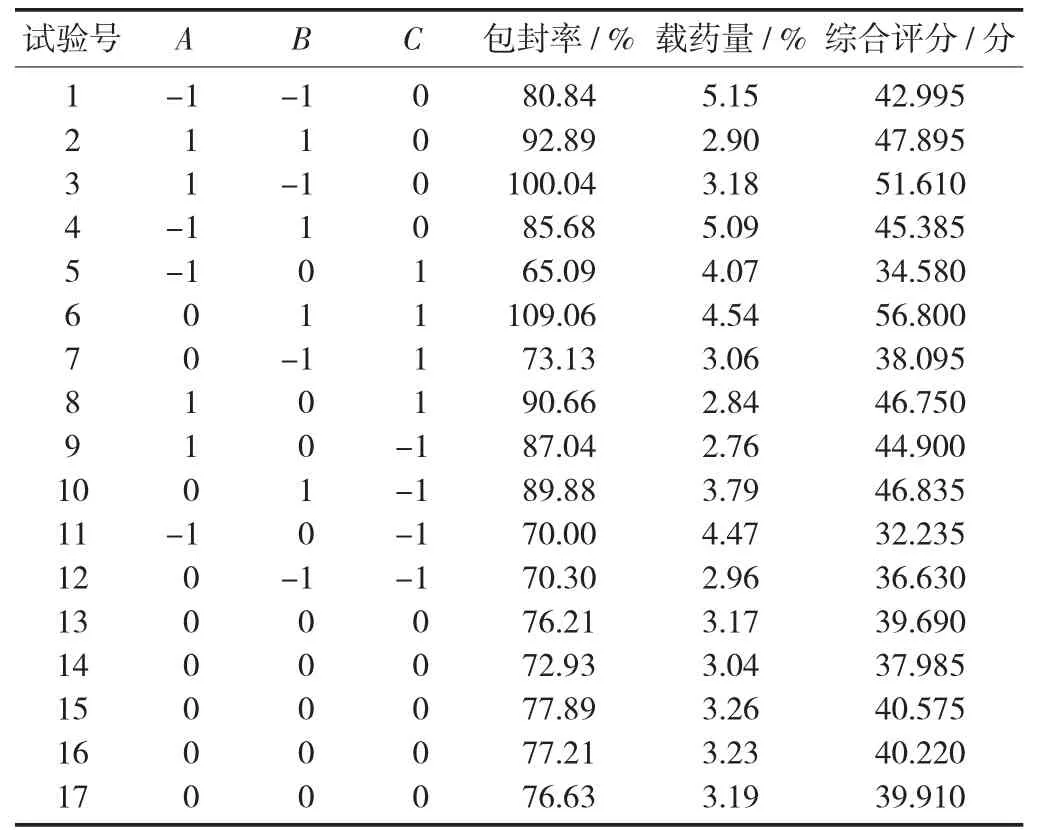
表5 响应曲面法试验结果
可知槲皮素脂质体制备工艺中影响包封率和载药量的主次因素顺序为A>B>C,即药脂比的影响最大,胆固醇与大豆磷脂质量比次之,水化温度影响最小。
以综合评分为指标,最佳处方工艺为A0B1C1,为表5中的第6组试验。即药脂比为1∶24,胆固醇与大豆磷脂质量比为1∶8,水化温度50℃,为槲皮素脂质体制备的最佳工艺。
2.6 槲皮素脂质体的形态观察
按照上述最佳处方制备3批槲皮素脂质体,测定其包封率和载药量无显著差异,制备工艺重现性良好。采用荧光倒置显微镜观察其形态。
槲皮素脂质体分布图见图2。

图2 槲皮素脂质体分布图
3 结论
制备脂质体过程中,大豆磷脂和胆固醇作为膜的流动性调节剂,其比例的变化对膜的形成有重要影响;成膜后加入水化液在一定温度下可形成脂质体。因此,单因素试验考查了大豆磷脂和胆固醇比例、药脂比、水化溶液、水化温度。结果表明,除了水化溶液由于水化后结果十分明显,不进行进一步研究,其余3项均将在后期进一步优化。
试验优化了槲皮素脂质体的制备工艺,通过单因素试验和响应曲面法得到了槲皮素脂质体的最优处方为胆固醇与大豆磷脂质量比1∶8,药脂比1∶24,水化温度50℃,在此条件下制备的槲皮素脂质体的包封率为109.06%,载药量为4.54%。
