绿茶末中L-茶氨酸的离子交换树脂纯化研究
2020-05-18刘晶晶陈志元李名洁
刘晶晶,陈志元,王 玉,江 丹,李名洁
(劲牌持正堂药业有限公司,湖北黄石 435000)
我国是世界最早开发利用茶叶的国家,在茶叶的生产与消费上位居世界前列[1]。茶叶在生产加工过程中会产生大量的茶末、茶梗等副产品,利用价值不高。随着茶叶深加工行业的发展,茶叶废料得到有效利用,特别是对茶末废料进行提取、分离纯化,可以获得多种生物活性物质,其中L-茶氨酸因其良好的生理功能与药用价值,逐渐成为国内外天然药物开发关注的热点[2]。
L-茶氨酸,又名L-谷氨酸-γ-乙基酰胺,是茶叶中特有的氨基酸,占茶叶干质量的0.5%~3.0%,天然存在的L-茶氨酸均为L型,化学性质稳定[3],具有降低血压、保护神经细胞、抑制癌细胞、浸润、减肥、改善经期综合症、提高免疫力、防御病毒等作用[4]。研究表明,茶叶中L-茶氨酸的含量与茶叶的品质呈正相关,茶叶中酚氨比值低,有利于茶叶品质[5]。现有的L-茶氨酸获取方式有化学合成法、微生物发酵法、茶叶愈伤组织及细胞培养法、体外酶促合成法等,存在安全性、成本高、技术难点攻克等问题[6-7]。从茶叶中直接提取分离制备获得L-茶氨酸,操作简便,易于实现。L-茶氨酸是两性电解质,使用离子交换树脂通过离子交换反应,可以实现目标物质与杂质的分离[8]。
以绿茶末为原料,在实验室前期确定了提取、大孔吸附除杂工艺的基础上,分别比较了LSI-010(H+),LSI-010(NH4+),001×7(NH4+),D941(OH-)4种类型离子交换树脂对绿茶末L-茶氨酸的纯化效果,并确定了LSI-010(H+)最佳上样pH值和氨水洗脱浓度。
1 材料与仪器
1.1 仪器
Waters e2695型高效液相色谱仪;AB135-S型分析天平,梅特勒-托利多公司产品;Sepax C18型色谱柱(4.6 mm×250 mm,5 μm),安捷伦科技公司产品;ELGA Option-Q型超纯水系统;水浴锅,上海申生科技有限公司产品。
1.2 试药
绿茶末,购自湖北宜昌;LSI-010型树脂,西安蓝深科技有限公司提供;001×7树脂、D941树脂,西安蓝晓科技有限公司提供;对照品L-茶氨酸(纯度98%,批号DST170621-021),成都德斯特生物技术有限公司提供;乙腈(TEDIA,色谱纯);盐酸、氨水、氢氧化钠,均为分析纯,国药集团化学试剂有限公司提供。
2 L-茶氨酸检测方法
2.1 对照品储备液的制备
精密称取L-茶氨酸对照品11.78 mg于50 mL容量瓶中,用水溶解并定容至刻度,即为对照品储备液,L-茶氨酸浓度为230.89 mol/L。
2.2 供试品溶液制备
精密称取绿茶末提取物50.00 mg于10 mL容量瓶,加水超声溶解,定容至刻度,摇匀,经0.22 μm微孔滤膜过滤,即为供试品溶液。
2.3 色谱条件
色谱柱:Sepax C18色谱柱(4.6 mm×250 mm,5 μm);紫外检测器,检测波长为210 nm;按照表1梯度洗脱,流动相流速0.5 mL/min,柱温30℃。
梯度洗脱见表1,L-茶氨酸对照品HPLC色谱图见图1,绿茶末提取物HPLC色谱图见图2。

表1 梯度洗脱
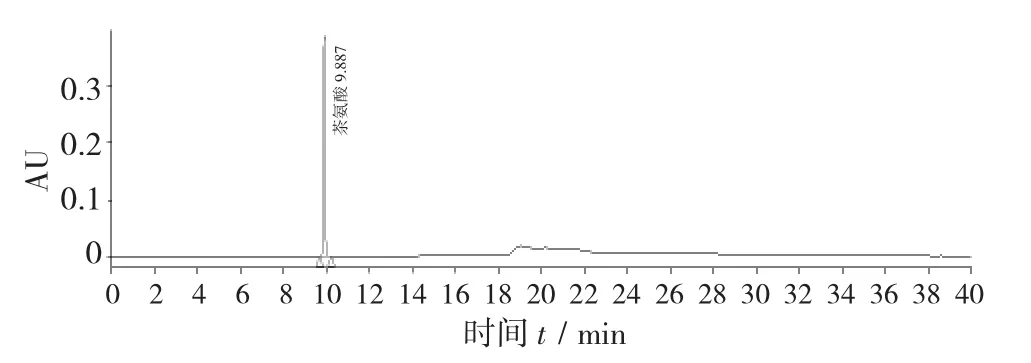
图1 L-茶氨酸对照品HPLC色谱图
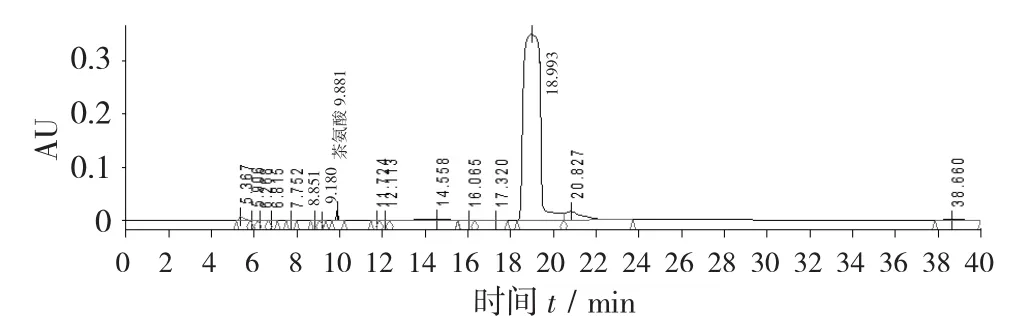
图2 绿茶末提取物HPLC色谱图
2.4 检测方法学研究
2.4.1 线性范围考查
分别精密移取2.1项下对照品储备液2,4,6,8,10 mL于10 mL容量瓶,加水稀释定容,所得L-茶氨酸浓度分别为46.18,92.36,138.53,184.71,230.89 mol/L,0.22 μm滤膜滤过后,作为标准品溶液备用。按照2.3项下所示条件进行色谱分析,以L-茶氨酸标准品溶液浓度为横坐标(X),以L-茶氨酸标准品溶液峰面积为纵坐标(Y),建立标准曲线:Y=9.02×103X-1.81×104,R=0.999 5。
2.4.2 精密度试验
精密称取绿茶末提取物51.31 mg,按照2.2中所示方法制备供试品溶液,在2.3项下进行色谱分析连续进样6次,精密度试验RSD值为0.87%。
2.4.3 稳定性试验
取2.4.2中的供试品溶液,按照2.3中色谱条件下分别于0,40,80,120,240 min时进样分析,得到绿茶末提取物中L-茶氨酸的峰面积,稳定性试验RSD值为0.94%。
2.4.4 重复性试验
精密称取绿茶末提取物50 mg共6份,按照2.2中所示方法制备供试品溶液,按照2.3中条件进行色谱分析,利用建立的标准曲线计算各供试品溶液中L-茶氨酸的含量,重复性试验RSD值为0.94%。
2.4.5 加标回收试验
精密称取绿茶末提取物25 mg共9份,分别加入相当于25 mg提取物中L-茶氨酸含量50%,100%,150%3个梯度的L-茶氨酸对照品溶液各3份,按照2.2中所示方法制备绿茶末提取物供试品溶液作为加标回收试验样品,按照2.3中条件进行色谱分析,利用标准曲线计算L-茶氨酸的含量及回收率。计算所得绿茶末提取物中L-茶氨酸的平均回收率为102.82%,加标回收试验的RSD值为0.02%。
3 离子交换树脂对L-茶氨酸纯化效果的考查
绿茶末经混匀后,分别加入药材量15倍,10倍纯化水,于70℃下提取30 min,提取2次,过滤后,经大孔树脂吸附分离,收集上样流出水洗液,分别考查离子交换树脂类型、上样pH值和氨水洗脱浓度对L-茶氨酸纯化效果的影响。
3.1 不同类型离子交换树脂对L-茶氨酸纯化效果的影响
称取等量绿茶末4份,经过提取、大孔树脂分离后,收集上样流出水洗液,分别经LSI-010(H+),LSI-010(NH4+)、001×7(NH4+)、D941(OH-)树脂交换后,4 BV水洗,弃去水洗液,0.5 mol/L氨水6 BV洗脱,收集洗脱液,浓缩干燥,计算收率,并测定L-茶氨酸的含量。
不同类型离子交换树脂对L-茶氨酸的纯化效果见表2。
3.2 不同上样pH值对L-茶氨酸纯化效果的影响
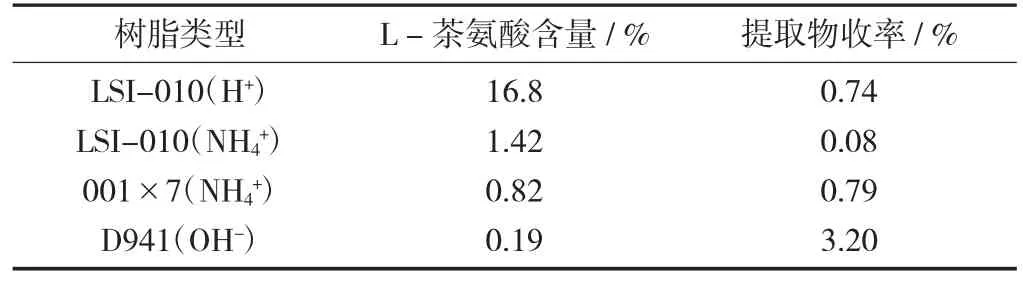
表2 不同类型离子交换树脂对L-茶氨酸的纯化效果
精密称取等量LSI-010共5份,预处理为H型后滤干水分,4%HCl调节大孔水洗流出液pH值为3.0~3.5,3.5~4.0,4.0~4.5,4.5~5.0,5.0~5.5,加样至离心管中,静态吸附,间歇振荡混匀,测定吸附前后L-茶氨酸浓度,计算L-茶氨酸的吸附率。
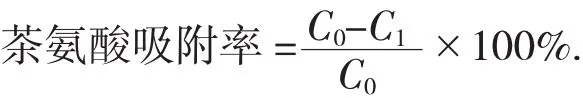
式中:C0——吸附前L-茶氨酸的量,mg;
C1——吸附后L-茶氨酸的量,mg。
不同上样pH值对L-茶氨酸的纯化效果见表3。
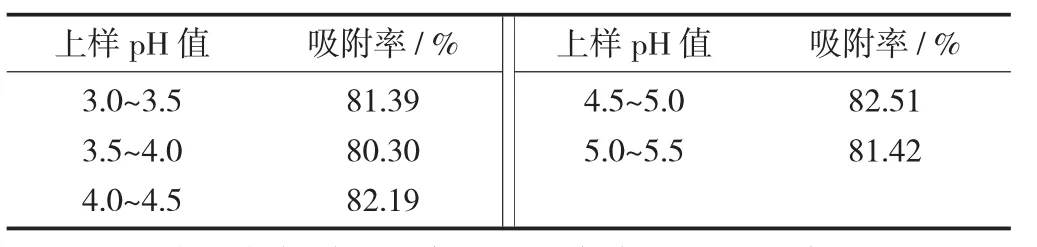
表3 不同上样pH值对L-茶氨酸的纯化效果
3.3 不同浓度氨水洗脱对L-茶氨酸纯化效果的影响
称取等量LSI-010共5份,预处理为H型后,装柱上样,4 BV水洗,弃去水洗液,分别以6 BV 0.25,0.50,1.00,1.50,2.0 mol/L氨水洗脱,收集洗脱液,浓缩干燥,测定提取物中L-茶氨酸含量。
不同浓度氨水洗脱对L-茶氨酸的纯化见表4。

表4 不同浓度氨水洗脱对L-茶氨酸的纯化
4 结论
不同类型离子交换树脂对L-茶氨酸的纯化效果(表2)结果显示,经4种树脂交换后,绿茶末提取物中L-茶氨酸的含量从高到低依次为LSI-010(H+),LSI-010(NH4+),001×7(NH4+),D941(OH-),提取物的收率从高到低依次为D941(OH-),001×7(NH4+),LSI-010(H+),LSI-010(NH4+);L-茶氨酸是两性电解质,其水溶液显示弱酸性,在此状态下,L-茶氨酸以阳离子形式存在,因而可以与阳离子树脂发生交换。由于不同类型离子交换树脂的交换基团选择性和交联度的差异,其对L-茶氨酸的吸附和交换能力也各不相同;树脂转型后对L-茶氨酸的吸附影响很大,就试验结果而言,H+比NH4+交换能力强[9]。
不同上样pH值对L-茶氨酸纯化效果(表3)结果显示,当pH值在4.5~5.0时,LSI-010(H+)对L-茶氨酸的吸附率较高;降低pH值,相应增加了体系的离子强度,但溶液中的离子与L-茶氨酸存在竞争交换基团。考虑到生产中酸液易于腐蚀管道与设备,调节pH值对L-茶氨酸纯化差异不大,为了避免增加工艺的复杂性,因而LSI-010(H+)上样前无需调节pH值(5.0~5.5)。
不同氨水浓度对L-茶氨酸的纯化效果(表4)结果显示,随着氨水洗脱浓度的增加,提取物中L-茶氨酸的含量先增加后下降,在氨水浓度为0.50 mol/L时,提取物中L-茶氨酸的含量最高;当氨水浓度增加,洗脱液的离子强度也相应增加,L-茶氨酸被释放和置换速度更快,但随之更多的杂质也被洗脱下来。
