三穗鸭ORAI1基因SNPs筛查及生物信息学分析
2020-05-15谭光辉张依裕覃媛钰李杰章
谭光辉,张依裕,吴 磊,覃媛钰,李杰章
(贵州大学 动物科学学院/高原山地动物遗传育种与繁殖教育部重点实验室,贵州 贵阳 550025)
钙释放酶激活钙调制器1(Orai calcium release-activated calcium modulator 1,ORAI1)属于ORAI家族成员,同时也是钙离子膜通道的一个亚型,它不仅调控细胞内钙离子流入,而且还是调节免疫反应的重要元素[1]。前人研究表明,ORAI1蛋白是介导钙离子信号的重要通道,是非兴奋细胞内最主要的钙离子进入细胞的方式[2-4]。DONG等[5]研究发现,ORAI1能够控制细胞内钙离子的内流,钙离子内流通过ORAI1通道间歇性激活。WANG等[6]和MOURA等[7]研究表明,ORAI1过表达增加了进入细胞的钙离子量,并且ORAI1是神经元内钙离子的稳态的调控因子之一,同时还是内质网钙储备耗尽的传感器。鸭ORAI1基因位于16号染色体上,有3个外显子,4个变异体,广泛表达于多种细胞和组织中,包括子宫细胞和免疫细胞中[8]。子宫是蛋壳形成主要部位,子宫内蛋壳腺的黏膜分泌的蛋壳液沉积而成蛋壳,蛋壳液中含有大量的钙离子[9]。因此,钙离子与蛋壳品质具有直接联系。
DNA混合池是混合具有相同特征群体的DNA,PCR扩增测序是直接检测出单核苷酸突变位点(Single nucleotide polymorphism site,SNPs)的一种成本低、效率高的方法。利用DNA混合池和直接测序技术对未知的单核苷酸突变或已知SNPs等位基因频率进行快速筛查,可极大缩短试验周期,是可行可信的SNPs筛选方法[10]。
三穗鸭原产于贵州三穗县,是我国优良地方品种,具有体型小、早熟、产蛋多、适应性和牧饲力强的特点,且其肉质细嫩、味美鲜香,深受人们喜爱。但随着目前养殖技术的逐渐提高,因蛋壳破损带来的经济损失越来越严重,产蛋高峰期尤为突出。鉴于此,以贵州三穗鸭为研究对象,采用DNA混合池和PCR直接测序法对三穗鸭ORAI1基因进行SNPs筛选,并进行蛋白质功能预测,以期明确ORAI1基因对三穗鸭蛋壳品质的影响,为在分子水平改善蛋壳品质提供理论依据。
1 材料和方法
1.1 主要试剂和仪器
主要仪器:电泳仪(DYY-2C)购自北京六一仪器厂;梯度PCR仪(PTC200)购自美国Bio-Rad公司;紫外分光光度计购自Thermo公司。
主要试剂:2×TaqPCR Master Mix 试剂和琼脂糖购自北京康为世纪生物科技有限公司;DL2000 DNA Marker 购自重庆擎科生物科技有限公司;全血DNA 提取试剂盒购自天根生化科技有限公司。
1.2 血样采集与DNA的提取
自贵州省三穗县三穗鸭繁育中心采集200份三穗鸭血样,保存于医用采血管。采用全血DNA 提取试剂盒提取血液DNA[11],紫外分光光度计检测DNA质量,1.5% 琼脂糖凝胶电泳检测DNA质量,三蒸水调整DNA质量浓度至100 ng/μL。各取2 μL DNA构建DNA混合池,保存于 -20 ℃备用。
1.3 引物设计与PCR扩增
参照NCBI GenBank中鸭ORAI1基因序列(NC_040061.1),使用Primer Premier 5.0软件设计5对特异性引物(表1),引物由上海生工生物有限公司合成。PCR扩增体系30 μL:上、下游引物各2 μL,2×TaqPCR Master Mix 15 μL,三穗鸭血液基因组DNA 1 μL,ddH2O 补足30 μL。PCR扩增程序:96 ℃预变性5 min;96 ℃变性30 s、退火(温度见表1) 50 s、72 ℃延伸30 s,35 个循环;72 ℃延伸5 min,保存于4 ℃。1.5%琼脂糖凝胶电泳检测扩增结果。
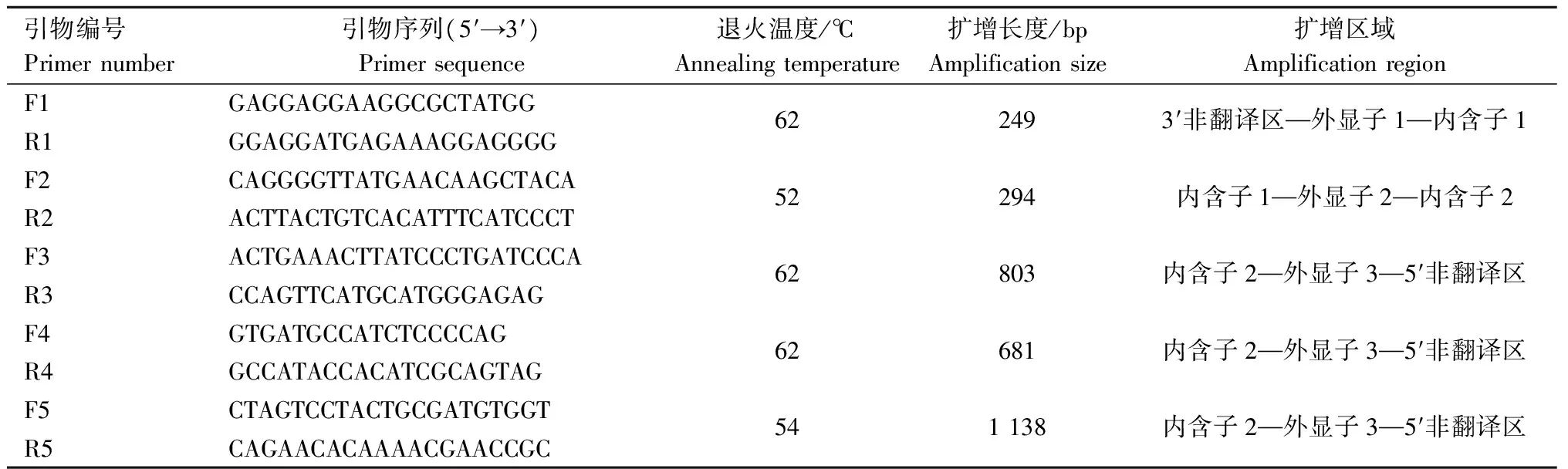
表1 三穗鸭ORAI1基因的引物信息Tab.1 Primer information of Sansui duck ORAI1 gene
1.4 SNPs筛选和等位基因频率估算
将PCR扩增产物用1.5%的琼脂糖凝胶电泳检测,选择特异性良好的PCR扩增产物进行纯化回收,送往上海生工生物有限公司测序。测序结果应用MegAlign、EditSeq和DNAStar软件比对拼接,获得三穗鸭ORAI1基因编码序列;采用Chromas软件查看测序图谱,MWSnap序列分析软件标尺测量三穗鸭ORAI1各突变位点等位基因峰图高度,计算等位基因频率:Fi=hi/(h1+h2),式中,Fi为突变位点等位基因频率,h1和h2为测序图谱上该突变位点等位基因1和2的峰高度[12-13]。
1.5 生物信息学分析
按照文献[12-13]中的软件对三穗鸭ORAI1基因编码区域进行蛋白质功能预测。采用在线软件AAcompldent(http://web.expasy.org/protparam/) 预测三穗鸭ORAI1蛋白的理化性质及疏水性和亲水性;采用在线软件RNAfold web server(http://rna.tbi.univie.ac.at//cgi-bin/RNAWebSuite/RNAfold.cgi)预测ORAI1基因mRNA二级结构;应用在线软件SignalP-5.0 Server(http://www.cbs.dtu.dk/services/SignalP/#opennewwindow)分析ORAI1蛋白的信号肽;利用NetNGlyc 1.0软件分析ORAI1蛋白的N-糖基化位点;应用在线软件PredictProtein预测ORAI1蛋白的二级结构;采用SWISS-MODEL同源建模方法构建ORAI1蛋白的三级结构模型。
2 结果与分析
2.1 三穗鸭ORAI1基因PCR扩增
从图1可以看出,三穗鸭ORAI1基因 5对引物扩增结果特异性较好,与预期扩增片段长度相符,可用于下一步试验。
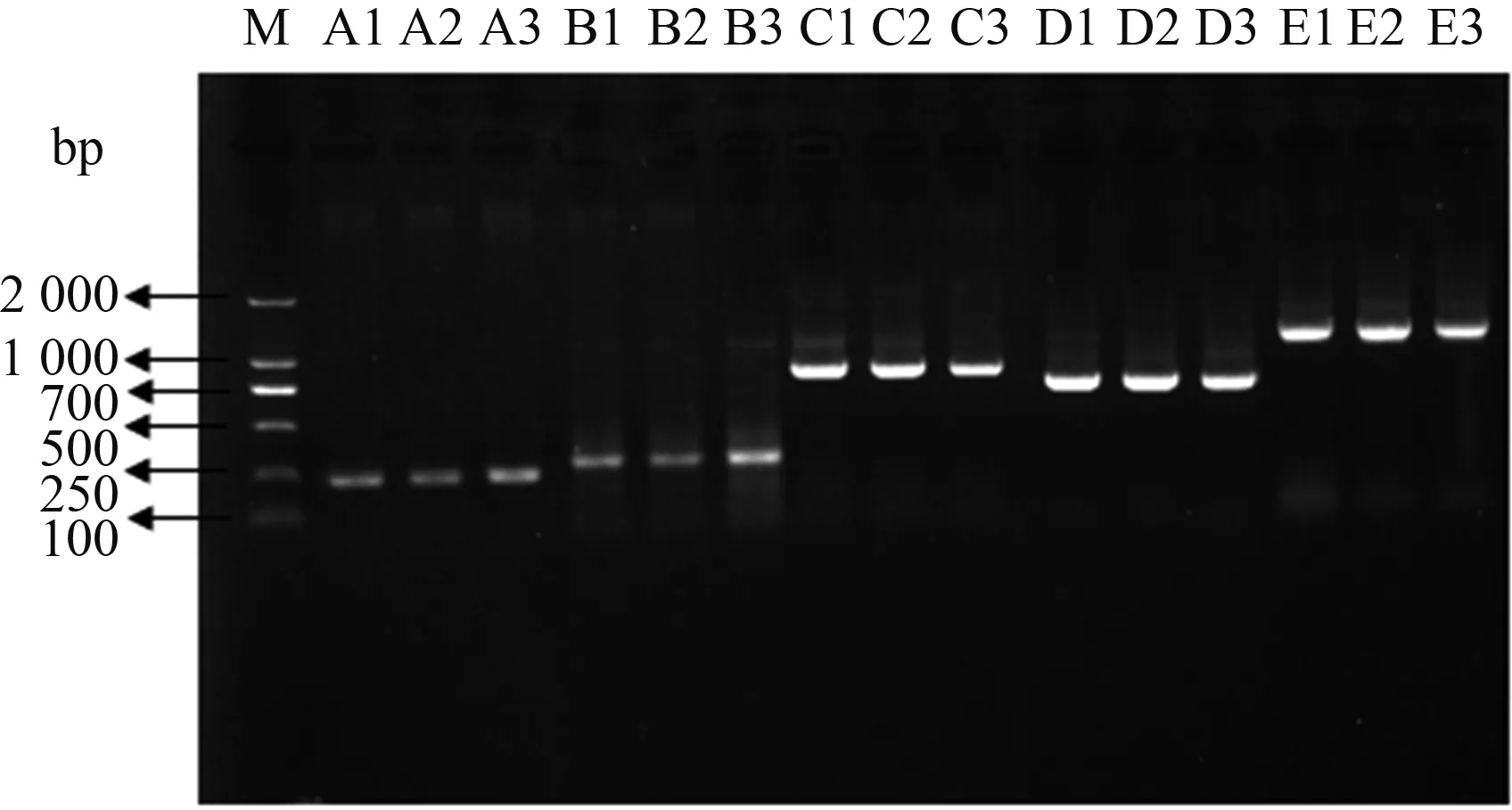
M:DL2000 DNA Marker;A1—A3:第F1/R1对引物
2.2 三穗鸭ORAI1基因序列测定
将拼接的三穗鸭ORAI1基因与GenBank公布的鸭ORAI1基因的CDS区序列进行比对,共发现3个SNPs(图2),均在外显子3,分别命名为 T84C、C188T、A471G(以该基因CDS区第1个碱基开始计数)。由于SNP位点核苷酸的密码子存在简并现象,3个SNPs均属于非错义突变,没有造成氨基酸的突变。
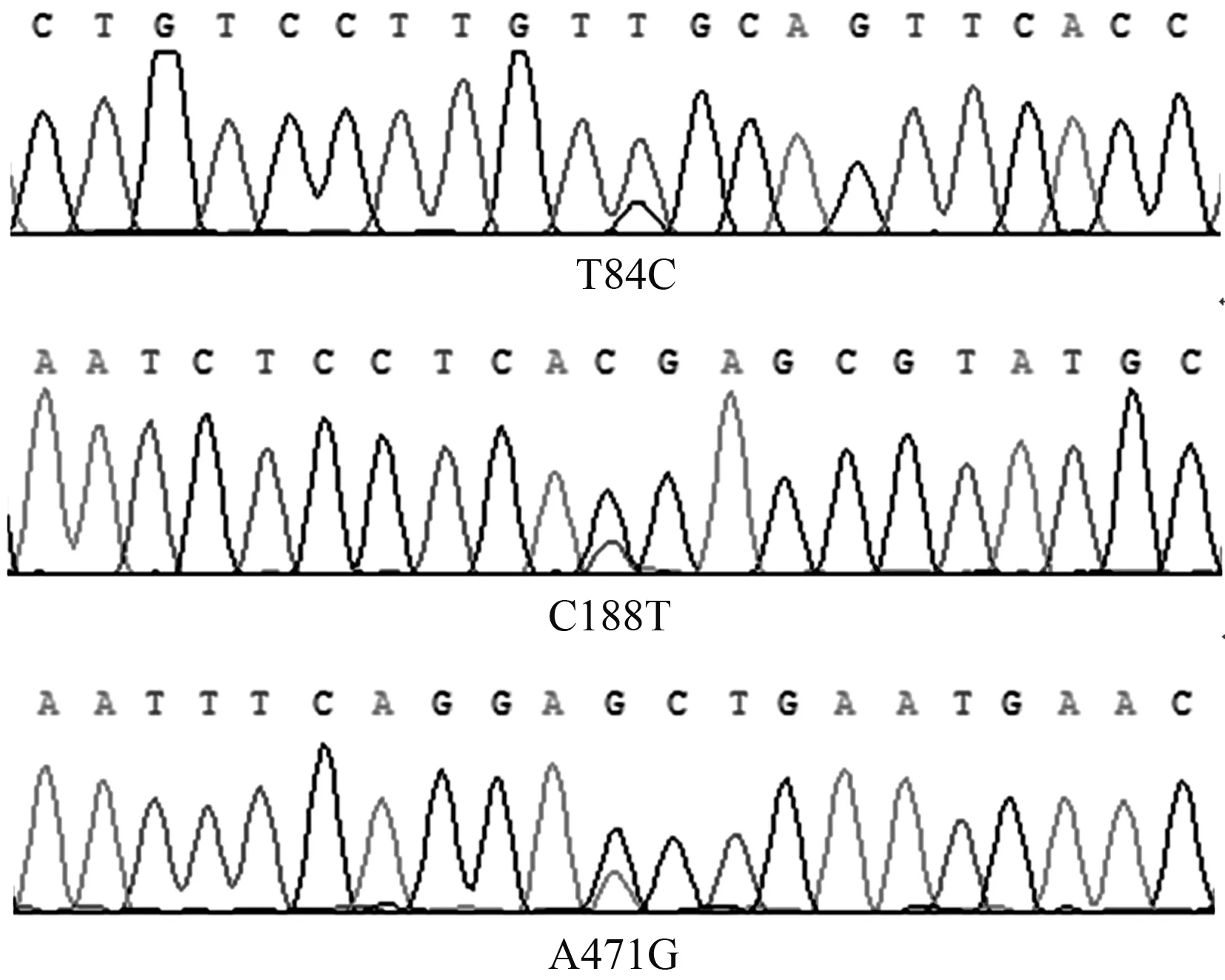
图2 三穗鸭ORAI1基因测序结果Fig.2 Results of ORAI1 gene sequencing in Sansui duck
2.3 三穗鸭ORAI1基因单核苷酸突变位点等位基因频率估算
由表2可知,3个SNPs在突变前后等位基因频率存在差异,其中T84C和C188T这2个突变位点在突变前后差异较大,并且突变后等位基因频率均降低,而A471G突变位点在突变前后等位基因频率差异较小,突变致使等位基因频率增加。
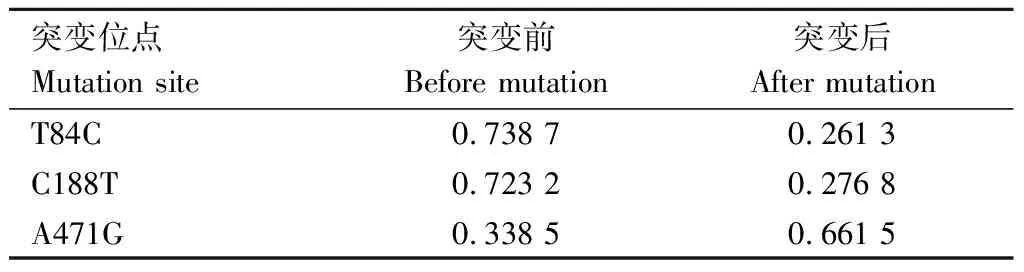
表2 三穗鸭ORAI1基因突变位点等位基因频率估算结果
2.4 蛋白质功能预测
2.4.1 SNPs对三穗鸭ORAI1基因mRNA二级结构的影响 以ORAI1基因CDS区为参考序列(No.:NC_040061.1),分别预测三穗鸭ORAI1基因CDS区T84C、C188T以及A471G突变对其mRNA二级结构的影响。对比参考序列,3个SNPs突变后其mRNA二级结构发生改变,并导致其自由能发生改变(图3)。与参考序列相比,T84C突变位点,自由能变化较小(由-249.00 kcal/mol变为 -247.60 kcal/mol),二级结构变化不是很明显;C188T(由-249.00 kcal/mol变为 -252.60 kcal/mol)和A471G(由-249.00 kcal/mol变为 -250.20 kcal/mol)突变位点自由能变化较大,二级结构改变较为明显;3个SNPs在突变后均引起自由能变化。
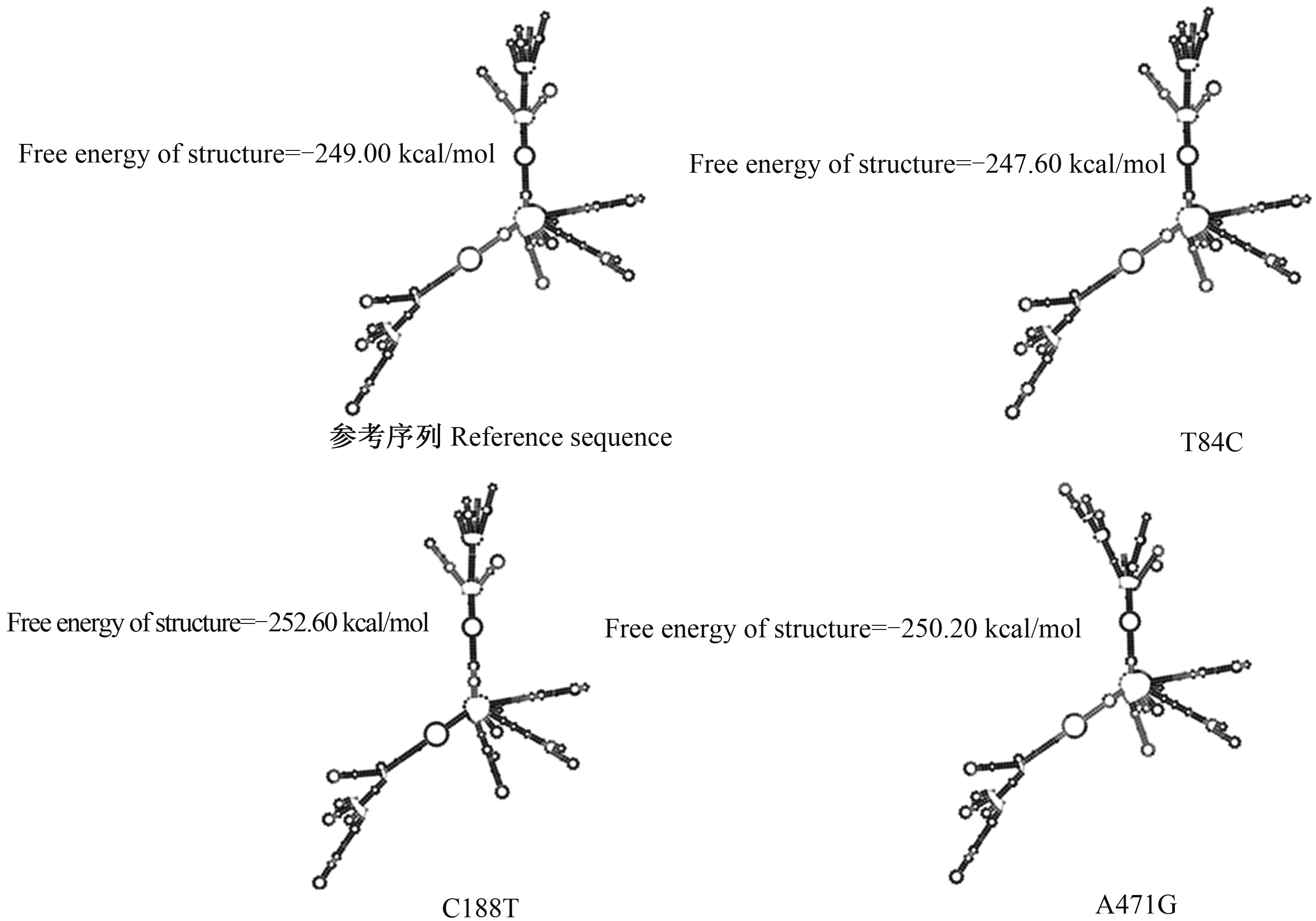
图3 三穗鸭ORAI1基因mRNA二级结构
2.4.2 三穗鸭ORAI1蛋白理化性质分析 三穗鸭ORAI1基因编码区全长792 bp,具有1个完整的开放性阅读框(Open reading frame,ORF),含有起始密码子(ATG)和终止密码子(TAA),编码263个氨基酸。从表3可以看出,丝氨酸(Ser)数量最多(32个),占整个氨基酸组成12.2%,半胱氨酸(Cys)、酪氨酸(Tyr)和色氨酸(Trp)数目最少(3个),占整个氨基酸组成1.1 %。正、负电荷残基总数分别是17、20个。对蛋白质空间结构起关键作用的半胱氨酸(Cys)3个;蛋白质分子式C1 288H2 053N351O370S10,理论等电点8.85,不稳定系数为49.59,大于40,属于不稳定蛋白。
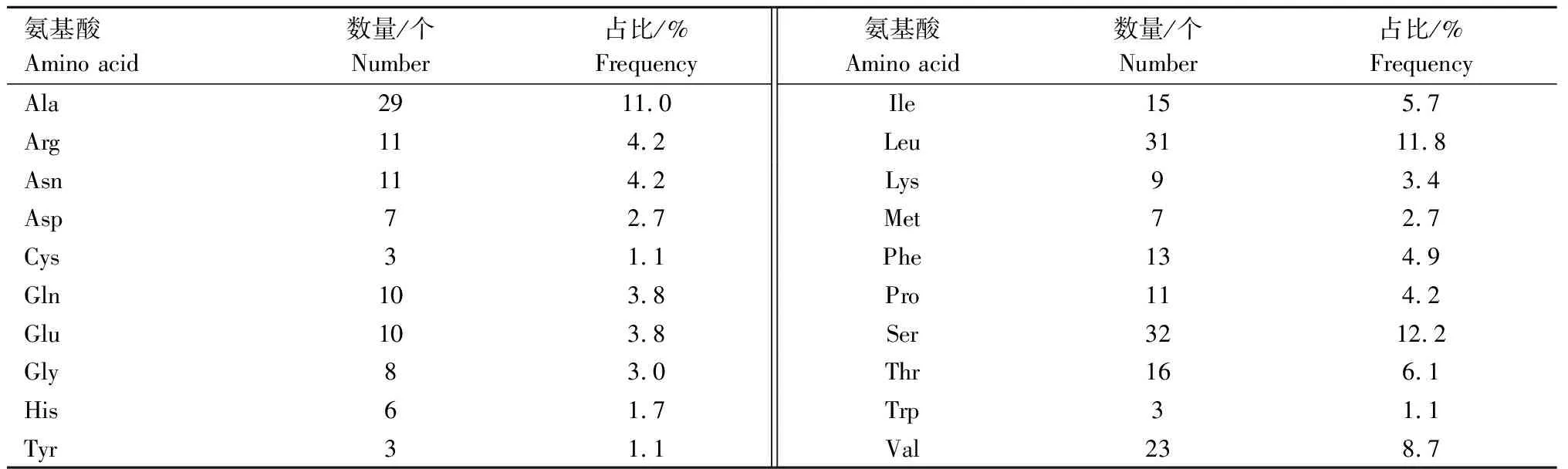
表3 三穗鸭ORAI1蛋白氨基酸组成
2.4.3 三穗鸭ORAI1蛋白亲水、疏水性预测 三穗鸭ORAI1蛋白亲水性和疏水性预测结果如图4所示,第230位的精氨酸(Arg)亲水性最强(-2.611),第213位的异亮氨酸(Ile)疏水性最强(3.133)。整个氨基酸肽链中疏水性氨基酸占47.1%,亲水性氨基酸占52.9%,总体体现为亲水性。
2.4.4 三穗鸭ORAI1蛋白信号肽分析 三穗鸭ORAI1蛋白信号肽预测结果如图5所示。蛋白质信号肽预测一般包含3个重要参数C值、Y值和S值。信号肽剪切位点C值最大,S值陡峭,Y值最高峰。可见,三穗鸭ORAI1蛋白不存在信号肽。
2.4.5 三穗鸭ORAI1蛋白的 N-糖基化位点分析 三穗鸭ORAI1蛋白中有2个潜在的N-糖基化位点,分别是Asn179和Asn186(图6)。蛋白质结构共价结合糖链结构形成糖基化位点,密切联系蛋白质的高级结构,能够定向调控蛋白质的功能,并参与信号转导、细胞分化和发育等功能[14]。据报道,蛋白质糖基化位点可修饰细胞内兰尼碱受体,影响钙离子释放,还能引起细胞膜电位以及钙通道的改变,影响细胞内钙离子水平[15-17]。由此预测,三穗鸭ORAI1蛋白可能调控机体钙离子浓度,从而与蛋壳品质密切相关。
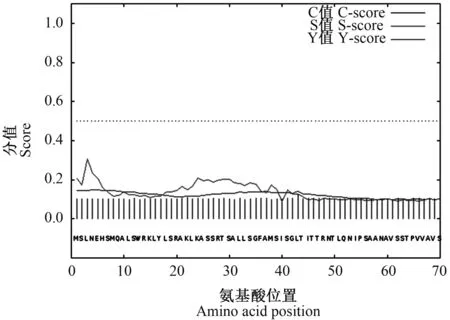
图5 三穗鸭ORAI1蛋白的信号肽分析结果Fig.5 Signal peptide analysis results of Sansui duck ORAI1 protein

图6 三穗鸭ORAI1蛋白的 N-糖基化位点预测结果
2.4.6 三穗鸭ORAI1蛋白的二级与三级结构预测 三穗鸭ORAI1蛋白的二级结构预测结果显示(图7),159个氨基酸构成α螺旋,占总氨基酸60.46%;78个氨基酸构成无规卷曲,占比29.66%;另外23个氨基酸和3个氨基酸分别构成延伸链和β转角,分别占整个氨基酸8.75%和1.14%。三级结构预测结果表明(图8),三穗鸭ORAI1蛋白主要由α螺旋和无规卷曲构成,这与二级结构预测结果一致。
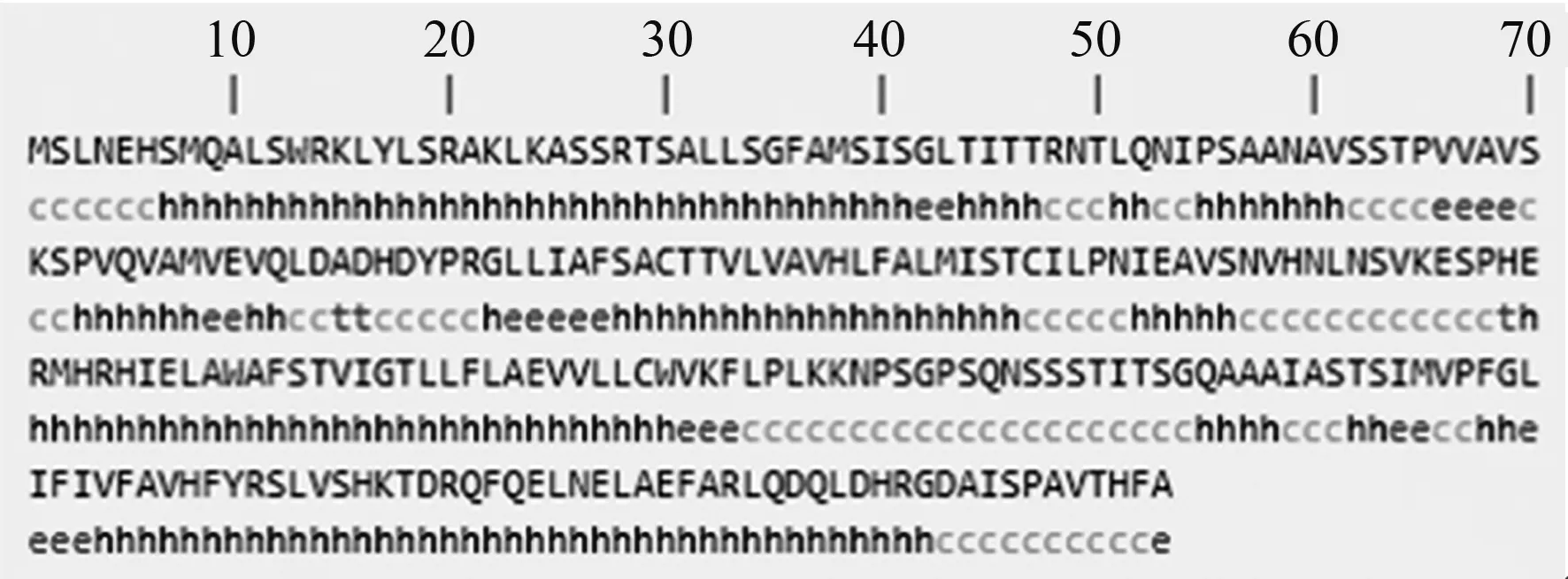
h:α螺旋;t:β转角;c:无规卷曲;e:延伸链
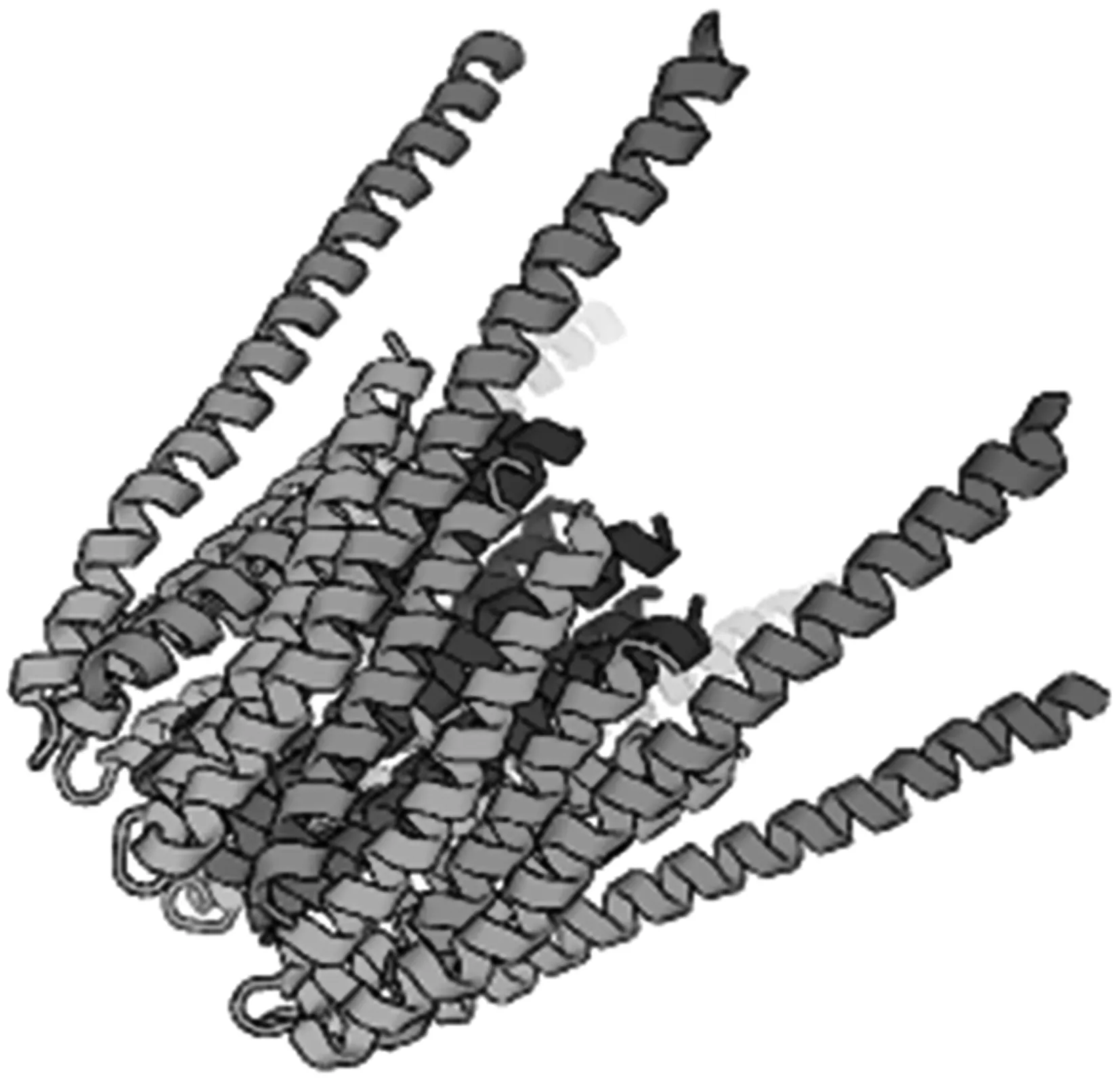
图8 三穗鸭ORAI1蛋白三级结构预测
3 结论与讨论
大量研究表明,ORAI1基因变异可改变人[18]、牛[19]、鼠[20]组织细胞内钙离子浓度以及机体钙离子释放量。YAMASHITA等[21]研究表明,ORAI1基因突变,可改变机体组织细胞钙离子浓度;同样,钙离子作为一种普遍存在的第二信使,正常的细胞和组织生理严格依赖于钙离子进入、储存和释放的精确调控,小鼠ORAI1基因变异引起细胞钙离子浓度改变,进而影响小鼠细胞的增殖和凋亡,特别T细胞和B细胞,对小鼠免疫产生极大影响[22]。由此推测,ORAI1基因也可能影响家禽机体钙离子浓度,诸如影响骨钙素沉积和钙蛋壳形成的主效基因或与控制该性状的主效基因连锁,能够作为提高地方鸭蛋壳品质的分子标记辅助选择。鸭ORAI1基因有3个外显子、2个内含子。本研究在三穗鸭ORAI1基因编码区发现3个SNPs(T84C、C188T、A471G),均在三穗鸭ORAI1基因第3外显子,其他2个外显子未发现多态性,揭示三穗鸭ORAI1基因第3外显子编码的氨基酸序列是蛋白质功能主要集中区域。3个SNPs未改变编码氨基酸,属于同义突变。可见,ORAI1基因序列和结构保守性较高,以及密码子简并性使得蛋白质未引起突变。研究发现,同义突变不会造成氨基酸的改变,但它们可能会反复改变调控剪接的外显子基序,如果这些突变位点与剪接位点相邻可能导致剪接位点失活,改变mRNA的剪切效率或准确性,从而影响蛋白质的功能、构象和表达水平,进而影响生物学功能[23-25]。对三穗鸭ORAI1基因的mRNA预测结果表明,3个SNPs突变后,其mRNA二级结构和自由能均发生了改变,其结构的稳定性也会受到影响。
蛋白质作为生命活动的承担者,在基因调控中扮演重要角色,同时蛋白质结构又影响着动物生命活动代谢,其一级结构、二级结构以及三级结构相互影响,发挥重要的生理功能。本研究发现,三穗鸭ORAI1蛋白由263个氨基酸折叠而成,为亲水性蛋白;不稳定系数为49.59(大于40),属于不稳定蛋白。在ORAI1蛋白氨基酸组成中,数目最多的是丝氨酸(Ser),比鸡多1个,比羊少3个;对蛋白质空间结构起关键作用的半胱氨酸(Cys)有3个,与鸡和羊数量相同,揭示在各种动物中ORAI1蛋白的半胱氨酸高度保守。本研究中,三穗鸭ORAI1蛋白二级结构主要包含由159个氨基酸构成的α螺旋以及由78个氨基酸构成的无规卷曲。按组成氨基酸的α螺旋比例大于46%、同时β转角比例小于5%的蛋白质二级结构分型标准,三穗鸭ORAI1蛋白二级结构属于非混合型蛋白,这种结构是否影响该蛋白质的能量代谢、运输和结合等过程,还有待进一步探讨。
