猪细小病毒病毒样颗粒的制备及其免疫评价
2020-05-15陈玉梅周景明刘东民马丽萍刘运超
陈玉梅,周景明,刘东民,马丽萍,冯 景,刘运超
(1.郑州大学 生命科学学院,河南 郑州 450001; 2.河南中泽生物工程有限公司,河南 郑州 450000)
猪细小病毒(Porcine parvovirus,PPV)为无囊膜的单链线状DNA病毒,二十面体等轴立体对称结构(T=1),病毒粒子呈六角形或圆形,平均直径20~26 nm,分子质量为5.3×106u,主要引起母猪的繁殖障碍,导致怀孕母猪的死胎和木乃伊胎、断奶仔猪多系统衰弱综合征等[1-2]。PPV在我国流行极为广泛,猪场检测病毒阳性率极高,给养猪业造成巨大的经济损失[3]。PPV 基因组包括2个开放阅读框(Open reading frame,ORF),ORF1编码非结构蛋白NS1、NS2 和NS3;ORF2 主要编码3种结构蛋白VP1、VP2 和VP3,它们的分子质量依次是83 ku、64 ku和60 ku[4-6]。VP1和VP2是从一组嵌套的编码序列中翻译出来的,较小的VP2是从与较大的VP1相同的RNA模板中剪接产生的,只是它们的氨基末端不同,而VP3是VP2的翻译后修饰产物。VP1蛋白大约占病毒粒子10%,主要在病毒复制和感染细胞时发挥作用,VP2蛋白是PPV的主要结构蛋白,约占病毒衣壳蛋白总量的60%以上,包含PPV主要的B细胞和T细胞抗原表位[7]。
目前,接种PPV疫苗仍是预防猪细小病毒感染的主要手段之一[8]。PPV疫苗的发展经历了弱毒苗到灭活苗的过程,出于对疫苗本身安全性的考虑,弱毒疫苗的毒株和灭活疫苗的灭活手段也在不断改进,但是弱毒疫苗毒力返强和灭活疫苗灭活失败的危险,始终是困扰现有PPV疫苗防治策略的一个重要问题[7]。同时,长期、大剂量、多频次PPV疫苗免疫给猪场的生产带来很大的经济和劳动量负担。通过系统研究野外分离株中VP蛋白的遗传多样性,发现了PPV新的变异株,传统的PPV疫苗株的抗血清不能有效中和这些病毒[9]。PPV的变异给猪场PPV的防控带来新的压力,而一种安全、高效的疫苗对PPV的清除工作尤其关键。重组表达的VP2蛋白能自我装配成病毒样颗粒(Virus-like particles,VLPs),是良好的抗原转运载体,并且能刺激机体产生中和抗体,因此,VP2蛋白对研究PPV疫苗具有很高的价值[6-7]。ANTONIS等[10]将PPVVP2基因成功克隆至杆状病毒表达系统,并在体外成功获得PPV VLPs,其免疫豚鼠和猪均能产生免疫保护反应。另外,国内外多个研究机构采用杆状病毒表达系统制备了VLPs,且该VLPs能够保护豚鼠抵抗PPV感染[11-15]。可见,PPV VP2在真核表达系统中能够顺利地形成VLPs结构,但是表达量较低,难以产业化应用。而采用原核表达系统表达VP2量较高,却难以实现可溶性表达,更难于形成VLPs结构。目前在原核表达系统中获得高活性的PPV VP2蛋白仍然是一个重大挑战,司艳红等[16]将PPVVP2基因克隆到pET32a上,在E.coli中成功表达了以包涵体形式存在的VP2与Trx-His-tag的融合蛋白,经复性处理后未能得到VLPs。鉴于此,采用改进的大肠杆菌表达系统体外表达获得可溶性PPV VP2蛋白,经体外装配形成VLPs,通过进一步研究VLPs疫苗刺激昆明鼠产生免疫应答效果,分析VLPs刺激机体产生特异性抗体、血凝抑制抗体及中和抗体的情况,比较PPV VLPs疫苗与商品化灭活疫苗的免疫效果,为PPV VLPs疫苗的研制奠定基础。
1 材料和方法
1.1 载体、细胞、病毒及供试动物
pET28a等质粒和菌种均由郑州大学生命科学学院抗体工程与分子免疫学实验室保存。伴侣蛋白Tf16表达质粒购自TaKaRa公司。
PK-15细胞及PPV-7909标准毒株由郑州大学生命科学学院抗体工程与分子免疫学实验室培养并保存。
供试动物:20只4周龄健康雌性昆明鼠购买自河南省郑州市实验动物中心。
1.2 试剂
Prime STAR Max DNA Polymerase、BamH Ⅰ、XhoⅠ、T4 DNA Ligase等分子生物学试剂均购自TaKaRa公司;Anti-6×His-tag antibody购自Proteintech公司;HRP标记的羊抗鼠IgG购自Abcam公司;IPTG、卡那霉素(Kan)、氯霉素(Cm)、L-阿拉伯糖等试剂均购自索莱宝科技有限公司;Ni-NTA亲和层析填料(Ni2+柱)购自Norvagen公司;Universal DNA回收试剂盒、质粒提取试剂盒均购自天根生化科技有限公司;BCA蛋白质浓度测定试剂盒购自Thermo公司;胰酶、FBS购自Gibco公司,弗氏完全/不完全佐剂购自Sigma公司。
1.3 PPV VP2原核表达载体的构建
以PPV的疫苗株WH-1株为研究对象,在GenBank中查询PPV VP2蛋白序列(China株,AY5883318),分析PPV VP2的基因和氨基酸序列,按照大肠杆菌密码子偏爱性,同时兼顾GC含量、mRNA的二级结构、核糖体结合位点和chi位点、限制性酶切位点等信息,优化并合成PPV VP2蛋白的基因。设计1对特异性引物,F:GGATCCATGTCGGAAAATGTGGAACA(BamH Ⅰ)。R:CCTCGAGTTAATACAGTTTCCGTGGAATGA(XhoⅠ)。将优化合成的PPVVP2基因经BamH Ⅰ和XhoⅠ双酶切后亚克隆至原核表达载体pET28a中,经菌液PCR、双酶切鉴定后送样测序,测序结果用DNAStar软件进行分析。将测序正确的阳性质粒转化E.coliBL21(DE3)感受态细胞,用于重组蛋白表达。
1.4 分子伴侣共表达菌株的构建
将含有阳性重组载体pET28a-VP2的BL21菌株制成感受态细胞,将伴侣蛋白质粒pTf16转化上述感受态细胞,涂布含Kan+/Cm+双抗性的固体LB培养基上,倒置37 ℃恒温过夜。挑选6个单克隆接种于含Kan+/Cm+双抗性液体LB培养基中,37 ℃ 220 r/min振荡培养过夜,筛选共表达阳性转化子。
1.5 重组蛋白初步表达与可溶性分析
分别将含pTf16与不含pTf16的pET28a-VP2表达菌体按 1∶1 000比例接种于Kan+/Cm+LB培养液中,37 ℃、220 r/min 过夜培养活化,将活化菌体按 1∶100比例接种于含Kan+/Cm+双抗性的LB培养液中,37 ℃、220 r/min 培养2 h。当OD600为0.6~0.8,将含pTf16质粒的pET28a-VP2表达菌中加入终质量浓度为 2 mg/mL的L-阿拉伯糖和0.5 mmol/L的IPTG,37 ℃、220 r/min振荡培养过夜;不含pTf16的表达菌只加入IPTG进行诱导。收集诱导后菌体并分别进行超声破碎,SDS-PAGE及Western blot分析表达产物。
1.6 重组蛋白表达条件优化
分别从诱导温度、诱导时间、IPTG浓度、质量浓度等方面进行了优化,诱导温度分别设为16、25、30、37 ℃,0.5 mmol/L IPTG 诱导表达10 h;IPTG浓度分别选择0.1、0.3、0.5、0.7、1.0 mmol/L 5个梯度(在最佳温度条件下诱导8 h筛选);共设置6、12、16、20 h 4个诱导时间收获菌体(在IPTG浓度为0.5 mmol/L、最佳温度下诱导)。分别用12%分离凝胶进行SDS-PAGE鉴定,以确定重组蛋白的最佳诱导表达条件。
1.7 重组表达蛋白的纯化
样品前处理:收集诱导表达菌体,用pH值8.0的50 mmol/L Tris-HCl、300 mmol/L NaCl缓冲液重悬后,进行超声破碎,12 000 r/min离心30 min,取超声上清用于纯化;分别用20%、30%、40%及50%的(NH4)2SO4沉淀对表达的重组PPV VP2蛋白进行粗纯,经SDS-PAGE分析粗纯效果;经透析除去(NH4)2SO4,再选用Ni2+柱进行亲和层析纯化,采用咪唑浓度梯度洗脱法,用SDS-PAGE、Western blot检测重组蛋白纯度,BCA法测定重组蛋白含量。
1.8 PPV VLPs组装及检测
1.8.1 组装 在获得高纯度PPV VP2蛋白的基础上优化VLPs装配缓冲液条件,研究 VP2蛋白在体外组装成VLPs的条件,用pH值8.0的50 mmol/L Tris-HCl作为基础缓冲液,分别选择NaCl浓度为50、100、150、200、250 mmol/L 5个梯度,探讨盐离子浓度对VLPs结构组装效率、稳定性的影响。
1.8.2 形成情况检测 通过透射扫描电镜(TEM)以及动态光散射技术(DLS)观察VLPs形成情况。
1.8.3 血凝活性检测 采用血凝试验测定VLPs的血凝活性,取96孔V型板,每孔加入PBS 25 μL,将VLPs进行系列倍比稀释,至11孔后吸取25 μL弃去,第12孔为PBS对照组,稀释后每孔再加入PBS 25 μL,最后每孔加入25 μL 1%小鼠红细胞悬液,微量振荡器轻微振荡摇匀,置于室温(20~25 ℃),静止1 h后判定结果,以能使100%红细胞凝集的VLPs最高稀释倍数作为判定终点。
1.9 VLPs的免疫评价
1.9.1 免疫程序 选取20只健康的昆明鼠随机分成4组,每组5只: A组免疫30 μg VLPs;B组免疫15 μg VLPs;C组免疫PPV灭活苗100 μL;D组为PBS对照组,免疫100 μL PBS。与佐剂分别配比后乳化免疫鼠(皮下多点注射),首免用弗氏完全佐剂,加强免疫选用弗氏不完全佐剂,首免后14 d加强免疫一次。免疫后0、7、14、21、28、35、42、49、56 d断尾采血收集血清,采用ELISA、血凝抑制试验(HI)和病毒中和试验(VN)检测小鼠的抗体应答情况。
1.9.2 ELISA测定抗体效价 用碳酸盐缓冲液(CBS)将纯化的VLPs稀释成2 μg/mL,按50 μL/孔的量加入96孔ELISA板内,4 ℃包被过夜; PBST洗3次,含5%脱脂奶粉的封闭液37 ℃封闭2 h;PBST洗3次,一抗用待检血清,以1∶100开始按2倍倍比稀释(1∶100、1∶200……1∶102 400),二抗用HRP标记的羊抗鼠IgG(1∶5 000),测定抗体效价。
1.9.3 HI检测 配制4个100%血凝单位(即4HA100)VLPs与倍比稀释的待检血清(1∶100、1∶200……1∶102 400)等体积混匀,每孔50 μL加入96孔血凝板,再加入50 μL 1%小鼠红细胞悬液,摇匀,室温放置1 h;判定结果:HI效价即为完全抑制4HA100单位抗原凝集的血清最高稀释度。
1.9.4 病毒中和试验 提前将PK15细胞接种于96孔培养板中;随即稀释PPV悬液至200个TCID50;将待检血清每孔按50 μL在新的96孔板上做2倍连续倍比稀释(1∶10、1∶20……1∶5 120),随后与稀释好的病毒悬液1∶1混合,放置1 h;将病毒与血清混合液感染PK15细胞;观察细胞病变情况,计算血清的中和抗体效价。
2 结果与分析
2.1 PPV VP2蛋白原核表达载体的构建及重组蛋白的表达分析
以优化合成的VP2基因为模板,应用高保真预混酶Prime STAR Max DNA Polymerase对VP2序列进行扩增,将其插入pET28a载体构建重组表达载体pET28a-VP2,并转化DH5α感受态细胞;经菌液PCR、双酶切鉴定及测序证实后的阳性质粒转化BL21(DE3)并制成感受态细胞,将伴侣蛋白质粒pTf16转化上述感受态细胞,涂布于含Kan+/Cm+双抗性固体LB培养基上,37 ℃倒置培养过夜。挑选6个单克隆于Kan+/Cm+双抗LB液体培养基中,37 ℃、220 r/min振荡培养筛选共表达阳性转化子。共表达菌经IPTG及L-阿拉伯糖初步诱导后,收集菌体经超声破碎后用SDS-PAGE及Western blot进行检测,结果显示,在可溶性上清和沉淀中均检测到大小约64 ku的目的蛋白(图1A),当与伴侣蛋白Tf16共表达时,VP2蛋白的可溶性表达量明显增加(图1B),其中图1B中第3孔在约56 ku位置的蛋白是伴侣蛋白Tf16。
2.2 重组VP2蛋白的表达条件优化
为了进一步提高重组VP2蛋白的可溶性表达量,分别从诱导时间、温度、IPTG浓度对表达条件进行优化,SDS-PAGE结果显示,25 ℃和30 ℃诱导时重组VP2蛋白可溶性表达量最高,选择30 ℃进行诱导表达(图2A);而IPTG浓度变化对目的蛋白可溶性表达量的影响并不大,故选择低剂量的0.1 mmol/L作为最佳浓度(图2B);诱导表达12 h时重组VP2蛋白可溶性表达量已达最高,继续培养目的蛋白的含量并没有明显提高(图2C)。综上,最终得出目的蛋白最佳诱导表达条件:0.1 mmol/L IPTG在 30 ℃诱导表达12 h,可获得较高表达量的可溶性VP2蛋白。
2.3 重组蛋白VP2的纯化
采用硫酸铵沉淀法进行第一步纯化,SDS-PAGE结果显示,重组VP2蛋白在硫酸铵含量为20%时已经开始出现沉淀,到40%时可完全沉淀(图3A),所以本研究采用40%硫酸铵对重组VP2蛋白进行纯化。用Tris-HCl缓冲液溶解后,透析除去硫酸铵,再进行Ni2+亲和层析纯化,经咪唑梯度洗脱分离纯化重组VP2蛋白,SDS-PAGE及Western blot检测结果表明,经二步法纯化获得的重组VP2蛋白的纯度约为90%(图3B)。

A:M.Marker; 1、3、5、7分别为16、25、30、37 ℃诱导表达后的超声上清;2、4、6、8分别为16、25、30、37 ℃诱导表达后的超声沉淀。B:M.Marker; 1、3、5、7分别为IPTG浓度为0.1、0.3、0.5、0.7 mmol/L诱导表达后的超声上清;2、4、6、8分别为IPTG浓度为0.1、0.3、0.5、0.7 mmol/L诱导表达后的超声沉淀。C:M.Marker; 1、3、5、7分别为诱导6、12、16、20 h的超声上清; 2、4、6、8分别为诱导6、12、16、20 h的超声沉淀A:M.Marker; 1,3,5,7 represent ultrasonic supernatant induced at 16 ℃,25 ℃,30 ℃ and 37 ℃,respectively; 2,4,6,8 represent ultrasonic precipitation induced at 16 ℃,25 ℃,30 ℃ and 37 ℃,respectively. B:M.Marker; 1,3,5,7 represent ultrasonic supernatant induced at the IPTG concentration of 0.1,0.3,0.5,0.7 mmol/L,respectively; 2,4,6,8 represent ultrasonic precipitation induced at the IPTG concentration of 0.1,0.3,0.5,0.7 mmol/L,respectively. C:M.Marker; 1,3,5,7 represent ultrasonic supernatant induced at 6 h,12 h,16 h and 20 h,respectively; 2,4,6,8 represent ultrasonic precipitation induced at 6 h,12 h,16 h and 20 h,respectively

A:硫酸铵沉淀初步纯化VP2蛋白。M.Marker;1—4.分别为20%、30%、40%及50% (NH4)2SO4沉淀。B: Ni2+亲和层析纯化VP2蛋白。 M.Marker;1—2.Ni2+纯化的VP2蛋白A: (NH4)2SO4 purification of VP2 protein. M.Marker; 1—4.20%,30%,40% and 50% (NH4)2SO4 precipitation. B: Ni2+ affinity chromatography.M.Marker; 1—2.Ni2+purification of VP2 protein
2.4 PPV VLPs组装和检测
分析NaCl浓度对VP2组装形成VLPs的影响,通过透射扫描电镜(TEM)(图4A)以及动态光散射技术(DLS)(图4B)观察VLPs形成情况,结果显示,从大肠杆菌表达系统获得的重组VP2蛋白可以在体外组装形成结构相对较均一、大小约20 nm的VLPs,pH值8.0的Tris缓冲液中,当NaCl浓度为150 mmol/L时VLPs组装效率最高。检测VLPs的血凝活性,证实制备的VLPs血凝效价为1∶1 024(图4C),说明该VLPs正确展示了PPV的血凝活性表位,结构接近天然PPV病毒。

A:电镜结果;B:动态光散射结果;C:血凝试验结果(VLPs稀释倍数分别从1∶8到1∶1 024)A:The results of electron microscopy; B:The results of dynamic light scattering; C:The results of Hemagglutination test(Dilution ratio of VLPs is from 1∶8 to 1∶1 024,respectively)图4 PPV VLPs组装和检测 Fig.4 Assembly and inspection of PPV VLPs
2.5 PPV VLPs免疫效果
采用ELISA检测昆明鼠的抗体应答情况,结果发现,VLPs组免疫血清特异性抗体效价最高可达1∶25 600,高剂量组略高于低剂量组;无论是高剂量还是低剂量组,抗体水平均略高于灭活疫苗组(图5)。

图5 免疫血清效价ELISA测定 Fig.5 The immunity serum titer measured by ELISA
病毒中和试验显示,VLPs能有效刺激小鼠产生较高效价的中和抗体,在免疫后35 d,A组高剂量免疫组(VLPs 30 μg)的抗体水平略高于B组低剂量组(VLPs 15 μg),而在免疫后42 d时低剂量组中和抗体水平则略高于高剂量组;PPV灭活疫苗组和PBS免疫组都几乎没有中和抗体的产生(图6A)。VLPs免疫后,15 μg VLPs比30 μg VLPs免疫组的HI抗体水平高,而PPV灭活苗免疫组几乎没有HI抗体产生,PBS免疫对照组在整个免疫期都没有HI抗体的产生(图6B)。
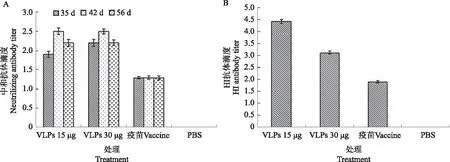
图6 免疫血清中和抗体和HI抗体检测 Fig.6 Detection of neutralizing antibody and HI antibody
3 结论与讨论
原核表达系统可以实现目的蛋白的高效表达、降低生产成本,在兽用疫苗市场有广泛应用前景。PPV VP2蛋白在体外经重组表达后能自我装配成VLPs结构,能刺激机体产生中和抗体。因此,实现VP2蛋白在原核表达系统的高效可溶性表达对PPV VLPs疫苗研究具有重要意义。国内外学者在原核表达PPV VP2 蛋白上开展了一系列研究,司艳红等[16]在E.coli中成功表达了以包涵体形式存在的VP2融合蛋白,经复性处理后未能得到VLPs;宋品等[17]在E.coli中获得与SUMO标签融合表达的PPV VP2蛋白,经切除标签获得VLPs。司艳红等[16]虽然在原核表达系统中表达获得重组VP2蛋白,但是却难以实现可溶性表达,更难于形成VLPs结构;宋品等[17]在原核表达系统中获得带有较大融合标签的重组VP2蛋白,但在后续组装VLPs过程中,需要切除标签,增加操作难度,提高了VLPs制备成本。本研究采用原核表达系统成功获得可溶性PPV VP2蛋白,用DNAStar软件分析PPV VP2蛋白氨基酸序列,VP2蛋白共含有579个氨基酸,其分子质量约为64.3 ku。SDS-PAGE结果显示,重组VP2蛋白在约64 ku处有明显目的条带,通过与伴侣蛋白共表达的方式可以明显增加目的蛋白的可溶性表达量,提高重组蛋白活性。经硫酸铵盐析沉淀和Ni2+柱亲和层析2步纯化法获得纯度约90%的重组VP2蛋白。由于PPV VLPs形成效率显著影响VLPs疫苗的免疫保护效果,经VLPs组装条件的优化,本研究发现,PPV VP2蛋白在pH值 8.0的Tris缓冲液、150 mmol/L NaCl浓度条件下VLPs形成率最高,最终获得与天然PPV病毒结构类似的VLPs结构,透射电镜和动态光散射检测结果表明,制备的VLPs大小约20 nm,结构均一、形状规则,且具有血凝活性,说明该VLPs能够正确展示PPV的血凝活性表位,与前述杆状病毒表达系统中获得的VLPs结构类似[10-15]。进一步用PPV VLPs疫苗免疫昆明鼠进行动物试验,证明制备的VLPs疫苗刺激机体产生的特异性抗体效价高达1∶25 600,说明制备的VLPs疫苗能有效刺激机体B淋巴细胞活化,产生明显优于PPV灭活疫苗特异性抗体,有良好的应用前景。
