基于GC-TOF-MS代谢组学研究栝楼桂枝汤对脑缺血大鼠的作用机制
2020-05-13郭双戴成球金钦张玉琴许文黄鸣清林羽徐伟
郭双,戴成球,金钦,张玉琴,许文*,黄鸣清*,林羽,徐伟
(1.福建中医药大学药学院,福建 福州 350122;2.福建中医药大学生物医药研发中心,福建 福州 350122)
脑卒中又称中风,发病迅速,症状多样,致残率高,死亡率高,近年已成为导致死亡的主要原因,严重威胁着人类的生命[1]。其中缺血性脑卒中是最常见的脑卒中类型,是由于血管堵塞导致的大脑血流急剧减少甚至供应中断,继而引发局部脑组织坏死,脑卒中在我国仍然是第一大致死性疾病[2]。
栝楼桂枝汤来源于张仲景的《金匮要略》,由天花粉、桂枝、白芍、甘草、生姜、大枣六味药组成,具有祛风和营,生津柔筋之功用。陈立典教授结合多年的临床经验将栝楼桂枝汤应用于脑卒中后的康复取得良好的疗效,目前该方颗粒剂经申报批准为福建省第二人民医院院内制剂(批件号:闽 2013S0001)[3-4]。前期课题组开展了该方对海马神经细胞及中脑动脉闭塞(MCAO)模型大鼠的作用[5],发现栝楼桂枝汤对缺血性脑卒中大鼠及原代海马神经元有一定的保护作用,其保护作用与其抗细胞凋亡作用有关。
代谢组学是系统生物学的重要组成部分,主要指特定时期内由细胞、组织或生物体产生的所有小分子量代谢物总和[6],它采用了系统生物学的策略和方法,基于疾病和药物干预下的系统代谢网络的整体性和动态性的变化,评价中药复方的整体效应及调控机制。本实验在前期课题组对于栝楼桂枝汤血清药物化学分析[7]及对脑缺血再灌注损伤的治疗作用的研究基础上,首次采用气相色谱-高分辨率飞行时间质谱联用(GC-TOF-MS)的大鼠血清代谢组学方法,通过分析栝楼桂枝汤对MCAO大鼠的内源性化合物水平的影响,找出潜在的小分子生物标志物,并建立栝楼桂枝汤治疗缺血性脑卒中代谢途径分析方法,为其对机体的整体作用效应和分子调控机制提供科学依据。
1 仪器与材料
1.1 实验动物及饲养环境 健康成年雄性SD大鼠30只,SPF级,体质量260~300 g,购于上海斯莱克实验动物有限公司,实验动物合格证号:2007000509960,许可证号:SC-SCXK (沪)2012-0002。实验动物饲养于福建中医药大学实验动物中心SPF级实验室,温度为22~24 ℃,相对湿度50%~70%;标准饲料及灭菌洁净水;自由摄食饮水;每天定时更换垫料,保持干燥;光/暗周期12/12 h;医学实验动物环境设施许可证号:SYXK (闽)2014-0005。
1.2 药品与试剂 栝楼桂枝汤(院内制剂,颗粒剂);内标:L-2-氯苯丙氨酸(批号:103616-89-3,≥98%),购自上海恒柏生物科技有限公司;衍生化试剂:BSTFA (含1% TMCS,V/V),购自 Regis Technologies,Inc.;甲醇(色谱纯,Merck公司);乙腈(色谱纯,Merck公司);甲酸(色谱级,阿拉丁试剂上海有限公司);水为超纯水,由Milli-Q纯水系统制备(美国Milli-Q公司)。
1.3 主要仪器设备 GC色谱仪(Agilent 7890B,美国Agilent公司);飞行时间质谱仪(LECO Chroma TOF PEGASUS HT,美国LECO公司);低温高速离心机(Eppendorf公司);高速涡旋仪(江苏海门市其林贝尔仪器制造有限公司)。
2 方法
2.1 栝楼桂枝汤灌胃液的制备方法 取栝楼桂枝汤颗粒100 g,加入10倍量50%乙醇,加热回流提取2次,每次1 h,合并滤液减压蒸馏至无醇味,制得0.9 g·mL-1的栝楼桂枝汤提取液。根据人临床用量换算成大鼠灌胃给药剂量为每天3.6 g·kg-1[5]。
2.2 动物分组 实验动物分为3组:假手术组(S组)、MCAO模型组(M组)、栝楼桂枝汤给药组(T组),每组10只,造模后1 h,灌胃给药栝楼桂枝汤4 mL·kg-1,每天给药1次,连续给药7 d,假手术组和模型组给予等容积的生理盐水。
2.3 大鼠MCAO模型的建立 参考Longa和O Neil的方法[5]:禁食不禁水12 h的SD大鼠用10%水合氯醛麻醉后取仰卧位,取出颈前被毛、进行常规消毒,颈部正中切口,仔细分离左侧的颈总动脉(common carotid artery,CCA),避免损伤迷走神经及颈交感神经,并向上分离颈外动脉(external carotid artery,ECA)和颈内动脉(internal carotid artery,ICA)。在距离颈总动脉分叉较远处用医用缝合线结扎总动脉和颈外动脉,将颈总动脉和颈内动脉拉成一直线,用动脉夹暂时阻断颈内动脉血流,在颈总动脉血管壁上剪一小口,把粗细适中的线栓自颈总动脉切口插入,沿着颈总动脉分叉处缓慢插入颈内动脉,遇有轻微阻力即可。此时线栓的膨大顶端即堵塞大脑中动脉的开口,再用缝合线固定住线栓,常规消毒后缝合皮肤切口。假手术组动物手术步骤类似,但未做线栓闭塞中动脉。造模后的大鼠轻轻转移到鼠笼中,平躺在室温垫料上以保持大鼠正常体温。参照Longa评定法,进行神经功能损伤程度的评价,1~3分代表模型制作成功,可用于实验。
2.4 样品收集与前处理 各组动物取血离心,精密吸取50 μL血浆样本,加入0.2 mL甲醇,再加入10 μL L-2-氯苯丙氨酸,漩涡混匀10 s;紧接着将样本4 ℃,1 300 rpm离心15 min;小心地取出0.2 mL上清于2 mL进样瓶(甲烷硅基化的)中,每个样本各取14 μL混合成QC样本。在真空浓缩器中干燥提取物;向干燥后的代谢物加入30 μL甲氧胺盐试剂(甲氧胺盐酸盐,溶于吡啶20 mg·mL-1),轻轻混匀后,放入烘箱中80 ℃孵30 min;向每个样品中迅速加入40 μL BSTFA(含有1% TCMS,V/V),将混合物70 ℃孵育2 h;冷却至室温,向混样的样本中加入10 μL FAMEs(饱和脂肪酸甲酯标准混合液,溶于氯仿C8~C16:1 mg·mL-1;C18~C24:0.5 mg·mL-1);混匀,上机检测。
2.5 气相色谱-飞行时间质谱联用(GC-TOF-MS)分析 GC-TOF-MS具体分析条件如下:进样量1 μL,不分流模式;载气为氦气;前进样口吹扫流速为3 mL·min-1;柱流速:1 mL·min;柱温:50 ℃保持1 min,以每分钟20 ℃的速率上升至300 ℃,保持6.5 min;前进样口温度:280 ℃;传输线温度:270 ℃;离子源温度:220 ℃;电离电压:-70 eV;扫描方式:m/z:50→500;扫描速率:20 spectra/sec;溶剂延迟:371 s。
2.6 数据处理 按照上述实验条件,得到了大鼠血清中内源性代谢物组的GC-TOF-MS数据,运用LECO公司的Chroma TOF 4.3X软件和LECO-Fiehn Rtx5数据库,对数据进行原始峰测量、基线校准、基线过滤、峰识别、峰对准、峰面积积分等计算。使用SIMCA软件(V14.1,MKS Data Analytics Solutions,Umea,Sweden)对归一化后的数据进行多元变量模式识别分析。数据经多维统计后,找出的差异性代谢物,主要通过检索NIST质谱库、HMDB数据库(http://www.hmdb.ca/)比对、对照品库比对等方法对生物标志物进行鉴定。
3 结果
3.1 大鼠血浆样品GC-TOF-MS总离子流图 在代谢组学中需要对大量样品进行分析,经过分析大鼠血清样品的代表性GC-MS总离子流图如图1所示。每种物质的峰形良好,峰彼此分离很好,说明分析条件适用于本研究中样品的检测。
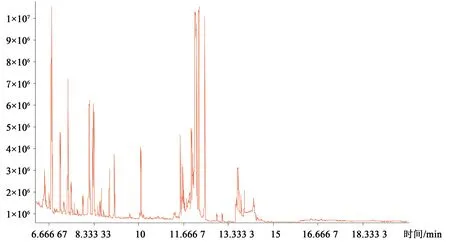
图1 大鼠血清样品的代表性GC-TOF-MS总离子流图
3.2 多维统计学分析结果
3.2.1 主成分(PCA)分析 色谱质谱数据经过Chroma TOF 4.3X软件进行数据提取和前处理,使用SIMCA软件进行多元变量模式识别分析。为了考察MCAO造模造成的大鼠体内代谢变化,首先采用了非监督的PCA方法,PCA分析采用LOG转换+CTR格式化处理的数据标度换算方式,对数据进行自动建模分析。
在PCA图中,每一个点代表一个血浆样品,样品在空间分布不同代表不同组别样本的代谢状况。TOTAL PCA得分图如图2所示,结果表明组别之间的区分在得分图上较为显著,给药组样本在PCA得分图空间上明显从模型组向正常对照组方向回归,样本全部处于95%置信区间(Hotelling T2 ellipse)内,累计的解释率R2X=0.344 cum,Q2=0.013 8 cum。模型组与正常组、模型组与给药组之间在PCA评分图中显示出清晰的区分,说明两组别间的动物在代谢谱上有着显著性的差异,PCA区分良好。
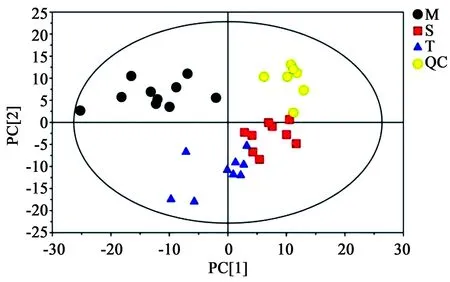
图2 TOTAL PCA得分图
3.2.2 正交偏最小二乘法-判别分析(OPLS-DA) 与无监督的PCA相比,有监督的正交偏最小二乘判别分析(OPLS-DA)更关注在聚类中做出显著贡献的化合物,本实验进一步采用OPLS-DA来筛选假手术对照组、模型组和给药组之间的差异代谢物。这种监督的方法建立的模型,可以找到伴随模型贡献较大的代谢物变量,最大化地凸显模型内部与预测主成分(predictive component)相关的差异;M组对S组的OPLS-DA得分图和置换检验图如图3所示。代表变量的分数R2X和Q2Y是指模型解释率和预测准确程度,Q2Y的累计量都接近于1的时候,意味着模型比较理想,有很好的解释率和预测率。本实验得到的模型中Q2Y达到0.989,这说明模型的区分程度和预测程度都较好。置换检验R2=0.88可以体现出模型具有良好的稳定性,从图3中可以清晰地看到正常组样本与模型样本能完全分开,揭示缺血性脑卒中可导致大鼠的血清代谢组出现显著代谢变化。同样,从图4中可以看出M组对T组的OPLS-DA得分下模型组和给药组大鼠代谢谱能完全区分。模型的Q2Y达到了0.989,置换检验截距R2=0.843同样体现出所建立的计算模型具有良好的稳定性。
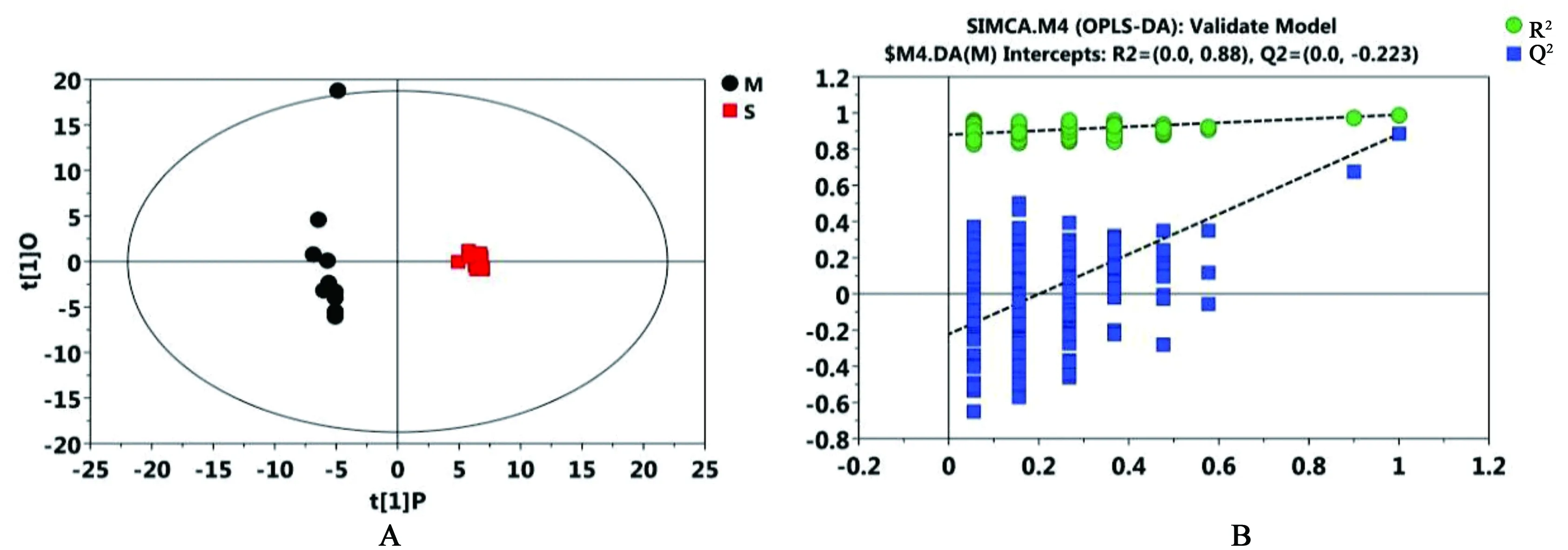
图3 M组对S组的OPLS-DA得分图(A)和M组对S组的置换检验图(B)
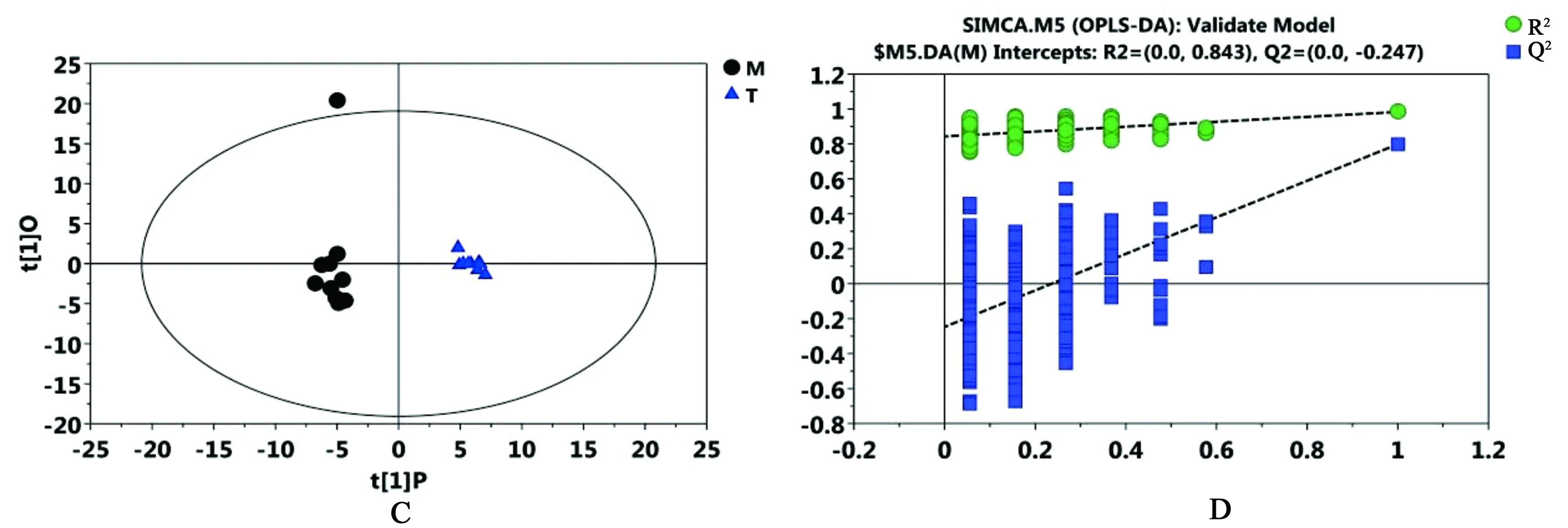
图4 M组对T组的OPLS-DA得分图(C)和M组对T组的置换检验图(D)
3.3 差异代谢物的筛选及鉴定 为了找到与各组别动物高度相关的代谢物,通过OPLS-DA分析过滤掉了不相关的正交信号,获得OPLS-DA载荷图,见图3~4。图上每一个点代表了样本中检测到一个代谢物,距离原点越远,表示与主成分的差异越大,对组间的分类贡献越大,载荷图的左右两端物质可视引起两组分类差异的主要代谢物,即为潜在的差异标志物。以第一主成分的VIP值(Variable Importance in the Projection,卡值标准VIP>1),学生氏t检验(Student′s t-test)的P值(P-value,P<0.05)来寻找差异代谢物,并通过检索NIST质谱库、HMDB数据库(http://www.hmdb.ca)比对、对照品比对等方法对差异代谢物进行结构指认,鉴别出这13个差异代谢物见表1。
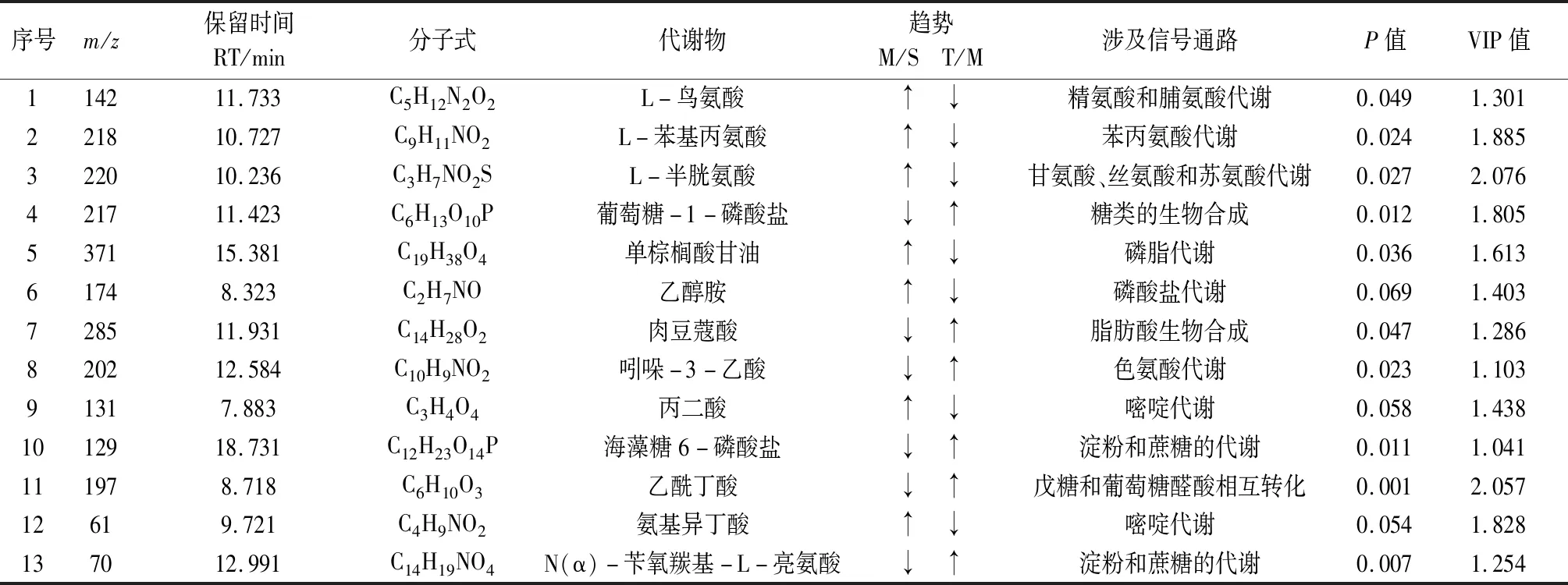
表1 GLGZD治疗的缺血性脑卒中相关的代谢标志物及其代谢途径
3.4 代谢通路分析 首先将13个差异代谢物通过KEGG、PubChem等常用代谢物数据库进行映射;接下来选择大鼠(rattus norvegicus)物种数据库搜索,最后进行代谢通路富集和拓扑分析,所得通路分析图见图5。其中,X轴(pathway impact)代表通路拓扑分析影响因子,Y轴[-log(P)]代表通路富集分析的P值(取负对数)。与此同时,圆圈大小与颜色深浅分别表示通路拓扑分析影响力值和通路富集分析P值(取负对数);圆圈越大,拓扑分析影响力越大;颜色越深(越红),P值越小;反之亦然。如图5所示,结果表明苯丙氨酸、酪氨酸和色氨酸生物合成、戊糖和葡萄糖醛酸相互转化、色氨酸代谢、嘧啶代谢和甘油磷脂代谢是其重要的相关代谢途径。
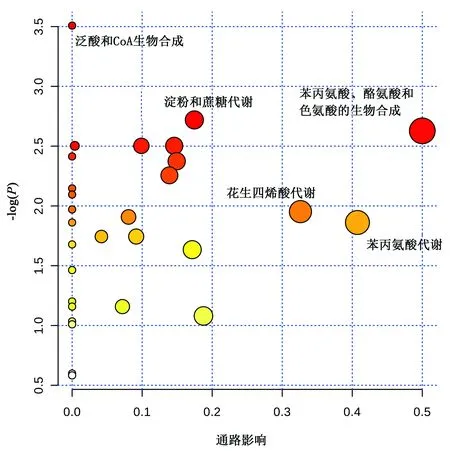
图5 代谢通路分析
4 讨论
4.1 栝楼桂枝汤对能量代谢的影响 大脑是碳水化合物和氧气的主要消耗者,且大脑中无长期的能量储存,需要持续供应氧气和葡萄糖来提供能量消耗,因此极易受到血液供应不足的影响。缺血性脑卒中引起的脑缺血阻断了大脑中氧气和葡萄糖的供应,破坏了三羧酸(TCA)循环,继而导致大脑的能量供应模式从有氧代谢转向无氧代谢[8-10]。结果表明MCAO模型大鼠在给予与GLGZD治疗后代谢物中葡萄糖-1-磷酸盐、海藻糖 6-磷酸、4-乙酰丁酸、N(α)-苄氧羰基-L-亮氨酸含量明显升高,促进淀粉和蔗糖的代谢、戊糖和葡萄糖醛酸相互转化,增加缺血、缺氧条件下的能量代谢,同时代谢物吲哚乙酸含量明显增高、丙二酸含量降低;吲哚乙酸是色氨酸的代谢分解产物,提示GLGZD可能通过促进蛋白质、氨基酸分解代谢来增加能量供应,而丙二酸是竞争性抑制剂,对电子传递链中的琥珀酸脱氢酶(复合物Ⅱ)起作用,丙二酸下降可降低对能量供应的抑制[11]。
4.2 栝楼桂枝汤对脂质代谢的影响 神经元膜富含多不饱和脂肪酸,对自由基的攻击特别敏感,而缺血再灌注损伤可导致膜脂质氧化;其中乙醇胺作为神经元中N-酰基-磷脂酰乙醇胺的氧化降解产物,可反应神经胶质细胞的功能障碍和神经元损伤[12-13]。如表1所示,在本实验中给药组中的乙醇胺相较之模型组呈下降趋势,说明给药组的神经元损伤较轻。肉豆蔻酸是存在于动物中的一种饱和14-碳脂肪酸,可掺入到真核细胞质膜的磷脂双层的脂酰基核心,参与并赋予酶的膜定位[14]。在本研究中发现给药组中的肉豆蔻酸较之模型组明显升高,提示GLGZD可通过提升细胞膜的恢复能力来减轻神经细胞损伤。
4.3 栝楼桂枝汤对氨基酸代谢的影响 鸟氨酸参与许多代谢途径,它是尿素循环的核心部分,可以处理过量的氮气;本实验中发现给药组中鸟氨酸含量下降,提示GLGZD可促进鸟氨酸运输到线粒体中,减少鸟氨酸在细胞质中的积累和提高清除氨甲酰磷酸和氨负荷的能力来减轻神经损伤[15]。在本研究中,与MCAO组相比,GLGZD干预后发现L-苯丙氨酸、L-半胱氨酸、β-氨基异丁酸等氨基酸代谢物水平增加或减少,改善了脑缺血再灌注损伤引起的氨基酸代谢异常[16]。
综上,本实验首次基于GC-TOF-MS的大鼠血清代谢组学分析方法探讨栝楼桂枝汤对缺血再灌注大鼠治疗作用的代谢组学机制研究,利用多元统计分析PCA和OPLS-DA方法,揭示大鼠血清中内源性小分子化合物的模式变化规律,筛选并鉴定出吲哚乙酸、丙二酸、乙醇胺、肉豆蔻酸、鸟氨酸等13个具显著差异性的代谢物,可视为GLGZD对MCAO大鼠发挥治疗作用的生物标志物,并且栝楼桂枝汤对缺血性脑卒中的保护作用主要反应可能在能量代谢、脂质代谢、氨基酸代谢等代谢途径的变化,通过促进糖转化、蛋白氨基酸分解代谢来增加能量供应;提升细胞膜的恢复能力、提高清除氨甲酰磷酸和氨负荷的能力等来减轻神经细胞损伤,改善大鼠脑缺血再灌注损伤症状。
致谢:本研究在康复技术协同创新中心国家中医药管理局中医康复研究中心资助下完成。
