OX40L对儿童哮喘和哮喘小鼠模型辅助性T细胞分化的影响①
2020-05-13林香花王思勤张秋兴
林香花 王思勤 张秋兴 刘 丹
(河南省人民医院变态反应科,郑州大学人民医院,郑州 450000)
哮喘是一种过敏性疾病,其特征是慢性气道发炎、气流受限和气道高反应性。哮喘的确切病因尚不清楚。多年来研究表明,Th1、Th2、Treg和Th17细胞功能障碍在过敏性哮喘中起关键作用,Th1细胞和Th17细胞主要分泌促炎细胞因子IFN-γ和IL-17,而Th2细胞和Treg细胞主要分泌抑炎细胞因子IL-4和TGF-β。当T细胞亚群从Th1向Th2漂移或Th17细胞减少而Treg细胞增加时,炎症反应被抑制,反之则加剧炎症反应。OX40L/OX40的相互作用有助于Th1、Th2、Treg和Th17细胞的分化并维持哮喘的免疫功能平衡[1]。OX40L(CD252,TNFSF4)最初被称为糖蛋白34 kD(GP34),属于TNF超家族,主要在抗原呈递细胞(APC)的表面表达,包括活化的树突状细胞(DCs)、B细胞、巨噬细胞、T细胞以及内皮细胞[2-4]。OX40(ACT35,CD134,TNFRSF4)在活化的CD4+T细胞的表面表达[5,6]。它可以与OX40L特异性结合并引发一系列反应,这些反应有助于促进CD4+T细胞的增殖和存活以及细胞因子的分泌[7]。
辅助性T细胞亚群(Th1/Th2)失调是哮喘的关键发病机制。在正常情况下,Th1和Th2细胞之间的相互抑制有利于体内免疫应答的平衡[8-10]。Th2型免疫应答是由包括IL-4在内的细胞因子介导的,从而促进过敏原致敏和超敏反应的发生[11]。Th2细胞可以分泌IL-4,并拮抗Th1细胞的产生及IFN-γ 的分泌,从而进一步促进哮喘的发展[12]。也有一些研究认识到Th1/Th2失衡不能完全解释哮喘的病因,其他CD4+T细胞亚群可能与哮喘有关,包括Th17细胞和Treg细胞[12]。Th17和Treg之间的不平衡可能在过敏性气道炎症中也起着关键作用,通常会促发嗜中性粒细胞炎症[13]。另一方面,Treg细胞通过抑制炎症反应来调节对过敏原的免疫应答并维持免疫稳态。因此,OX40/OX40L在调节哮喘中Th1/Th2和Th17/Treg的平衡中起着至关重要的作用[14]。
此外,最近的研究表明,哮喘的病因与某些分子和转录因子有关。研究表明,PI3K/AKT信号通路可能在调节哮喘气道平滑肌细胞的增殖中起着至关重要的作用[15]。LY294002是一种特殊的PI3K抑制剂,能够在鼠哮喘模型中显著下调Akt磷酸化并抑制炎性细胞浸润、黏液产生和气道高反应性。气管内给予LY294002能够减少哮喘小鼠的气道炎症[16]。
此外,最近的研究表明,OX40/OX40L的相互作用可能通过调节Th1和Th2细胞相关的信号通路促进免疫应答[17]。本研究旨在探讨OX40L对哮喘细胞免疫过程中辅助性T细胞分化的影响,并考察OX40L是否可以通过PI3K/AKT信号通路诱导辅助性T细胞分化。
1 材料与方法
1.1材料
1.1.1实验材料 Percoll 细胞分离液购自北京索莱宝科技有限公司;卵清蛋白(OVA)、OX40L、IL-4、IFN-γ和IL-17以及TGF-β ELISA试剂盒购自美国Sigma-Aldrich公司;抗p-AKT、AKT、p-p38、p38和GAPDH的一抗购自美国Cell Signaling公司;自动磁选和抗CD4微珠分离试剂盒购自德国Miltenyi Biotec公司;流式细胞仪、PE抗Foxp3、OX40L-Ig融合蛋白、同型对照IgG、抗小鼠-OX40L单克隆抗体(mAb)购自美国Biolegend公司;ECL试剂苏木精和伊红(HE)染色试剂盒购自上海碧云天生物科技有限公司;LSC-LB7低本底液体闪烁计数系统购自日立Aloka公司。
1.1.2研究对象 2019年3月至8月期间,分别收集我院收治的20例急性期哮喘患儿和20例稳定期哮喘患儿,男女各半。急性期哮喘患儿年龄为5~13岁,平均(8.35±2.56)岁。稳定期哮喘患儿年龄为6~13岁,平均(8.41±2.17)岁。另外选择20例同期体检的健康儿童作为对照组,男女各半,年龄为6~12岁,平均(8.52±1.53)岁。三组的人口统计学资料无显著差异(P>0.05)。
1.2方法
1.2.1血清样本检测 使用酶联免疫吸附(ELISA)方法测量血清中的OX40L、Th1(IFN-γ)、Th2(IL-4)、Th17(IL-17)以及Treg(TGF-β)细胞因子水平。
1.2.2致敏细胞中OX40L表达的检测 参考文献[18]分离外周血单个核细胞(PBMC)。通过Percoll 细胞分离液从昆明小鼠的外周血样本中分离出外周单个核细胞。采集EDTA抗凝外周血,采用Percoll 细胞分离液通过密度梯度离心法分离外周单个核细胞。将外周血离心后在距白细胞层5 mm左右停止血浆提取,使用无菌吸管向剩余标本中加入等体积RPIM1640培养基稀释混匀,将稀释后血液加入装有细胞分离液的离心管中,4 000 r/min 室温离心15 min,弃上清液,将细胞与RPMI1640培养基及终浓度为1 mg/ml的OVA加入到24孔培养板中,调整细胞浓度为 1×106个/孔,每孔总体积 2 ml。然后刺激48 h,磷酸盐缓冲液(PBS)作为对照。使用ELISA方法测量上清液中的IL-4、IFN-γ和IL-17以及TGF-β水平。并通过ELISA试剂盒检测OX40L在细胞表面上的表达。
1.2.3蛋白磷酸化测定 在裂解缓冲液中制备OVA处理细胞的蛋白质提取物,然后进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)并转移到硝酸纤维素膜上。封闭膜2 h后与抗p-AKT、AKT、p-p38、p38和GAPDH的一抗一起孵育,然后与HRP标记的二抗一起孵育。使用ECL试剂进行显影,GAPDH作为内部对照。
1.2.4OX40L对辅助性T细胞分化的影响 通过自动磁选和抗CD4微珠分离试剂盒分离和纯化CD4+T细胞。所有分选的细胞群的纯度大于95%。将OVA诱导的CD4+T细胞与OX40L-Ig融合蛋白或对照IgG分别孵育48 h。为了估计T细胞的增殖,在48 h 培养的最后12 h内添加3H-TdR。收获细胞并计数。通过ELISA测量上清液中的IL-4、IFN-γ、IL-17和TGF-β水平。使用FITC抗CD4、PE抗IFN-γ、PE抗IL-4、PE抗IL-17对Th1、Th2和Th17进行流式细胞分析。Treg细胞用FITC抗CD4和PE抗CD25染色标记,然后与PE抗Foxp3一起孵育。
1.2.5OX40L调节辅助性T细胞分化的信号通路 分别用OX40L-Ig融合蛋白或对照IgG诱导OVA诱导的CD4+T细胞48 h。 Western blot检测AKT和p38的表达和磷酸化。此外,将OVA诱导的CD4+T细胞与OX40L-Ig融合蛋白或对照IgG孵育48 h后,加入PI3K/Akt抑制剂LY294002(终浓度50 μmol/L)或p38MAPK抑制剂SB203580(终浓度50 μmol/L)。然后,在48 h培养的最后12 h内添3H-TdR(终浓度1 mCi/ml)。收集细胞并用液体闪烁计数系统进行计数。上清液中的IL-4、IL-17、加IFN-γ和TGF-β水平通过ELISA进行测量。通过流式细胞术测量Th1、Th2、Th17和Treg的细胞计数。
1.2.6小鼠哮喘实验模型的诱导 昆明小鼠购自南京医科大学实验动物中心,将小鼠饲养在25℃、55%相对湿度、12 h光暗循环照明的无菌饲养室内,给予标准小鼠饲料及纯净水,不限制饮食。为了诱导昆明小鼠哮喘实验模型,将100 mg/ml OVA用200 mg/ml氢氧化铝-生理盐水溶液乳化,在第0、7和14天通过腹腔内注射0.1 ml 0.5%的OVA溶液对小鼠进行OVA致敏,然后在第22、24、26和28天进行0.5% OVA雾化吸入30 min。将生理盐水代替OVA处理小鼠作为对照。
1.2.7OX40L-Ig融合蛋白给药 为了评价OX40L的作用,在OVA致敏的第0、3、7、10和14天,对小鼠模型腹腔注射OX40L-Ig融合蛋白、同型对照IgG或抗小鼠-OX40L单克隆抗体(mAb)。最后一次激发24 h后,以10%水合氯醛(300 mg/kg)行腹腔注射,然后脱颈椎处死小鼠,并收集肺组织和支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)。
1.2.8细胞因子的检测及HE染色 ELISA法检测BALF中IL-4、IL-17、IFN-γ和TGF-β水平。通过FCM分析小鼠外周血Th细胞的数目;将小鼠肺组织用10%多聚甲醛固定并进行HE染色评价病理改变。
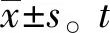
2 结果
2.1OX40L在患者血清中的表达 如表1所示,与稳定期哮喘或健康对照受试者相比,急性期哮喘患者的OX40L、IL-4和IL-17水平明显增加,而IFN-γ 和TGF-β明显降低。该结果提示OX40L在哮喘中起着至关重要的作用。
2.2OX40L在OVA诱导的小鼠单个核细胞中的表达 本研究检测了OVA诱导的小鼠单个核细胞中OX40L的表达,结果表明OVA组的OX40L的表达明显高于PBS对照组(表2)。同样,OVA组的IL-4和IL-17的表达也比PBS对照组高,然而,OVA组的IFN-γ和TGF-β则明显降低。此外,OVA组Akt磷酸化水平也明显升高(图1)。
2.3OX40L通过PI3K/AKT信号诱导辅助性T细胞分化 如表3所示,与对照相比,OVA组中CD4+T细胞的增殖明显增加,当用OX40L-Ig融合蛋白处理时,CD4+T细胞的增殖进一步增加。在OVA组和OVA+OX40L-Ig组中, IL-4和IL-17的水平升高, 而IFN-γ和TGF-β的水平降低。同样,OVA组和OVA+OX40L-Ig组中Th2和Th17的数量增加,而Th1和Treg的数量减少。此外,如图2所示,OVA诱导的CD4+T细胞中Akt的磷酸化水平升高,而OX40L-Ig融合蛋白处理的OVA诱导的CD4+T细胞中Akt的磷酸化水平进一步升高。以上结果表明PI3K/Akt信号通路可能与OX40L诱导的辅助T细胞分化有关。
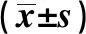
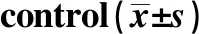

IndexControlAcute asthmaStable asthmaOX40L(ng/L)4.50±0.357.30±0.561)4.47±0.342)IL-4(ng/L)1.17±0.094.64±0.361)2.64±0.201)2)IL-17(ng/L)11.30±0.8722.67±1.741)15.70±1.211)2)IFN-γ(ng/L)15.70±1.219.54±0.731)13.11±1.012)TGF-β(ng/L)62.56±4.8141.46±3.191)52.80±4.061)2)
Note:Compared with control group,1)P<0.05;compared with acute asthma group,2)P<0.05.
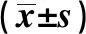


IndexPBSOVAOX40L(ng/L)2.32±0.185.46±0.421)IL-4(ng/L)54.36±4.18114.63±8.821)IL-17(ng/L)1.43±0.113.62±0.281)IFN-γ(ng/L)1.64±0.130.95±0.071)TGF-β(ng/L)6.36±0.494.63±0.361)
Note:Compared with PBS group,1)P<0.05.
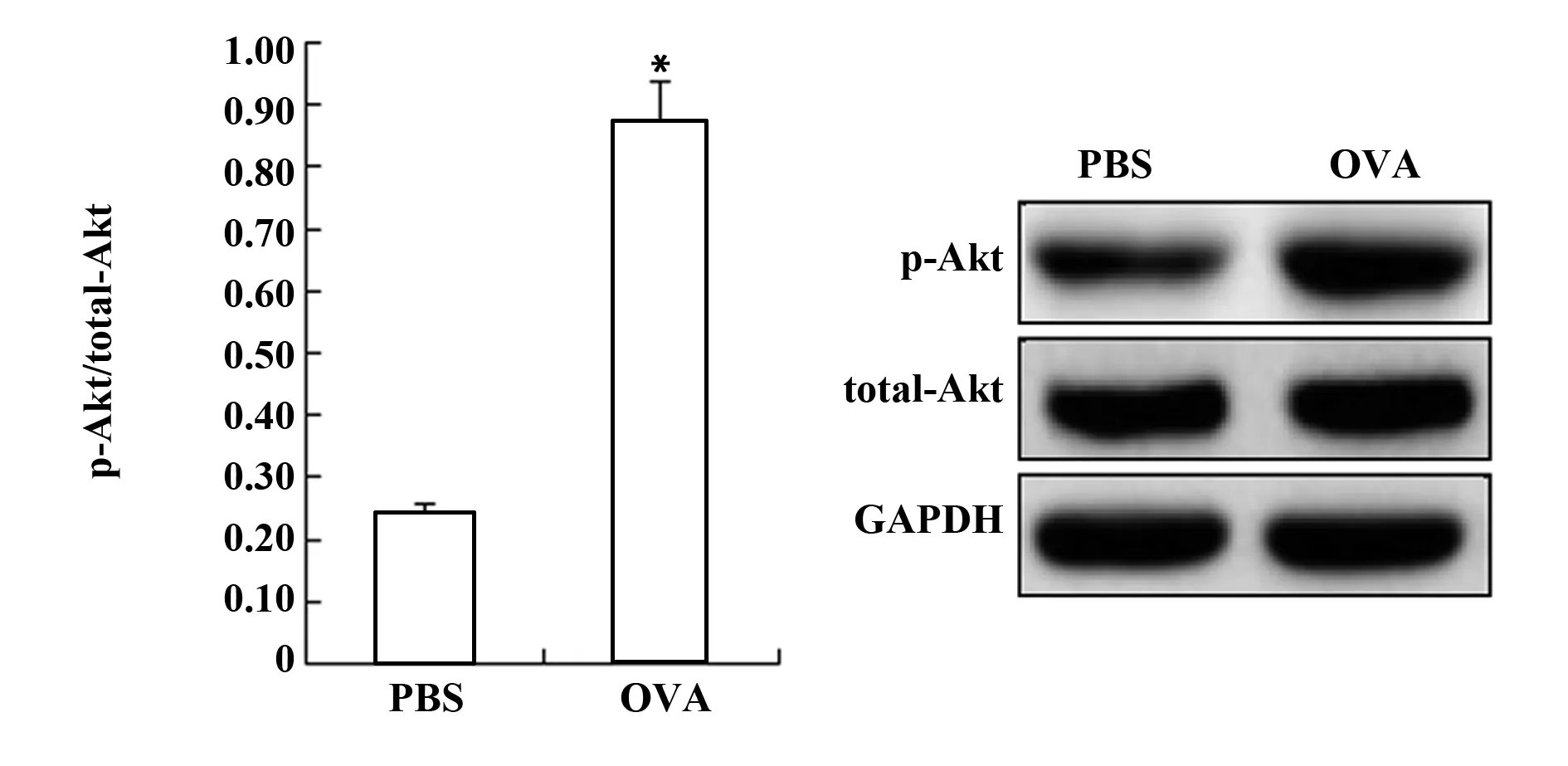
图1 Western blot检测p-Akt和total-Akt蛋白表达Fig.1 Western blot analysis of p-Akt and total-Akt protein expressionNote:Compared with PBS groups,*.P<0.05.


IndexControlOVAOVA+OX40L-Ig3H-TdR uptake (cpm×103)2.44±0.186.36±0.471)10.64±0.781)2)IL-4(ng/L)64.35±4.7198.56±7.221)135.64±9.941)2)IL-17(ng/L)1.32±0.102.54±0.191)4.18±0.311)2)IFN-γ(ng/L)1.64±0.121.13±0.081)0.65±0.051)2)TGF-β(ng/L)6.47±0.473.17±0.231)1.59±0.121)2)Th1(%)11.64±0.855.75±0.421)2.09±0.151)2)Th2(%)5.74±0.4211.58±0.851)16.34±1.21)2)Th17(%)2.53±0.194.57±0.331)6.74±0.491)2)Treg(%)7.75±0.574.67±0.341)2.35±0.171)2)
Note:Compared with control group,1)P<0.05;compared with OVA group,2)P<0.05.
2.4PI3K/AKT信号抑制剂诱导辅助性T细胞分化 本研究应用PI3K/Akt抑制剂LY294002处理OVA诱导的CD4+T细胞。如表4所示,LY294002处理后,OVA诱导的CD4+T细胞中IL-4、IL-17以及Th2和Th17细胞的数量明显减少。说明LY294002可以抑制OVA诱导的Th2和Th17细胞增殖。相反,LY294002显著升高了IFN-γ和TGF-β的表达以及Th1细胞和Treg细胞的数量。说明LY294002可以促进OVA诱导的Th1和Treg细胞的增殖。
2.5OX40L诱导哮喘小鼠模型辅助性T细胞分化实验 为了确定OX40L在辅助性T细胞分化中的作用,本研究建立了哮喘小鼠模型。如表5所示,当对照组和OVA组相比时,用OX40L-Ig融合蛋白处理的OVA诱导的小鼠哮喘模型BALF中的IL-4和IL-17水平以及小鼠外周血Th2和Th17细胞的数目显著增加,而IFN-γ和TGF-β水平以及Th1和Treg细胞的数目显著减少。相反,当用抗小鼠OX40L单抗处理时,与OVA+OX40L 组相比,IL-4和IL-17水平以及Th2和Th17细胞的数量显著减少,而IFN-γ和TGF-β水平以及Th1和Treg细胞的数量明显增加。这些结果表明,OX40L的缺失可以抑制Th2和Th17细胞的分化。

图2 Western blot检测OX40L-Ig融合蛋白对Akt磷酸化的影响Fig.2 Western blot analysis of effect of OX40L-Ig fusion protein on Akt phosphorylationNote:Compared with control group,*.P<0.05;compared with OVA group,#.P<0.05.
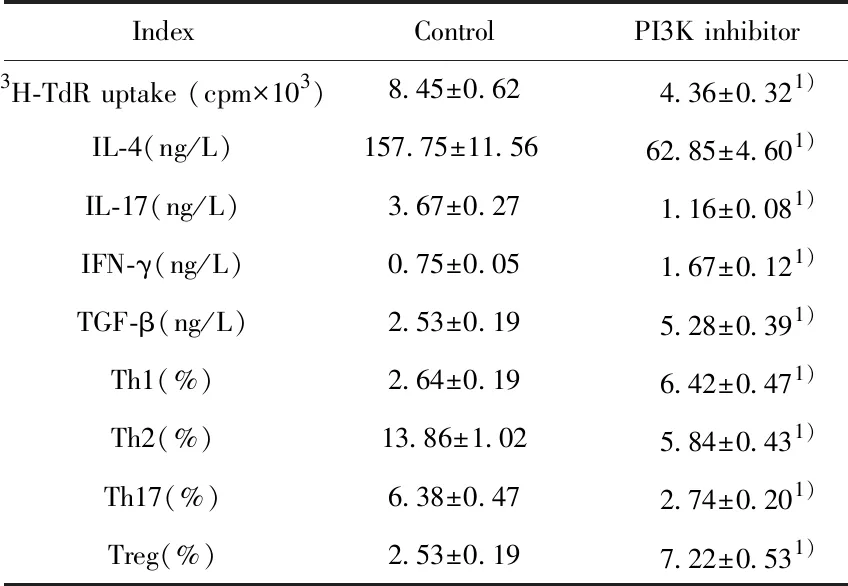
IndexControlPI3K inhibitor3H-TdR uptake (cpm×103)8.45±0.624.36±0.321)IL-4(ng/L)157.75±11.5662.85±4.601)IL-17(ng/L)3.67±0.271.16±0.081)IFN-γ(ng/L)0.75±0.051.67±0.121)TGF-β(ng/L)2.53±0.195.28±0.391)Th1(%)2.64±0.196.42±0.471)Th2(%)13.86±1.025.84±0.431)Th17(%)6.38±0.472.74±0.201)Treg(%)2.53±0.197.22±0.531)
Note:Compared with control group,1)P<0.05.
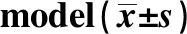

IndexControlOVAOVA+IgGOVA+OX40LOVA+Anti-OX40LIL-4(ng/L)6.35±0.4715.56±1.141)14.86±1.091) 22.64±1.661)2)3) 7.89±0.581)2)3)4)IL-17(ng/L)71.67±5.25108.46±7.951)105.75±7.751) 147.85±10.831)2)3)76.90±5.632)3)4)TGF-β(ng/L)423.86±31.05312.86±22.921)308.64±22.611)207.75±15.221)2)3)388.76±28.481)2)3)4)IFN-γ(ng/L)154.64±11.3389.67±6.571)87.56±6.411) 46.85±3.431)2)3)112.96±8.281)2)3)4)Th1(%)8.46±0.626.46±0.471)6.54±0.481) 3.26±0.241)2)3)7.04±0.521)2)3)4)Th2(%)4.24±0.315.34±0.391)5.13±0.381) 7.45±0.551)2)3)4.47±0.332)3)4)Th17(%)2.16±0.164.24±0.311)4.57±0.331) 5.76±0.421)2)3)3.04±0.221)2)3)4)Treg(%)8.15±0.606.36±0.471)6.42±0.471) 4.32±0.321)2)3)7.93±0.582)3)4)
Note:Compared with control group,1)P<0.05;compared with OVA group,2)P<0.05;compared with OVA+IgG group,3)P<0.05;compared with OVA+OX40L group,4)P<0.05.
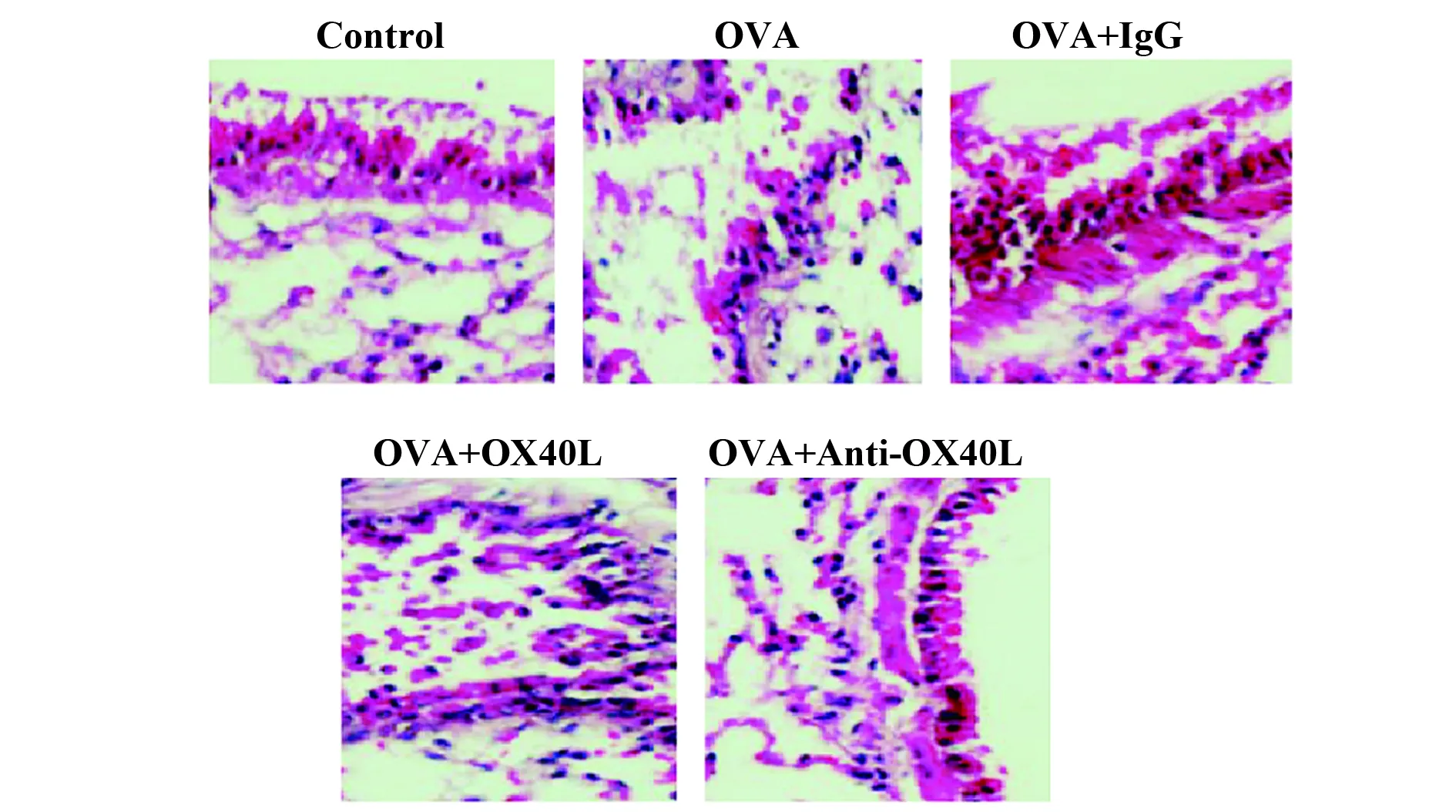
图3 HE染色检测OX40L-Ig融合蛋白和抗小鼠OX40L单抗对哮喘小鼠肺组织病变的影响(×200)Fig.3 Effect of OX40L-Ig fusion protein and anti-mouse OX40L monoclonal antibody on lung tissue lesions in asthmatic mice by HE staining (×200)
为了确定OX40L-Ig融合蛋白和抗小鼠OX40L单抗对哮喘小鼠肺组织病变的影响,采用HE染色评价肺组织病变,如图3所示,OVA模型组和OVA+IgG组可见炎症细胞浸润明显增加,尤其是血管周围和支气管周围的淋巴细胞和嗜酸性粒细胞浸润,上皮下基底层增厚。此外,在用OX40L-Ig融合蛋白处理组中,炎症细胞浸润进一步加剧。相反,在用抗小鼠OX40L单抗处理后,肺组织中嗜酸性粒细胞的浸润明显减少,并且基底层上皮增厚情况显著减轻。
3 讨论
支气管哮喘是一种由多种炎症细胞和介质引起的气道过敏性炎症。炎症细胞和释放的介质在复杂的哮喘病原学中起着重要的作用。本研究探讨了OX40L在哮喘中的作用机理。研究发现OX40L在哮喘患者中的表达显著升高,这表明OX40L与哮喘相关。其他研究发现,哮喘儿童在急性发作期的OX40L水平显著高于中度和轻度哮喘急性发作的儿童[19]。此外,与健康对照组相比,轻度哮喘患者中OX40、OX40L和IL-4水平也显著增加[20]。
Th1/Th2细胞和Th17/Treg细胞的平衡与哮喘的发病过程密切相关。Th1细胞和Th17细胞主要分泌细胞因子IFN-γ和IL-17,而Th2细胞和Treg细胞主要分泌细胞因子IL-4和TGF-β。本研究发现急性期哮喘患者的IL-4和IL-17水平明显增加,而IFN-γ和TGF-β明显降低。并且OVA诱导的单个核细胞中的IL-4和IL-17的表达也显著升高,而IFN-γ和TGF-β则明显降低。表明OVA诱导了Th1/Th2细胞和Th17/Treg细胞的失平衡。
本研究还发现OVA诱导的单个核细胞中OX40L水平升高,这表明OX40L在辅助性T细胞诱导的哮喘反应中起重要作用。具体而言,OX40/OX40L相互作用在T细胞分化中起潜在作用,并影响Th1/Th2的平衡[21]。OX40L可以激活T细胞表达IL-4,并抑制IFN-γ的表达,从而参与免疫细胞介导的Th2型免疫应答[22]。另外,OX40L还可以诱导Th17细胞表达IL-17从而促进Th17型免疫应答,以及阻止Treg的分化并阻断其功能[23]。
多项研究显示,与哮喘有关的信号传导途径,例如酪氨酸激酶信号传导级联在过敏性气道炎症中起着至关重要的作用,而GM-CSF STAT5途径的激活延迟了哮喘患者肺粒细胞的凋亡[24-26]。此外,据报道,TGF-β信号在哮喘气道中高表达,并且TGF-β信号的激活可以促进哮喘气道重塑[27]。而PI3K/AKT信号也可促进哮喘的进展。各种研究表明,抑制PI3K/Akt信号传导可减轻过敏性哮喘的严重程度[28]。本研究发现OX40L可显著激活OVA诱导的单个核细胞以及CD4+T细胞中的Akt磷酸化,此外,本研究应用PI3K/Akt抑制剂LY294002处理OVA诱导的CD4+T细胞,发现抑制PI3K/Akt信号可明显降低OVA诱导的IL-4和IL-17水平以及Th2和Th17细胞的数量,但可升高IFN-γ和TGF-β的表达以及Th1和Treg细胞的数量。表明PI3K/Akt信号通路介导OX40L诱导的辅助性T细胞的分化。
本研究建立了哮喘小鼠模型,并分别用OX40L-Ig融合蛋白和抗小鼠OX40L单抗处理小鼠,发现OX40L-Ig融合蛋白处理可加剧哮喘小鼠肺组织中炎症细胞浸润,而用抗小鼠OX40L单抗处理则可抑制肺组织病变。进一步证实OX40L在哮喘发生中的促进作用。OX40/OX40L信号参与调控Th1、Th2、Treg和Th17细胞的增殖和分化,并且介导哮喘发病过程中的重要促炎或抗炎细胞因子的表达,研究OX40/OX40L信号作为Th细胞第二信号的具体生物学功能有利于进一步揭示哮喘的发病机制。
总之,本研究表明,OX40L通过PI3K/Akt信号通路诱导了Th2和Th17细胞的分化,用抗小鼠OX40L单抗阻断OX40L可以诱导哮喘中的Th1和Treg细胞分化。
