原发性肝癌患者循环miR-203a-3p表达水平与SOCS1和SOCS3的关系及意义①
2020-05-13刘敏王阁
刘 敏 王 阁
(新疆兵团医院肿瘤科,乌鲁木齐 830000)
肝癌作为世界第五大最为常见的癌症,每年的新发肝癌病例和死亡病例均超过7 000万例[1]。血液检查和影像学检测是目前普查肝癌的主要手段,由于患者早期症状不典型且病程发展快,临床上大约有80%的患者发现时已处于晚期,错失了最佳手术时机。机体内基因异常表达一般先于肿瘤的发生,因此从基因水平上寻求一种更为灵敏的肝癌早期诊断生物学标记物成为本领域研究的热点,微小RNA(microRNA,miR)在肿瘤性疾病中一般被作为抑癌基因或原癌基因加以研究,是近几年的研究热点。细胞因子信号抑制物(suppres-sor of cytokine signaling,SOCS)是一种细胞因子信号传导抑制因子,可通过负反馈抑制多条信号通路,是JAK-STAT信号转导通路中的重要抑制因子,可通过抑制JAK-STAT信号转导发挥抗肿瘤作用。现有研究已证实,肝癌病灶组织中SOCS家族的SOCS1和SOCS3均呈低表达,SOCS1和SOCS3的启动子异常甲基化是沉默其表达和诱发肿瘤的一个重要原因,可预测疾病严重程度及患者预后[2-4]。有研究证实SOCS1和SOCS3均是miR-203a-3p的靶基因[5,6],本研究分析循环miR-203a-3p表达与组织SOCS1、SOCS3的关系,为肝癌的临床诊治提供新靶点。
1 材料与方法
1.1材料
1.1.1一般资料 选取我院2017年5月至2018年5月收治的50例原发性肝癌患者作为研究组,其中男31例,女19例,年龄37~71岁,平均(51.23±4.36)岁。另招募50例健康体检者作为对照组,其中男26例,女24例,年龄35~73岁,平均年龄(53.14±5.23)岁。两组患者的年龄和性别差异无统计学意义(P>0.05)。研究组纳入标准:首次诊出为原发性肝癌,无既往治疗史;近6个月内无免疫调节史;自愿签署知情同意书。本研究经本院伦理委员会批准。
1.1.2试剂与仪器 namodropND-1000分光光度计购自美国Thermo公司;PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit购自大连TaKaRa公司;GoTaq®qPCR Master Mix试剂盒购自德国Promega公司;ABI 7500型实时荧光定量PCR扩增仪购自美国ABI公司;miR-203a-3p引物、小鼠抗SOCS3单克隆抗体、核酸提取试剂盒、HRP标记山羊抗兔IgG和山羊抗小鼠IgM购自生工生物工程(上海)股份有限公司;兔抗SOCS1单克隆抗体购自美国Abnova公司;EZ DNA Methylation-GoldTMKit购自美国ZYMO RESEARCH公司。
1.2方法
1.2.1样本提取方法 50例肝癌患者于确诊后,治疗前抽取晨8:00时外周肘静脉血,即刻送检;于手术过程中留取肝癌组织和癌旁2 cm以上的健康组织,-70℃保存。50例健康志愿者于体检时抽取晨8:00时外周肘静脉血,即刻送检。
1.2.2循环miR-203a-3p表达测定方法 Trizol裂解法提取研究组和对照组全血样本总RNA,用nanodropND-1000分光光度计检测RNA浓度和纯度,用于后续实验。实时荧光定量PCR实验检测miR-203a-3p表达,主要步骤:①所得总RNA样本,使用PrimeScriptTMⅡ 1st Strand cDNA Synthesis Kit反转录生成cDNA。②使用GoTaq®qPCR Master Mix试剂盒和ABI 7500型实时荧光定量PCR扩增仪检测miR-203a-3p表达。miR-203a-3p引物上游序列:5′-CCGGTGAAATGTTTAGGACCACTAG-3′;下游序列:5′-GCCGCGTGAAATGTTTAGG-3′;内参为U6。③每个样本的目的基因做3个重复,取平均Ct值根据公式:n=2-ΔΔCt计算miR-203a-3p表达量。
1.2.3组织SOCS1和SOCS3的蛋白表达测定 采用免疫蛋白印迹实验(Western blot)检测病灶组织和癌旁组织SOCS1和SOCS3的蛋白表达,主要步骤:① 使用裂解液(RIPA∶PMSF=100∶1)裂解冻存的肝组织,充分裂解后将裂解液转移至新的离心管中,4℃ 12 000 r/min离心5 min,取上清转移至新的1.5 ml离心管中,保存于-20℃备用。② 使用BCA法测定蛋白质含量。③进行SDS-聚丙烯酰胺凝胶电泳。④ 80 V恒压转膜1 h;室温条件下5%的脱脂奶粉封闭60 min;分别加入兔抗SOCS1单克隆抗体和小鼠抗SOCS3单克隆抗体,4℃孵育过夜;分别加入HRP标记山羊抗兔IgG和山羊抗小鼠IgM,室温孵育90 min。⑤曝光、显影、定影。显影后扫描胶片,用Image J图像分析软件分析条带灰度值,以各组条带灰度值与β-actin条带灰度值的比值,代表各组蛋白相对表达量。
1.2.4组织SOCS1和SOCS3甲基化程度测定方法 采用核酸提取试剂盒提取病灶组织和癌旁组织的基因组DNA。采用EZ DNA Methylation-GoldTMKit试剂盒,对基因组 DNA 进行亚硫酸氢盐处理,严格按照试剂盒的说明进行操作。目的基因SOCS1、SOCS3和内参基因β-actin使用Premier 5.0设计引物。阳性对照、阴性对照以及空白对照分别为Human Methylated DNA、Human Non-methylated DNA以及双蒸水。PCR产物的电泳采用1.5%的琼脂糖凝胶,电泳后在溴化乙锭溶液中染15 min,最后在凝胶成像仪中观察并分析电泳图。

2 结果
2.1循环miR-203a-3p的表达水平 研究组循环miR-203a-3p的表达水平为0.829±0.208,对照组为1.596±0.304,研究组低于对照组,差异有统计学意义(P<0.05),见图1。
2.2组织SOCS1和SOCS3蛋白表达水平 研究组病灶组织的SOCS1和SOCS3蛋白表达水平分别为0.825±0.322和0.624±0.200,癌旁组织分别为0.285±0.096和0.352±0.185,病灶组织均低于癌旁组织,差异有统计学意义(P<0.05);见图2。

图2 组织SOCS1和SOCS3蛋白表达水平比较Fig.2 Comparison in protein expression level of SOCS1 and SOCS3Note: A.Protein expression of SOCS1.The left figure is the Western blot sample.The right figure is the histogram of 50 patients;B.Protein expression of SOCS3.The left figure is the Western blot sample.The right figure is the histogram of 50 patients.
2.3组织SOCS1和SOCS3基因甲基化水平 研究组病灶组织的SOCS1和SOCS3甲基化表达水平分别为0.805±0.062和0.652±0.062,癌旁组织分别为0.105±0.026和0.154±0.026,病灶组织甲基化表达水平均高于癌旁组织,差异有统计学意义(P<0.05);研究组病灶组织的SOCS1和SOCS3非甲基化表达水平分别为0.012±0.002和0.013±0.003,癌旁组织分别为0.352±0.046和0.285±0.085,病灶组织非甲基化表达水平均低于癌旁组织,差异有统计学意义(P<0.05);见图3。
2.4循环miR-203a-3p与SOCS1和SOCS3表达水平的相关性分析 肝癌患者血清循环miR-203a-3p表达水平与肝癌组织SOCS1和SOCS3蛋白表达水平呈正相关性(r=0.576、0.475,P<0.05);与SOCS1和SOCS3基因甲基化程度呈负相关性(r=-0.585、-0.579,P<0.05);其相关直线如图4所示。
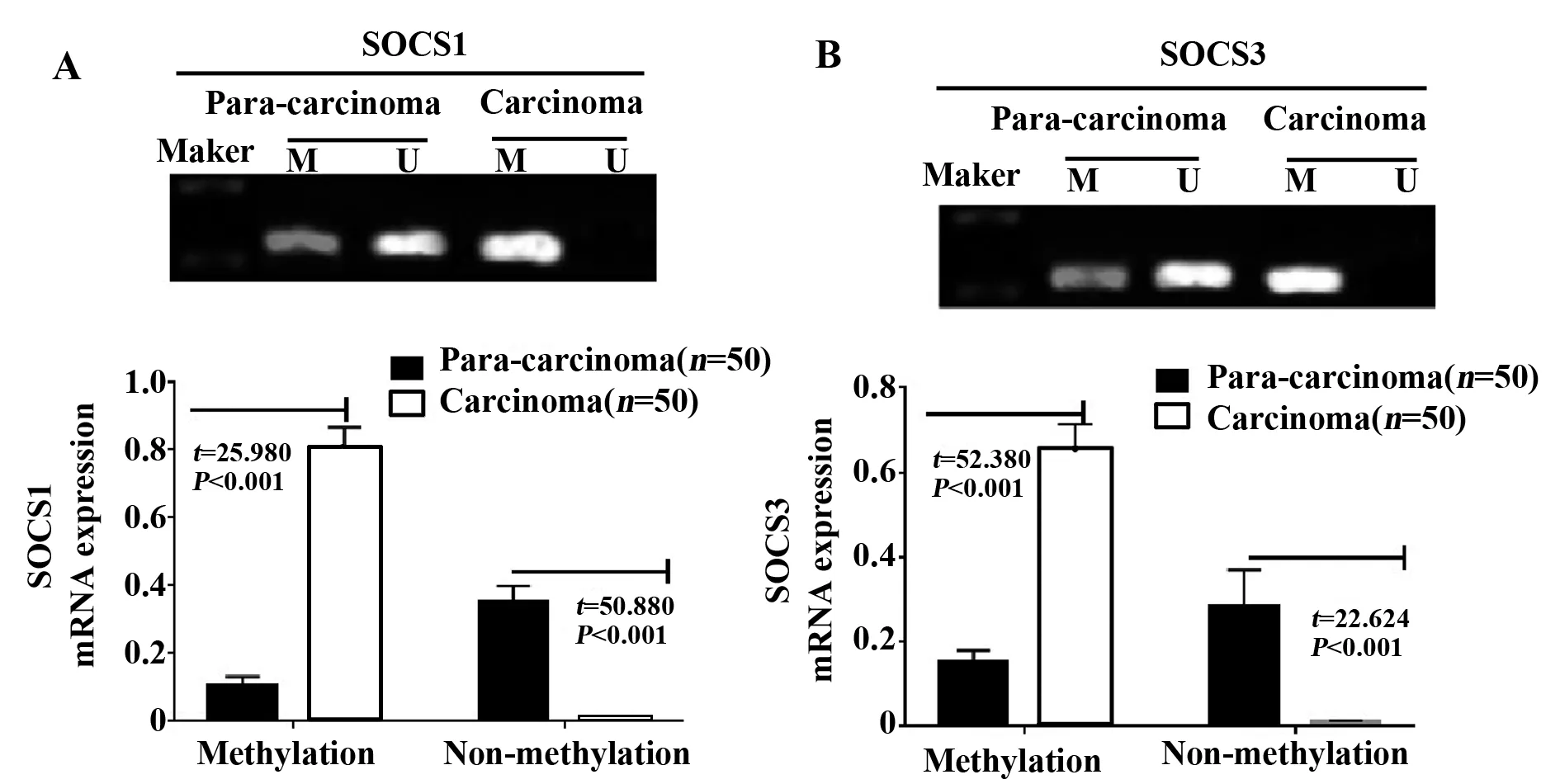
图3 组织SOCS1和SOCS3基因甲基化水平比较Fig.3 Comparison in methylation level of tissue SOCS1 and SOCS3Note: A.Methylation expression of SOCS1,the above diagram is the MSP experimental sample (M represents methylation expression,U represents non-methylation expression).The below diagram is the histogram of 50 patients;B.Methylation expression of SOCS3,the above diagram is the MSP experimental sample (M represents methylation expression,U represents non-methylation express-ion).The below diagram is the histogram of 50 patients.
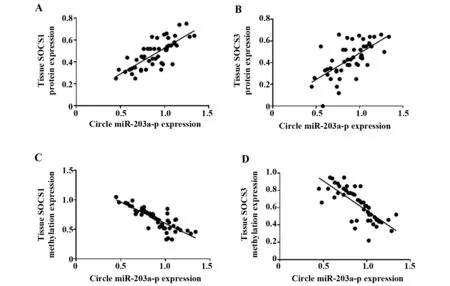
图4 血清循环miR-203a-3p表达水平与各个指标的相关直线Fig.4 Correlation line between expression level of serum circulating miR-203a-3p and various indicatorsNote: A.Circulating miR-203a-3p expression and SOCS1 protein expression in liver cancer patients;B.Circulating miR-203a-3p expression and the SOCS3 protein expression in cancer tissues;C.Circulating miR-203a-3p expression and SOCS1 methylation expression in cancer tissues;D.Circulating miR-203a-3p expression and SOCS3 methylation expression in cancer tissues.
3 讨论
肝癌是全球发病率最高的癌症之一,由于其发病前期症状不明显,病情发展较快,因此给肝癌患者的早期诊断和及时有效治疗带来了一定的难度。为了实现肝癌患者的早期诊断和更好的治疗,明确肝癌的发病机制非常关键,本研究探讨了肝癌组织中循环miR-203a-3p表达水平与SOCS1和SOCS3表达水平及其甲基化水平的关系,以期为完善肝癌发病机制和为寻求一种早期诊断肝癌的灵敏指标奠定一定的基础。
miR-203在多种肿瘤中具有促进细胞凋亡的作用,抑制miR-203表达可促进Hela细胞增殖,重新表达可抑制Hela细胞增殖[7-9]。Furuta等[10]研究证实miR-203在肝癌组织中表达水平明显下调,而用甲基化酶抑制剂5-氮杂-2脱氧胞苷处理后可恢复miR-203的表达水平,说明其下调可能是由甲基化所致;上调肝癌细胞miR-203表达水平可抑制细胞的生长,推测miR-203是一种新型的肝癌表观遗传学沉默肿瘤抑制miRNAs[11,12]。miR-203a-3p与miR-203高度同源,在肝癌患者中可能也具有抑癌作用。SOCS1和SOCS3属SOCS家族的成员,是由细胞产生并能够反馈性阻断细胞因子信号转导过程的负性调节因子,可抑制Janus 酪氨酸激酶-信号传导子及转录激活子(Janus tyrosine kinase-signal transducer and activator of transcription,JAK-STAT)信号通路异常激活引发的细胞增殖。王红雷等[13]应用对比分析了肝细胞癌组织和正常肝组织中的SOCS3表达,发现SOCS3在癌组织中表达水平下调,且其具体水平与肿瘤大小、分化程度以及患者的生存期有关。进一步研究表明,SOCS3启动子区甲基化是导致SOCS3表达沉默和肿瘤活动增强的一个重要原因,在针对乙肝病毒(HBV)相关性肝癌和原发性肝癌的临床研究中均发现了类似情况[14,15]。符常波等[16]发现SOCS1低表达与肝癌的发生、发展和转移有关,SOCS1失活会导致JAK-STAT信号通路过度持续激活,肿瘤细胞侵袭性增加和病情恶化,Gui等[17]也得出了相仿的结论,认为SOCS1的甲基化程度与肝癌患者的预后密切相关。Zhang等[18]发现SOCS1在乙肝病毒(HBV)相关性肝癌的病灶组织和正常组织均有阳性表达,且病灶组织中的甲基化状态增强,并指出SOCS1的甲基化削弱了SOCS1对抑癌基因p53的正向调节作用,是HBV相关性肝癌发展的一个重要机制。
事实上,多种类型肿瘤中常存在SOCS基因启动子区甲基化,使得SOCS1和SOCS3表达降低,JAK2-STAT信号通路异化,最终导致肿瘤细胞的无限增殖[19]。Aniagu等[20]认为在肝癌发生、发展过程中 SOCS1甲基化呈动态变化:初期阶段甲基化主要发生在 SOCS1基因启动子区域的组蛋白水平;随着癌症进一步发生,甲基化则逐渐蔓延至基因启动子的CpG岛。Lena等[21]通过将腺病毒转染miR-203进入小鼠角阮细胞中之后,SOCS3的表达水平有小幅度上升,认为SOCS3有可能是miR-203的靶基因,但并不一定是直接靶基因。因此,有关miR-203与SOCS1、SOCS3的关系有待于进一步研究证实。本研究发现肝癌患者的miR-203a-3p和SOCS1、SOCS3表达水平均有所下调,SOCS1和SOCS3的甲基化水平则呈上升趋势,同时miR-203a-3p和SOCS1、SOCS3的表达水平在肝癌患者中呈正相关关系,与SOCS1和SOCS3的甲基化水平呈负相关关系,说明两者可能共同参与了肝癌的发生与发展。
综上所述,miR-203a-3p可能对原发性肝癌的SOCS1、SOCS3甲基化修饰有影响,有望为其临床诊治提供新靶点。miRs调控靶基因的机制复杂,miR-203a-3p和SOCS1、SOCS3的具体关系及其具体机制还需要进一步研究证实。
