乙肝病毒X蛋白结合蛋白可能通过PI3K/Akt信号通路影响肝癌细胞的增殖和迁移
2020-05-13刘阳魏俊肖贝曾琴
刘 阳 魏 俊 肖 贝 曾 琴
(武汉市传染病医院肺结核科,武汉 430023)
乙肝病毒X蛋白结合蛋白(hepatitis B X-interacting protein,HBXIP)是哺乳动物中一种高度保守的细胞组成型表达蛋白,在恶性肿瘤组织中高表达,作为癌蛋白受到研究者的广泛关注[1]。已有研究报道,HBXIP在非小细胞肺癌、卵巢癌、膀胱癌等多种恶性肿瘤中高表达,通过影响肿瘤细胞增殖、迁移和侵袭等促进肿瘤进展,与肿瘤不良预后密切相关[2-4]。肝癌相关研究表明,HBXIP在肝癌组织和癌细胞中高表达与肝癌组织分化、TNM分期及癌栓形成及癌细胞免疫逃逸有关[5,6]。但目前HBXIP对肝癌细胞增殖和迁移的影响及其机制尚未完全阐明。磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)及其下游蛋白激酶B(Akt)所组成的PI3K/Akt信号通路是调节细胞增殖、凋亡、分化和葡萄糖转运等功能的重要通路,一直是肿瘤细胞增殖、凋亡、迁移等恶性生物学行为的研究热点[7,8]。本研究分析HBXIP对肝癌细胞增殖和迁移的影响,旨在揭示HBXIP对肝癌细胞增殖和迁移的影响是否与PI3K/Akt信号通路有关。
1 材料与方法
1.1材料
1.1.1细胞株 人正常肝脏细胞HL7702和人肝癌细胞HepG2、Hep3B、Huh7由中国科学院上海细胞库提供。
1.1.2主要试剂 RPMI1640培养基、胎牛血清(Gibco公司);青霉素和链霉素(Solarbio公司);pcDNA3.1-HBXIP质粒、siRNA-HBXIP由广州锐博生物科技有限公司构建;LY294002(PI3K抑制剂,Apexbio公司);逆转录试剂盒(TaKaRa公司);SYBR Green实时荧光定量PCR试剂盒(ABI公司);MTT试剂和二甲基亚砜(Solarbio公司);鼠抗人HBXIP单克隆抗体、兔抗人PI3K单克隆抗体、兔抗人p-PI3K单克隆抗体、兔抗人p-Akt多克隆抗体、兔抗人Akt多克隆抗体、鼠抗人GAPDH单克隆抗体及辣根过氧化酶标记的山羊抗鼠IgG二抗(Abcam公司)。
1.2方法
1.2.1细胞培养 将HL7702、HepG2、Hep3B、Huh7细胞接种于RPMI1640完全培养基(含青霉素100 U/ml、链霉素100 μg/ml,10%胎牛血清),置于37℃、含5%CO2的培养中培养。当细胞90%铺满培养瓶后,加入胰酶消化细胞进行传代培养。
1.2.2qRT-PCR实验 收集对数生长期的HL7702、HepG2、Hep3B、Huh7细胞,采用TRIzol法抽提细胞总RNA,测定RNA样品浓度和完整性,使用逆转录试剂盒合成cDNA,以cDNA为模板,GAPDH为内参基因,使用SYBR Green实时荧光定量PCR试剂盒进行qPCR反应。HBXIP引物序列:正向5′-ATGGAGCCAGGTGCAGGTC-3′,反向5′-TGGAGGGATTCTTCATTGTG-3′;GAPDH引物序列:上游5′-ATCCCATCACCATCTTCC-3′,下游5′-TCCTTCCACGATACCAAA-3′。结果采用2-ΔΔCt法计算HBXIP mRNA相对表达水平。
1.2.3细胞转染 选择肝癌细胞HepG2进行后续实验。收集对数生长期的肝癌细胞,制成单细胞悬液并以2×105个/孔接种于6孔板,放入培养箱中培养,当细胞融合50%~70%时,将pcDNA3.1-HBXIP质粒、siRNA-HBXIP转染细胞,转染36 h后检测转染效率,另将转染pcDNA3.1空载体、siRNA阴性对照及未转染的细胞作为对照,分别记为pcDNA-HBXIP组、si-HBXIP组、pcDNA组、si-NC组和空白组。每组设5个重复孔重复3次实验。
1.2.4MTT实验 收集对数生长期的空白组和稳定转染的pcDNA组、pcDNA-HBXIP组、si-NC组和si-HBXIP组肝癌细胞,制成单细胞悬液并以1×104个/孔接种于96孔板(加入或不加入LY294002处理),放入培养箱中培养,分别于0 h、24 h、48 h和72 h时,以20 μl/孔加入5 mg/ml的MTT溶液继续培养4 h,吸除孔内液体,以150 μl/孔加入二甲基亚砜溶液振荡反应5 min。使用酶标仪测定每孔490 nm 波长处吸光度值。
1.2.5细胞划痕实验 收集对数生长期的空白组和稳定转染的pcDNA组、pcDNA-HBXIP组、si-NC组和si-HBXIP组肝癌细胞,制成密度为5×105个/ml的单细胞悬液,以500 μl/孔铺于6孔板上,加入RPMI1640完全培养液培养至形成单层细胞。用10 μl无菌枪头在单层细胞上划痕,PBS溶液清洗3次,加入40 μg/ml的无氟尿嘧啶溶液孵育24 h,更换RMPI1640完全培养液继续培养24 h。吸去培养液,PBS溶液清洗3次,倒置显微镜下观察并拍照。细胞迁移率(%)=(初次划痕面积-末次观察时划痕面积)/初次划痕面积×100%。
1.2.6Western blot实验 收集对数生长期的HL7702、HepG2、Hep3B、Huh7细胞及转染各组细胞,加入RIPA裂解液对细胞进行裂解,BCA法测定每个蛋白样品的浓度。向蛋白样品中加入5倍的SDS-PAGE蛋白上样缓冲液混匀,放入沸水浴中加入5 min使蛋白充分变性,蛋白样品冷却后进行SDS-PAGE电泳。电泳结束后使用Bio-Rad湿式转膜装置将目的蛋白转移至PVDF膜,洗膜1~2 min,加入5%脱脂奶粉中封闭1 h。加入1∶1 000稀释的鼠抗人HBXIP单克隆抗体、兔抗人PI3K单克隆抗体、兔抗人p-PI3K单克隆抗体、兔抗人p-Akt多克隆抗体、兔抗人Akt多克隆抗体、鼠抗人GAPDH单克隆抗体4℃孵育过夜,洗膜1~2 min,加入1∶2 000 稀释的辣根过氧化酶标记的山羊抗鼠IgG二抗室温孵育2 h。洗膜,加入ECL溶液显色,曝光、拍照,应用Image J软件分析蛋白条带灰度值并计算目的蛋白相对表达量。

2 结果
2.1HBXIP在人正常肝细胞株及肝癌细胞株中表达 与人正常肝细胞株HL7702比较,肝癌细胞株HepG2、Hep3B、Huh7中HBXIP mRNA相对表达水平均明显升高(P<0.05,图1A),HBXIP蛋白相对表达水平均明显升高(P<0.05,图1B)。
2.2HBXIP过表达对肝癌细胞HepG2增殖的影响 与空白组和pcDNA组比较,pcDNA-HBXIP组肝癌细胞中HBXIP蛋白相对表达量明显升高(P<0.05,图2A);MTT实验结果,与空白组和pcDNA组比较,pcDNA-HBXIP组肝癌细胞在培养48 h和 72 h 时增殖活性明显增强(P<0.05,图2B)。说明过表达HBXIP促进肝癌细胞增殖。

图1 HBXIP在人正常肝细胞株及肝癌细胞株中表达Fig.1 HBXIP expression in human normal liver cell lines and liver cancer cell linesNote: Compared with HL7702 cell,*.P<0.05.
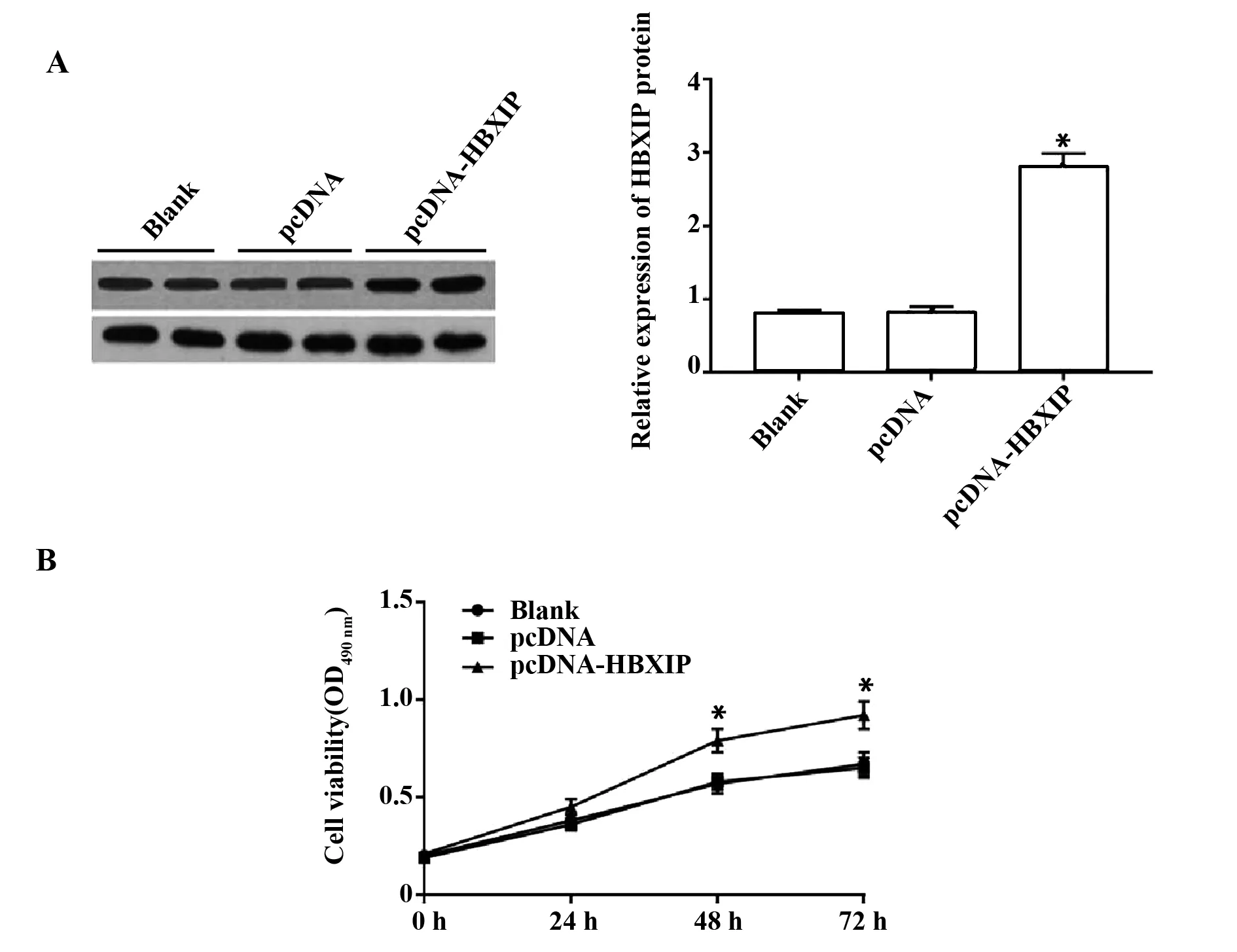
图2 HBXIP过表达对肝癌细胞HepG2增殖的影响Fig.2 Effect of HBXIP overexpression on proliferation of HepG2 cellsNote: Compared with blank group and pcDNA group,*.P<0.05.
2.3HBXIP过表达对肝癌细胞HepG2迁移的影响 划痕实验结果,空白组、pcDNA组和pcDNA-HBXIP组肝癌细胞迁移率分别为(33.82±2.79)%、(32.74±2.58)%、(58.17±4.11)%。与空白组和pcDNA组比较,pcDNA-HBXIP组肝癌细胞迁移率明显升高(P<0.05),说明过表达HBXIP促进肝癌细胞迁移(图3)。
2.4沉默HBXIP对肝癌细胞HepG2增殖和迁移的影响 与空白组和si-NC组比较,si-HBXIP组肝癌细胞中HBXIP蛋白表达明显降低(P<0.05,图4A),培养48 h和72 h时细胞增殖活性明显降低(P<0.05,图4B);空白组、si-NC组和si-HBXIP组肝癌细胞迁移率分别为(33.75±2.81)%、(33.16±2.43)%、(18.17±1.35)%,si-HBXIP组肝癌细胞迁移率较空白组、si-NC组明显降低(P<0.05,图4C)。说明沉默HBXIP能够抑制肝癌细胞增殖和迁移。
2.5HBXIP过表达对肝癌细胞HepG2中PI3K/Akt信号通路的影响 与空白组和pcDNA组比较,pcD-NAHBXIP组肝癌细胞中p-PI3K和p-Akt蛋白相对表达水平明显升高(P<0.05),PI3K和Akt蛋白相对表达水平差异无统计学意义(P>0.05,图5)。

图3 划痕实验检测肝癌细胞迁移能力Fig.3 Scratch test to detect liver cancer cell migrationability
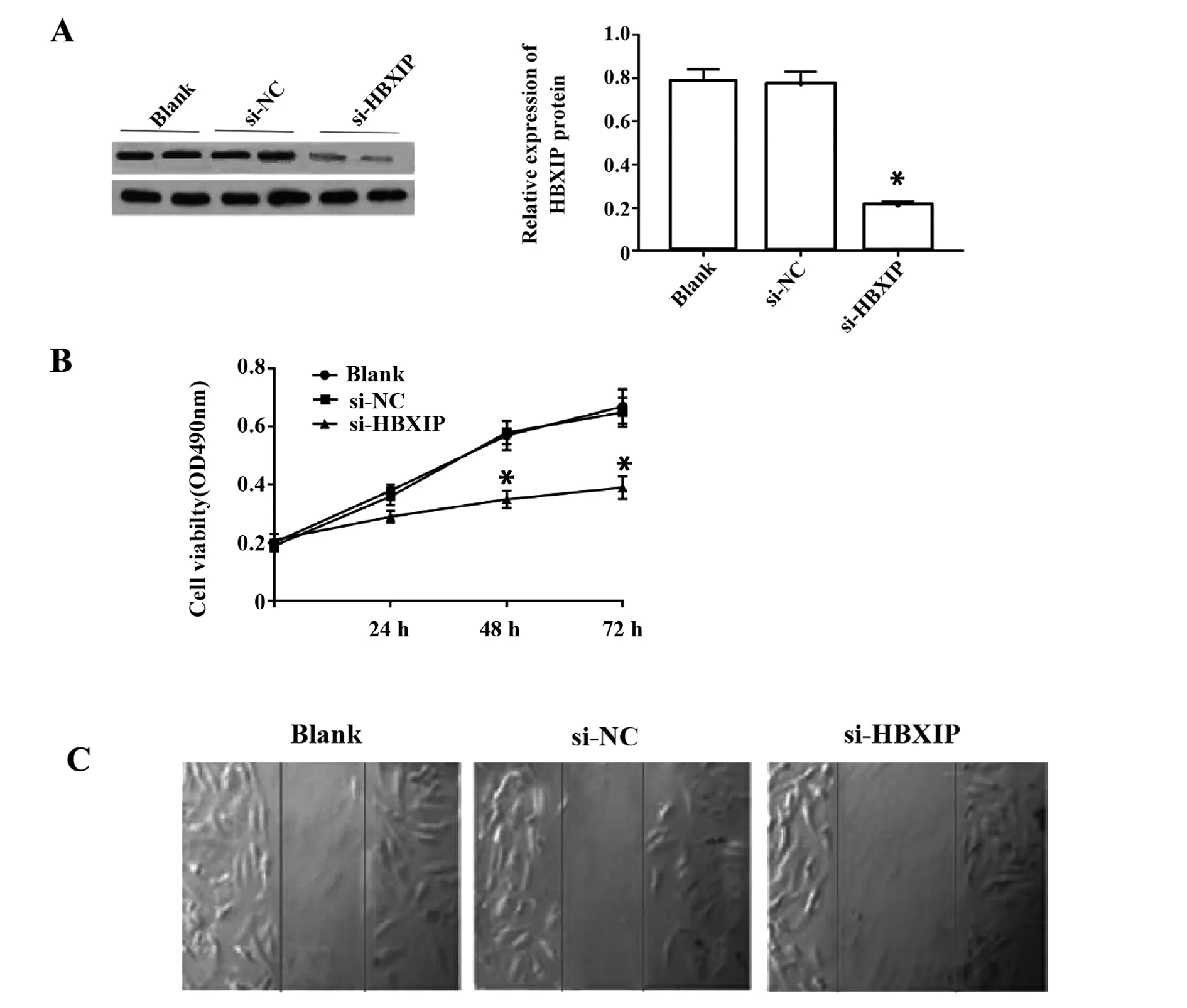
图4 沉默HBXIP对肝癌细胞HepG2增殖和迁移的影响Fig.4 Effect of silencing HBXIP on proliferation and migration of HepG2 cellsNote: Compared with blank group and siNC group,*.P<0.05.
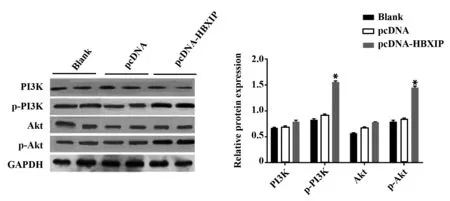
图5 HBXIP过表达对肝癌细胞HepG2中PI3K/Akt通路的影响Fig.5 Effect of HBXIP overexpression on PI3K/Akt pathway of HepG2 cellsNote: Compared with blank group and pcDNA group,*.P<0.05.

图6 LY294002对过表达HBXIP的肝癌细胞增殖和迁移的影响Fig.6 Effect of LY294002 on proliferation and migration of hepatoma cells overexpressing HBXIPNote: Compared with blank group and pcDNA group,*.P<0.05;compared with pcDNA-HBXIP group,#.P<0.05.
2.6LY294002对过表达HBXIP的肝癌细胞增殖和迁移的影响 与pcDNA-HBXIP组比较,pcDNA-HBXIP+LY294002组肝癌细胞增殖活性明显受到抑制(P<0.05,图6A),细胞迁移率明显降低(P<0.05,图6B)。说明阻断PI3K/Akt信号通路能够逆转过表达HBXIP对肝癌细胞增殖和迁移能力的促进作用。
3 讨论
肝癌是威胁全球人类健康的主要恶性肿瘤之一,2014年中国分地区恶性肿瘤发病和死亡分析报告显示[9],肝癌在我国中、东、西部地区死亡率均居第2位。肝癌预后危险因素分析表明,肿瘤大小、血管侵犯、淋巴结转移是影响肝癌预后的独立危险因素[10,11]。控制癌细胞增殖和迁移对肝癌临床治疗及预后改善具有重要意义。
人的HBXIP基因定位于染色体1p13.3,编码分子量约19 kD的蛋白。最初认为HBXIP与乙型肝炎病毒X蛋白(HBx)的C末端结合,作为癌蛋白在控制细胞增殖、凋亡和分裂中发挥作用。近年来越来越多的研究关注HBXIP在癌症发生及进展中的分子机制,HBXIP在乳腺癌中高表达,通过激活转录因子Sp1上调成纤维细胞生长因子4(FGF4)促进乳腺癌细胞迁移,通过转录因子E2F1诱导PKM2上调表达促进乳腺癌细胞增殖[12,13]。HBXIP通过激活转录因子c-Myb上调Hippo通路下游效应蛋白YAP,促进肝癌生长[14]。提示HBXIP作为一种癌蛋白可通过调节癌相关转录因子表达激活癌症细胞生长相关通路,进而促进癌症进展。
本研究结果表明,HBXIP在肝癌细胞株HepG2、Hep3B、Huh7中均高表达,以肝癌HepG2细胞为研究对象,构建过表达HBXIP和抑制表达HBXIP的肝癌细胞,发现过表达HBXIP明显促进肝癌细胞增殖和迁移,而抑制HBXIP表达后肝癌细胞增殖和迁移能力明显降低。说明HBXIP在肝癌细胞中高表达对细胞增殖和迁移具有促进作用,抑制HBXIP可能是肝癌的潜在治疗靶点。
PI3K/Akt信号通路是真核细胞中重要的信号转导通路之一,通过影响下游多种效应因子的活化状态在促进细胞增殖、抑制细胞凋亡、促进肿瘤耐药等多种生物过程中起关键作用[15-17]。HBXIP基因过表达促进腺样囊性癌细胞株ACC-M增殖、迁移和侵袭,其作用机制可能与促进PI3K、Akt磷酸化有关[18]。本研究结果发现,HBXIP在肝癌细胞中过表达后细胞中PI3K和Akt总体水平无明显变化,但p-PI3K、p-Akt蛋白表达明显升高,说明HBXIP在肝癌细胞中高表达能够促进PI3K、Akt磷酸化,即激活PI3K/Akt信号通路。有研究表明,PI3K/Akt信号通路在维持HepG2细胞中肿瘤干细胞比例及特性中起重要作用,是肝癌对索拉菲尼耐药的重要因素,也是调节肝癌细胞生长、增殖、迁移和侵袭的重要机制[19-21]。为证实HBXIP促进肝癌细胞增殖和迁移的作用是否与激活PI3K/Akt信号通路有关,本研究用LY294002阻断PI3K/Akt信号通路,发现过表达HBXIP的肝癌细胞增殖和迁移能力明显降低,说明与腺样囊性癌细胞中一样,HBXIP对肝癌细胞增殖和迁移的促进作用与PI3K/Akt信号通路有关。
综上所述,本研究初步证明HBXIP在肝癌细胞中高表达,可能通过激活PI3K/Akt信号通路促进肝癌细胞增殖和迁移,提示靶向干扰HBXIP的表达可能对改善肝癌预后具有积极意义。但该作用途径中的具体分子机制仍需进一步深入探讨。
