电针对神经病理性疼痛伴发焦虑大鼠行为学及缰核HCN1表达的影响
2020-05-13
浙江中医药大学第三临床医学院 杭州 310053
慢性疼痛复杂难治,而神经病理性疼痛是其中最常见的一类,它由神经系统的损伤或炎症引起[1]。临床研究提示,慢性疼痛可导致焦虑,而焦虑能增强痛觉,长期慢性疼痛伴发焦虑、抑郁的人群比例可高达 57.4%[2]。目前,电针(electro-acupuncture,EA)对神经病理性慢性疼痛的疗效已经得到广泛认可[3]。临床研究证实,EA还能缓解由慢性疼痛伴发的焦虑情绪,但对相关机制的研究较少。缰核是中枢神经系统单胺类神经调节系统的负调控中心,在精神类疾病如焦虑症与抑郁症的发病中起着重要作用[4]。以往研究证实缰核是针刺镇痛的重要环节[5],但其在针刺调控精神障碍中的作用尚不清楚。超极化激活环核苷酸门控通道蛋白(hyperpolarization-activated cyclicnucleotide-gated channels,HCN)属于孔隙环离子通道超家族的环核苷酸门控通道离子通道亚组,该通道有4种亚型,其中HCN1广泛分布于神经系统[6]。研究报道,神经病理性疼痛患者神经损伤后,表达HCN的轴突在损伤处聚集,而敲除HCN1后大鼠焦虑抑郁情绪能够得到明显改善[7-8]。由此可见,HCN通道在神经病理性疼痛及其诱发的精神情绪变化中发挥了重要作用,是疼痛和情绪变化可能的“交叉点”。
由此,本研究拟通过坐骨神经分支选择性损伤(sciatic nerve branch selective injury,SNI) 法制备神经病理性疼痛模型,观察大鼠双侧机械性痛阈(mechanical paw withdrawal thresholds,MPWTs)及焦虑情绪的变化,并观察EA干预对双侧缰核HCN1与cfos表达的影响,初步探讨EA调控神经病理性疼痛伴发精神障碍的可能机制。
1 材料和方法
1.1 动物 清洁级健康雄性SD大鼠32只,购于上海斯莱克实验动物有限责任公司 [实验动物生产许可证号:SCXK(沪)2017-0005],体质量(220±20)g,委托浙江中医药大学实验动物中心饲养 [实验动物使用许可证号:SYXK(浙)2018-0012],饲养期间给予啮齿类动物标准颗粒饲料以及自由饮水,12h明暗循环,室温(23±2)℃。
1.2 主要试剂与仪器 HCN1抗体、驴抗小鼠IgG H&L(Alexa Fluor 488)预吸附二抗、c-fos抗体、驴抗兔IgG H&L(Alexa Fluor 647)预吸附二抗均购于美国 Abcam 公司(批号:ab84816、ab150109、ab190289、150063)。NC12775型 Von-Frey触痛仪购于美国stoelting公司;HM550型冰冻切片机购于美国Thermo Scientific公司;VS120-S6-W型数字病理切片(荧光)扫描分析仪购于日本Olympus公司;SMART V 3.0型动物视频跟踪系统为深圳市瑞沃德生命科技有限公司产品;HANS-200A型韩氏穴位神经刺激仪购于联创科技南京济生医疗科技有限公司。
1.3 动物分组和SNI模型的建立 采用完全随机法将大鼠分为空白对照组、假手术组、SNI组和EA组,每组8只。SNI组和EA组大鼠以10%戊巴比妥钠45mg/kg腹腔注射麻醉,于左侧大腿与股骨平行靠后1cm左右剪开皮肤,分离肌肉组织,暴露出坐骨神经,并小心向下分离至神经分叉。小心分离周围粘连组织和坐骨神经的3条分支胫神经、腓总神经和腓肠神经,以丝线结扎胫神经和腓总神经,同时在神经干结扎的远侧端用眼科剪剪去大约2~4mm神经干,保留腓肠神经,之后逐层缝合组织和表皮[9]。假手术组仅仅暴露与分离左侧胫神经、腓总神经和腓肠神经,不予结扎与离断。空白对照组不予任何处理。
1.4 EA干预 EA组大鼠从造模后第8天采用电针刺激双侧“足三里”“昆仑”[10],刺激频率 2Hz,起始强度 1mA、15min,而后调整为 2mA、15min,30min/次,1次/d,共治疗3次。
1.5 大鼠MPWTs测定 将大鼠置于测痛架上,适应环境15min后,观察并调整使大鼠左后足部可通过铁丝网眼,使用Up and Down法测定MPWTs。分别选用力度为0.4、0.6、1.0、2.0、4.0、6.0、8.0、15.0 和 26.0g 的Von Frey纤维丝,首先从4.0g开始,将Von Frey纤维丝置于大鼠左后足腓肠神经支配的足底外侧1/3区域(避开足垫),轻微垂直用力至Von Frey纤维丝弯曲成S形,刺激时间每次持续5s,间隔大于2min,若大鼠出现缩足/逃逸行为则为阳性反应,记为“X”,换小一级力度的Von Frey纤维丝继续刺激;反之以“O”表示,更换为大一级力度的Von Frey纤维丝继续刺激,直到出现第一对前两个有效符号不相同(即“XO”或“OX”)的记录,再连续重复测量4次,如可得到“OOOXXOOX”的序列,以依据公式 MPWTs(g)=(10[Xf+κδ])/10 000 计算痛阈。其中κ值由序列组合查表获得,序列中最后一根刺激丝的对数值记为Xf值,选取的各个刺激丝力度取对数后差值的平均值记为δ,本实验中约为0.231[11]。若连续5次测量均为阴性反应,则痛阈值为26.0g;反之若均为阳性反应,则痛阈值为0.4g。于造模前,造模后l、3、5、7、8、9及10d 分别检测大鼠双足MPWTs的变化。
1.6 旷场实验 具体操作参考文献[12]进行。将大鼠放入一个100cm×100cm×50cm的黑色敞箱中,敞箱底面平均划分为16个小方格,中间4个为中央区,其他12格为周围区。每只大鼠实验前将箱体用酒精棉球擦拭,以防大鼠留下的尿液和粪便影响观察。实验前1d所有大鼠置于实验室1h以适应环境。第2天分别将每只大鼠按照头部背对实验者的方向放置在箱体的中央区中,以动物视频跟踪系统记录大鼠5min内的探索情况,计算大鼠进入中央区次数、中央区停留时间、中央区运动距离和旷场内运动总距离。
1.7 免疫荧光检测大鼠缰核c-fos和HCN1表达水平 实验结束后断头处死大鼠,以0.9%氯化钠150mL心脏灌注,然后4%多聚甲醛300mL滴注,分离大脑后以4%多聚甲醛固定24h,蔗糖溶液梯度脱水,过液氮后保存于-80℃冰箱备用。采用贴片法,37℃回温孵育1h,磷酸盐缓冲液 (phosphate buffer saline,PBS)漂洗3次后以PBS稀释的10%驴血清封闭孵育 1h,分别滴加 c-fos抗体(稀释比例 1:700)与HCN1 抗体(稀释比例 1:400),4℃过夜。次日 37℃复温45min后,以PBS漂洗3次,分别滴加驴抗兔IgG(稀释比例 1:800)与驴抗小鼠 IgG(稀释比例 1:400)二抗,37℃孵育1h,漂洗后室温避光晾干,滴加抗荧光淬灭封片液封片。采用不含一抗的稀释液替代一抗,作为阴性对照,其余条件不变。采用数字病理切片(荧光)扫描分析仪观察并拍片。以阴性对照为参考,使用Image Pro Plus 6.0软件进行分析,分别计算大鼠患侧与健侧内侧缰核 (medial habenular nucleus,MHb)、外侧缰核外侧部分 (lateral habenular nucleus lateral part,LHbL)和外侧缰核内侧部分(lateral habenular nucleus medial part,LHbM)的平均光密度(integrated optical density,IOD)。
1.8 统计学分析 采用SPSS 20.0统计软件进行统计学分析,计量资料以±s表示。多组间比较采用单因素方差分析;组间两两比较,满足方差齐性时采用LSD-t检验,方差不齐时采用Dunett’s T3检验,以P<0.05为差异有统计学意义。
2 结果
2.1 各组大鼠 MPWTs比较 与空白对照组比较,假手术组患侧MPWTs在造模后第1、3天降低,第5天开始升高,直至第10天,但差异均无统计学意义 (P>0.05)。与假手术组比较,造模后第1天至第10天,SNI组大鼠患侧MPWTs均降低(P<0.01)。与SNI组比较,造模第1天至第7天,EA组MPWTs差异无统计学意义(P>0.05),EA干预后EA组MPWTs升高(P<0.01),一直维持到造模后第10天。各组大鼠健侧MPWTs所有时点差异均无统计学意义(P>0.05)。见图1。

图1 各组大鼠不同时点MPWTs比较Fig.1 Comparison of MPWTs at different time points in each group
2.2 各组大鼠旷场实验结果比较 与空白对照组比较,造模后第10天假手术组运动总距离、进入中央区次数、中央区停留时间以及中央区运动距离差异均无统计学意义(P>0.05),表明假手术组没有产生焦虑样情绪变化。与假手术组比较,SNI组运动总距离和中央区运动距离缩短(P<0.01,P<0.05),进入中央区次数减少(P<0.01),中央区停留时间减少,但差异无统计学意义 (P>0.05);与空白对照组比较,SNI组中央区停留时间减少,差异有统计学意义(P<0.05)。与SNI组比较,EA组大鼠运动总距离、进入中央区次数、中央区停留时间均增加 (P<0.05,P<0.01,P<0.01),但中央区运动距离差异无统计学意义(P>0.05)。见图 2。
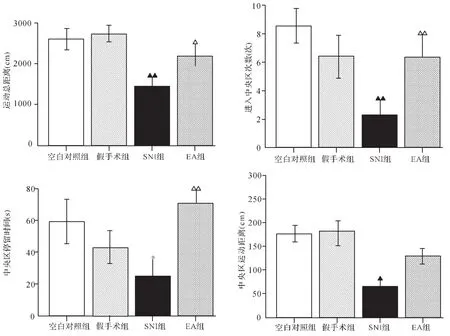
图2 各组大鼠旷场实验结果比较Fig.2 Comparison of the open field experimental results in each group
2.3 各组大鼠缰核HCN1表达水平比较 大鼠的缰核分为MHb、LHbL和LHbM[13]。见图3。与空白对照组比较,造模后第10天假手术组和SNI组大鼠健侧MHb、LHbM和LHbL的HCN1表达水平均升高,差异无统计学意义(P>0.05)。与空白对照组比较,假手术组患侧 MHb、LHbL的HCN1仅少量表达,LHbM表达较多,但差异均无统计学意义(P>0.05)。与假手术组比较,SNI组患侧各部分HCN1表达水平均明显增高(P<0.01,P<0.01,P<0.01);与 SNI组比较,EA 组患侧各部分 HCN1 表达水平均降低(P<0.01,P<0.01,P<0.01)。见图 4、5。
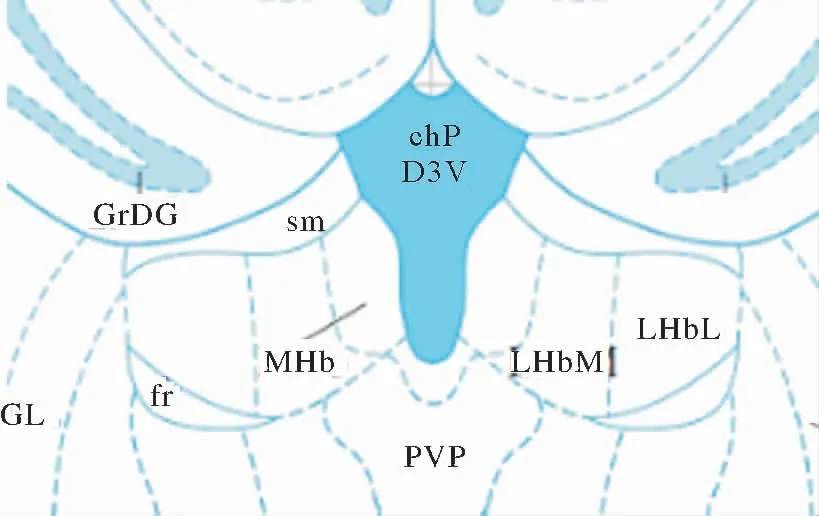
图3 大鼠缰核示意图(Bregma 3.36mm)Fig.3 Schematic diagram of rat habenuclar nucleus(Bregma 3.36mm)
2.4 各组大鼠缰核c-fos表达水平比较 造模第10天,各组大鼠健侧MHb和LHbL的c-fos表达水平差异均无统计学意义(P>0.05)。与空白对照组比较,假手术组健侧LHbM的c-fos表达水平差异无统计学意义(P>0.05);但与假手术组比较,SNI组 c-fos表达水平升高明显(P<0.01);而与 SNI组比较,EA组 cfos表达水平明显降低(P<0.01)。
与空白对照组比较,假手术组患侧MHb和LH-bL的c-fos表达水平差异无统计学意义(P>0.05),而患侧LHbM的c-fos表达水平升高(P<0.01);与假手术组比较,SNI组患侧MHb和LHbL的c-fos表达水平均升高(P<0.05,P<0.01);SNI组患侧 LHbM 的 cfos表达水平虽进一步升高,但差异无统计学意义(P>0.05)。与 SNI组比较,EA 组患侧 MHb、LHbL 和LHbM 的 c-fos表达水平均下降 (P<0.05,P<0.01,P<0.01)。见图 6、7。
图4 各组大鼠缰核HCN1表达(100×)Fig.4 HCN1 expression of habenuclar nucleus in each group(100×)
3 讨论
神经病理性疼痛由神经系统的损伤或炎症引起,以痛阈过敏、异常痛觉和自发疼痛为特征[14],其发病机制尚不明确。目前较理想的神经病理性疼痛动物模型主要有4种:SNI模型、坐骨神经慢性压榨模型、坐骨神经部分结扎模型和脊神经选择结扎模型[15]。SNI模型方法简单、重复性高、运用广泛,且疼痛仅累及患侧[9]。本研究中SNI大鼠模型在造模后第1天患侧MPWTs显著下降,一直持续到实验结束,而对健侧痛阈几乎无影响,且造模成功率为100%,与文献报道一致。
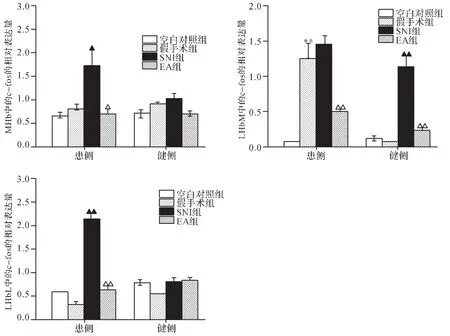
图7 各组大鼠缰核c-fos表达比较Fig.7 Comparison of c-fos expression of habenuclar nucleus in each group
临床与实验研究均发现,慢性疼痛可导致焦虑,而焦虑能增强痛觉,一般疼痛4~8周后才会出现焦虑样行为或抑郁样行为[15],而神经病理性疼痛能够更早地诱发情绪变化[16]。同时有研究证实,左侧疼痛比右侧疼痛更容易诱发焦虑样情绪[17]。本实验制备左侧SNI模型,观察发现SNI大鼠在造模后第7天已经产生焦虑情绪,由此选择在该时间点行EA干预。以往研究证实,低频EA对神经病理性疼痛包括糖尿病神经痛、坐骨神经痛等诱导产生的痛觉过敏具有良好的抑制作用[3]。低频EA刺激“足三里”穴能较好地抑制脊髓神经结扎模型大鼠的机械痛觉过敏,这种效应可以一直持续到造模后2周,但是大多数研究仅仅观察导致这种疼痛敏化以及EA干预的背根神经节(dorsal root ganglion,DRG)或者脊髓机制[3,18],低频 EA 对神经病理性疼痛引发的焦虑抑郁的调控作用则少见于报道。
经典的旷场实验通过观察大鼠在方形敞箱等开阔环境中的自主行为与探究行为,以了解大鼠的焦虑心理。正常动物的探究特性使其在周边活动并使其产生进入中央区域活动的动机,而焦虑动物因对环境恐惧会减少其运动总量,且主要在周边区域活动,在中央区域活动较少[12]。EA干预3次即可以观察到大鼠患侧MPWTs升高的同时,其运动总距离增加,进入中央区的时间和次数也增加了,中央区运动距离也有增加的趋势,但差异无统计学意义,推测原因可能与本研究样本量较少有关。本研究显示,EA在干预疼痛的同时能够早期干预疼痛伴发的焦虑样精神障碍。文献报道,在EA治疗慢性压力引起的抑郁模型中可以观察到EA快速起效,仅7d就可以产生抗抑郁效应[19]。本实验室其他研究小组也发现高频EA能够快速干预痛-抑郁二联征大鼠的痛阈和抑郁情绪[20]。然而以往探讨EA对抗焦虑抑郁等精神障碍的作用时,往往仅探讨其与单胺类神经调节系统的关系[20-21]。临床治疗焦虑抑郁等精神障碍时,用药早期中枢5-羟色胺(5-hydroxytryptamine,5-HT)等单胺类物质水平即发生显著改变,但焦虑症状的改善往往较慢,常常需要几周时间[22],因此笔者推测EA快速干预神经病理性疼痛伴发的焦虑情绪可能还有其他关键机制。
韩济生[5]提出“中脑边缘镇痛回路的假说”,发现在包括导水管周围灰质、伏核、杏仁核和缰核的任何一个核团中微量注射纳洛酮,能够降低75%以上的针刺镇痛效应,证实了缰核在针刺镇痛中的重要作用。而近年的研究发现,缰核尤其外侧缰核是中枢神经系统中单胺类神经调节系统的负调控中心,在焦虑抑郁等精神障碍调控中起到重要作用[4]。c-fos被认为是神经元活动的标志物,它在正常大鼠神经元内极少被激活,其表达正是中枢对各种伤害性刺激的应答反应,且其表达的水平与所受到的刺激强度呈正相关[23]。本研究观察到,SNI组大鼠患侧 MHb、LHbM和LHbL的c-fos表达均显著升高,这表明缰核神经元在SNI模型中被强烈激活,产生了积极的应答,而EA可能通过调控其表达,实现其干预作用。值得注意的是,假手术组患侧和SNI组健侧的LHbM的c-fos也高度表达,其原因是否与假手术组早期MPWTs降低,以及与其他痛阈或者情绪障碍相关,尚需要更多实验进一步进行探讨。
HCN在神经病理性疼痛中扮演了重要的开关角色,为疼痛和情绪变化可能的“交叉点”[24]。该通道有4种亚型,即HCN1~4[6],在细胞膜超极化达到-60mV至-90mV时可以产生一种超极化内向电流(hyperpolarization activated inware current,Ih)[25]。在神经病理性疼痛中,神经损伤后Ih电流产生密度增加,表达HCN的轴突在损伤处聚集,HCN1敲除小鼠对冷刺激的阈值下降了一半[26]。另有研究发现,HCN1以及HCN通道的辅助亚基三角形四肽(tetratricopeptide,TPR)结构域相互作用蛋白敲除的小鼠在动物行为学检测中都表现出了抗焦虑、抗抑郁的结果[27]。
文献显示HCN1广泛分布,但其在正常大鼠缰核中仅少量表达[28]。本实验发现SNI模型中患侧缰核的3个部分MHb、LHbM与LHbL中HCN1均高表达,健侧改变不明显,显示疼痛或者情绪变化均可能影响缰核HCN1的表达,而EA能够起到很好的抑制作用,这表明EA的镇痛与抗焦虑作用与缰核HCN1表达密切相关,其机制值得进一步探讨。
