两孔胸腔镜下肺段切除和肺叶切除治疗早期非小细胞肺癌疗效比较
2020-05-13汪令伟焦方磊李钦传
刘 刚,汪令伟,董 林,焦方磊,李钦传
(同济大学附属东方医院胸外科,上海 200120)
2018年底美国癌症学会发表的《2018年全球癌症统计数据》[1]显示,2018年全球新增癌症病例1 800万,死亡病例960 万,其中,我国新增病例380.4 万,死亡病例229.6 万,我国癌症发病率及死亡率位居全球首位。2018《中国城市癌症数据》报告显示,全国恶性肿瘤新发病例数380.4 万例,平均每天超过1 万人被确诊为癌症,每分钟有7 个人被确诊为癌症。因肺癌的发病率与死亡率均居我国城镇居民恶性肿瘤的首位,肺癌现已成为威胁我国人民生命的主要恶性肿瘤[2]。临床上将肺癌主要分为小细胞肺癌(small cell lung cancer,SCLC)和非小细胞肺癌(non⁃small cell lung cancer,NSCLC)两大类,而 NSCLC 占肺癌总比例的80%~85%。手术是早期NSCLC 的首选治疗方案,也是可能达到肺癌治愈效果的唯一办法。近些年,随着微创理念的普及以及腔镜技术的发展,胸腔镜下手术在NSCLC 的治疗中得到了极大的推广与应用。当肿瘤直径≤2 cm 时,对肿瘤行段切及叶切具有相近的肿瘤学预后效果[3⁃5]。通过胸腔镜辅助下对NSCLC 行肺段切除或肺叶切的治疗,均可达到令人满意的治疗效果,但优先选用何种术式进行治疗尚无定论。本研究比较胸腔镜下肺段切除术、肺叶切术治疗早期NSCLC 的术后疗效分析,希望能够对临床治疗方案的优化提供一定的理论依据。
1 资料与方法
1.1 一般资料
选取同济大学附属东方医院2017年8月至2018年10月同一医疗手术团队(且单一术者)收治的接受胸腔镜下肺段切除或肺叶切除、术后病理分期证实不超过IA2 期(2018年NCCN TNM 分期)的NSCLC 患者110 例,根据手术方式分为肺段切除组(n=60)与肺叶切除组(n=50)。入组标准:(1) 术前胸部CT 检查证实为肺内周围型单发肺结节;(2) 肿瘤直径≤2 cm;(3) 肺部结节磨玻璃成分≥50%;(4) 随访肿瘤倍增时间≥400 d;(5) 患者可耐受手术且既往无其他部位恶性肿瘤病史。排除标准:(1) 术后病理证实为非 NSCLC 的患者;(2) 术后病理证实分期>IA3 期的 NSCLC 的患者;(3) 存在精神或者行为异常,无法有效配合的NSCLC 患者;(4) 术中胸腔粘连严重或大失血而中转开胸的NSCLC 患者;(5) 存在活动性细菌或真菌感染;(6) 同时或异时性(在过去 5年内)双重癌症;(7) 间质性肺炎、肺纤维化或严重肺气肿;(8) 使用全身类固醇药物;(9) 存在无法控制的糖尿病和(或)高血压;(10) 术后接受放化疗的 NSCLC 患者。患者一般临床资料:两组患者年龄、性别、及肺部结节直径相比较,差异无统计学意义(P>0.05),见表1。
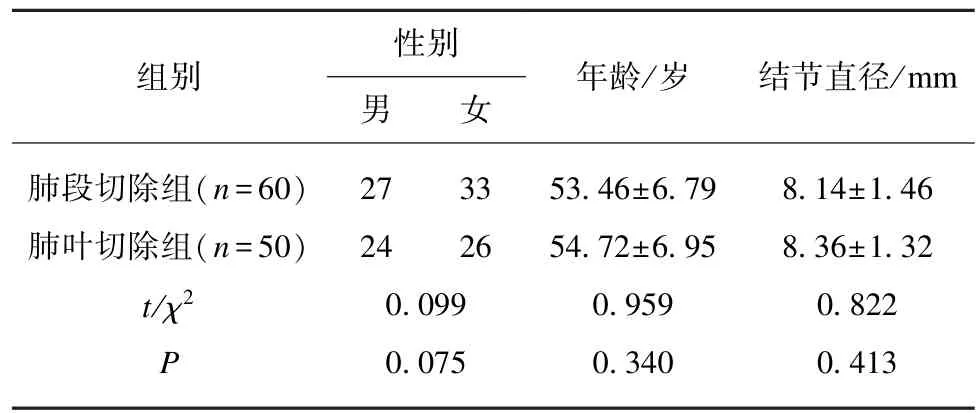
表1 患者临床资料Tab.1 Clinical data of patients
1.2 手术方式
胸腔镜下肺段切除与肺叶切除采用同样的手术入路。双腔插管麻醉成功后,选健侧卧位,腋下垫胸枕及手术台调为折刀位,患侧上臂固定于头侧手臂架上,取腋中线第7 或8 肋间切长1~1.5 cm 切口作为胸腔镜观察孔。在胸腔镜置入观察下于腋前线第5 或第 6 肋间作 2 ~2.5 cm 切口作为操作孔。若有胸腔粘连,用电凝钩分离胸腔粘连。手术切除病灶均离切缘≥2 cm 或≥肿瘤直径,保证切缘阴性。游离及切断血管、支气管顺序均为肺静脉-肺动脉-支气管。且均行N1 和N2 组淋巴结采样,其中至少包括3 个纵隔引流区淋巴结(右肺上中叶行第2R、4R、及7 组清扫;右肺下叶清扫第 4R、7 及 9 组;左肺上叶清扫第 5、6、7 组;左肺下叶清扫第 7、8、9 组;及术中可见其余明显肿大的淋巴结)。并确保术中冰冻送检切缘(-)方可充分止血,冲洗胸腔,确定无漏气及活动性出血后于锁中线第二肋间留置“猪尾巴”胸引管1 根,于观察孔留置28#硅胶胸引管1根,逐层缝合关胸。
1.3 观察指标
观察两组治疗指标(手术时长、术中出血量、术后住院时间)、术后并发症指标(肺漏气、肺不张、心律失常、发热、脓胸、乳糜胸、支气管胸膜瘘、肺栓塞),手术1 个月后肺功能下降情况以及术后局部复发率、累积生存率等,并对数据进行统计学分析。
1.4 统计学处理
数据由SPSS 19.0 统计软件进行统计学分析。计数资料以(n,%)表示,采用χ2检验;计量资料以(±s)表示,采用独立样本t检验比较。P<0.05 表示差异具有统计学意义。
2 结 果
2.1 两组患者治疗情况比较
肺段切除组患者手术时间、术中出血量均小于肺叶切除组,差异有统计学意义(P<0.005);虽然肺段切除组术后住院时间较肺叶切除组患者短,但是差异无统计学意义(P>0.05),见表2。
表2 两组患者的治疗情况比较Tab.2 Comparison of treatment between the two groups (±s)
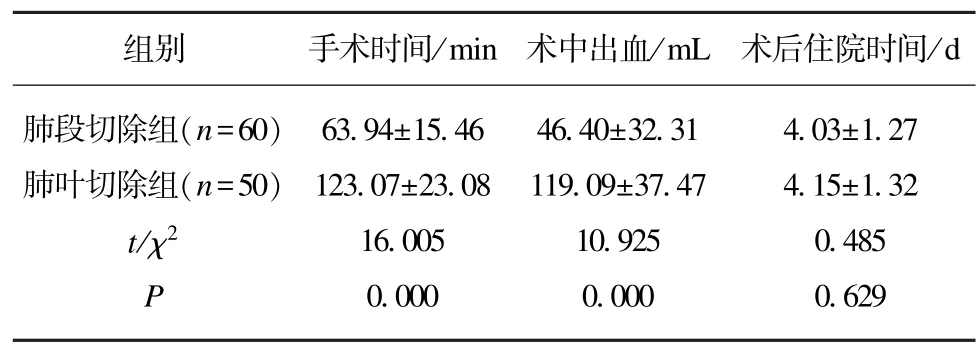
表2 两组患者的治疗情况比较Tab.2 Comparison of treatment between the two groups (±s)
______组别 手术时间/min 术中出血/mL 术后住院时间/d肺段切除组(n=60) 63.94±15.46 46.40±32.31 4.03±1.27肺叶切除组(n=50) 123.07±23.08 119.09±37.47 4.15±1.32 t/χ2 16.005 10.925 0.485 P 0.000 0.000 0.629
2.2 两组患者术后并发症比较
肺段切除组术后肺漏气的发生率高于肺叶切除组,差异有统计学意义(P<0.05)。肺段切除组术后肺不张、心律失常、发热的发生率虽然低于肺叶切除组,但差异无统计学意义(P>0.05);两组术后乳糜胸、脓胸、支气管胸膜瘘及肺栓塞等严重并发症相比较,差异无统计学意义(P>0.05),见表3。
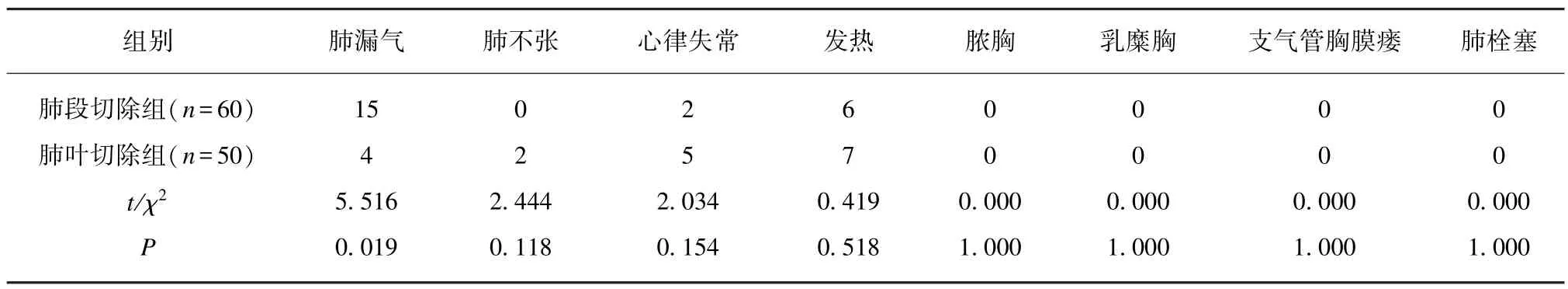
表3 两组患者的术后并发症比较Tab.3 Comparison of postoperative complications between the two groups
2.3 两组患者肺功能比较
术前两组患者的肺功能指标第1 秒用力呼气容积(FEV1)、每分钟最大通气量(maximal voluntary ventilation,MVV)差异无统计学意义(P>0.05);术后肺功能(术后肺功能评估均于术后1 个月患者复查时进行)比较,肺段切除组指标均优于参照组,且组间差异有统计学意义(P<0.05),见表4。
2.4 两组预后情况比较
在术后1~2年内的随访期间内,肺段切除组及肺叶切除组均无局部复发患者,组间差异无统计学意义(t/χ2=0.000,P=1.000)。随访至今,肺肺切除组和肺叶切除组患者也均无死亡,两组患者累积生存率100%。
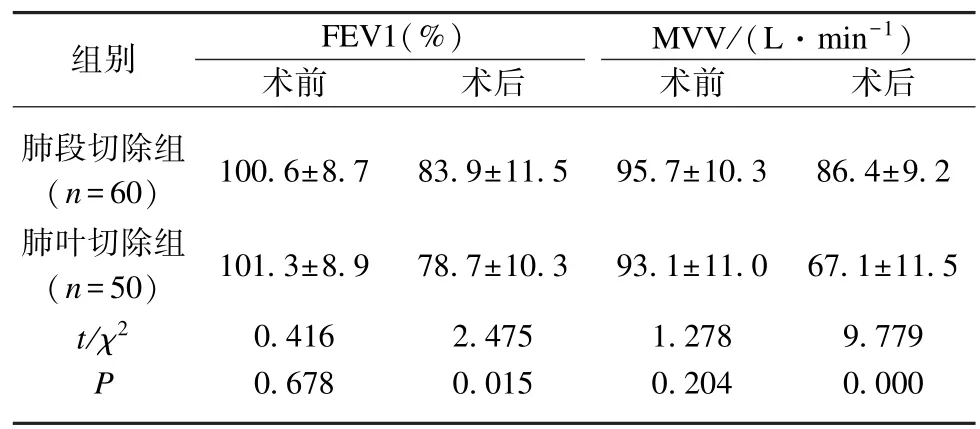
表4 两组患者肺功能比较Tab.4 Comparison of pulmonary function between the two groups
3 讨 论
肺癌作为一种危害性较大的恶性肿瘤,近年来肺癌的发病率与死亡率均居我国城镇居民恶性肿瘤的首位,现已成为威胁我国人民生命的主要恶性肿瘤[1]。临床上将肺癌主要分为 SCLC 和 NSCLC 两大类,而NSCLC 占肺癌总比例的80%~85%,其5年生存率不足 20%[6]。薄层 CT 扫描磨玻璃结节(ground⁃glass opacity,GGO)的术前放射学表现已被证明可以很好地预测预后[7⁃9]。随着低剂量 CT 在肺癌筛查中的推广应用及高分辨率CT 在早期肺癌影像诊断中的普及和人们健康体检意识的提高,大量NSCLC 在早期被检出[10⁃11],患者得以及时就医并经由手术治疗而达到根治的效果[12]。外科手术是治疗NSCLC 的首选方法,也是可能达到肺癌治愈效果的唯一办法。近些年,随着微创理念的普及以及腔镜技术的发展,胸腔镜辅助下手术在NSCLC 的治疗中得到了极大的推广与应用。
美国国立综合癌症网络(NCCN)指南中对早期NSCLC 的首选推荐术式为标准的肺叶切除术。近年来随着胸外科医师对肺段切除的逐渐深入实践及对肺叶切除的进一步思考,肺段切除逐步得到多数胸外科医师的接受,并被广泛推广。NCCN 指南中进一步指出,亚肺叶切除术(即肺段切除术或肺楔形切除术),在技术条件允许且不增加手术风险的前提下可用于以下情况。(1) 肺功能差或因其他严重合并症,而不能耐受肺叶切除术。(2) CT 提示为肺内周围型非侵袭性病变(指位于肺实质外侧1/3),且病变直径≤2 cm,并具有以下任一特征:病理证实为单纯的原位腺癌(adenocarcinoma in situ,AIS);CT 随防1年以上高度怀疑为恶性肿瘤,磨玻璃样成分≥50%;影像学检查证实肿瘤倍增时间≥400 d[13]。虽然胸腔镜下肺叶切除+淋巴结清扫术是NCCN 指南推荐治疗早期NSCLC 的标准术式,其具有创伤小、出血量少及住院周期短的优点。但目前临床上对手术治疗早期NSCLC 患者时选择何种术式更加适宜仍存在许多争论。从微创的理念来讲,肺叶切除并不十分契合在能保证疗效的前提下尽量保留多正常组织的微创理念[14⁃15]。近 10年来,随着胸腔镜器械的不断更新换代、胸外科医师胸腔镜手术技术的不断提升,越来越多的胸外科医师将胸腔镜下肺段解剖性切除应用于早期NSCLC 的治疗之中,并取得了不劣于胸腔镜下肺叶切除的疗效[16⁃17]。
两孔胸腔镜下单纯肺段切除术指在胸腔镜的辅助下,经由常规两孔路径行镜下操作,术中对需切除的肺段动静脉、支气管进行解剖处理[18]。从技术层面上,可将单纯的肺段切除术区分为简单肺段切除和复杂肺段切除两种类型。其中,简单肺段切除包括:双肺背段,双肺尖段及左肺舌段。因为只有一个段间平面需要区分,血管解剖结构变异相对较低,组织更容易暴露,所以这些肺段的切除比较简单;而复杂肺段切除是指除外双肺背段,双肺尖段及左肺舌段及超过一个段间平面的肺段切除。两个或两个以上的肺段间平面使得肺段切除在技术上更加困难,即使是经验丰富的的胸外科医生也难以轻易完成。而位于基底段的肿瘤通常难以通过最多2 个肺段切除,因此基底段的切除不归类于单纯的肺段切除,允许将手术方式转换为肺叶切除术。
本研究发现,对早期NSCLC 患者行胸腔镜下肺段切除术与肺叶切除术后,肺段切除组手术时间、术中出血量少于肺叶切除组,差异具有统计学意义(P>0.05);肺段切除组虽然术后住院时间短于肺叶切除组,但是差异无统计学意义(P>0.05);提示两种术式治疗早期NSCLC 均可取得良好的治疗效果,但是肺段切除对机体损伤小于肺叶切除,术中出血的风险更低。肺段切除住院时间虽然优于肺叶切除,但是差异不明显。肺段切除组术后肺漏气的发生率高于肺叶切除组,差异具有统计学意义(P<0.05)。这可能与肺段切除术对术者手术操作技术要求较高,肺段间缺少绝对界限,其间肺组织联系紧密[15],相应的支气管及血管难以充分暴露,并且需要更多的使用电刀烧灼来打开裂隙界限有关。同时,在本研究观察到一个有意思的现象,相比于肺叶切除需要使用的钉仓(平均5 个),肺段切除需要的略少一些(平均4 个)。这将为患者节省治疗费用,具有一定的经济性,但这也可能是导致患者肺漏气较多的一个原因。肺段切除组术后肺不张、心律失常、发热的发生率虽然低于肺叶切除组,但差异不具有统计学意义(P>0.05),两组术后乳糜胸、脓胸、支气管胸膜瘘及肺栓塞等严重并发症相比较无差异。肺段切除组术后肺功能优于肺叶切除组,差异具有统计学意义(P<0.05)。所有手术患者肺功能和术前相比均有不同程度的损失。肺段切除组对保留患者术后肺功能方面优于肺叶切除组,肺段切除组的患者术后肺功能(FEV1、MVV)的下降比率明显低于肺叶切除组。这对一些因抽烟或老年而致肺功能较差患者尤其有意义[19]。这可能与肺段切除与肺叶切除相比可保留更多的肺组织,能够充分保留患者的肺功能,加快患者术后康复有关。两组患者在随访期间均无局部复发及死亡,表明肺段切除是安全有效的,不劣于肺叶切除。
综上所述,对于早期NSCLC 行两孔胸腔镜下肺段切除术与肺叶切除术,近期预后无差异,表明肺段切除是安全有效的,不劣于肺叶切除。虽然与肺叶切除术相比,肺段切除更有可能发生肺漏气,但是肺段切除术仍具有术中出血少,住院时间短、对患者肺功能的保留更优等优点,整体治疗效果较好,经济花费较少,因此胸腔镜下肺段切除在早期NSCLC的治疗中值得推广应用。
