RNA干扰技术防治新型冠状病毒肺炎的思考和展望
2020-05-13刘鹏飞马文静赵爱华谭天浩俞作仁
刘鹏飞,马文静,赵爱华,谭天浩,赵 倩,俞作仁
(1.同济大学医学院东方医院转化医学研究中心,上海 200120;2.甘肃省武威市中医医院,甘肃 武威 733000)
2019年12月,我国武汉市暴发了新型冠状病毒肺炎(coronavirus disease 2019,COVID⁃19)疫情。截止2020年2月底,全球已经有接近80 000 例确诊患者,近3 000 例感染者死亡。由于新型冠状病毒(SARS⁃CoV⁃2)传染性强、传播速度快、潜伏期长,并且部分无症状患者具有传染性,增加了其隐蔽性和感染力。COVID⁃19 临床症状、传播规律与2003年我国暴发的严重急性呼吸综合征(severe acute respiratory syndrome,SARS)及 2012年中东国家暴发的中东呼吸综合征(Middle East respiratory syndrome,MERS)既有相同之处,也有不同之处。分析SARS⁃CoV⁃2 基因组序列及COVID⁃19 病理特征、临床症状,将有助于寻找有效的预防和治疗手段。本文对SARS⁃CoV⁃2 基因组结构特点、抗病毒药物筛选和研发进展及 RNA 干扰(RNA interference,RNAi)技术抗 SARS⁃CoV⁃2 的应用进行综述。
1 SARS⁃CoV⁃2的结构和序列特征
冠状病毒(coronaviruses,CoVs)是一种 RNA病毒,因在电子显微镜下发现病毒包膜上有大量类似冠状的棘突,故命名为冠状病毒。冠状病毒基因组是一个27~32 kb 正义的单链RNA,其中ORF1a和ORF1b 约占基因组的2/3,它们编码2 个大的重叠多蛋白,最终被加工成RNA 依赖的RNA 聚合酶及其他参与RNA 合成或宿主反应调节的非结构蛋白;基因组的另外1/3 主要负责编码4 种结构蛋白和其他辅助蛋白[1]。4 种结构蛋白为棘突蛋白(spike glycoprotein,S)、包膜蛋白(envelope protein,E)、膜蛋白(membrane protein,M)和核衣壳蛋白(nucleocapsid protein,N)。根据最新的国际病毒分类学委员会(ICTV)分类,冠状病毒分为4 个属(α⁃CoVs、β⁃CoVs、δ⁃CoVs 和 γ⁃CoVs)[2]。冠状病毒会引起各种家畜、野生动物以及人类的疾病,其中α⁃CoVs 和 β⁃CoVs 主要感染哺乳动物,而 γ⁃CoVs 和 δ⁃CoVs 主要感染鸟类[2⁃3]。目前,已鉴定出 7 种可以感染人类的人冠状病毒(human coronavirus,HCoVs),其中包括 α⁃CoVs 属的 HCoV⁃NL63 和 HCoV⁃229E,β⁃CoVs 属的 HCoV⁃OC43、HCoV⁃HKU1、SARS⁃CoV[4]、MERS⁃CoV[5]和 SARS⁃CoV⁃2[6]。不同类型的冠状病毒的致病能力存在较大差异,部分冠状病毒如HCoV⁃OC43 和HCoV⁃229E 是造成普通流行性感冒的主要原因;而有些冠状病毒感染可能引发严重的疾病,甚至威胁生命,例如由 SARS⁃CoV 引起的 SARS、由 MERS⁃CoV 引起的 MERS 和由 SARS⁃CoV⁃2 引起的 COVID⁃19,都造成了大范围的感染和大量患者的死亡[7]。进入21 世纪短短20年以来,已暴发3 次由冠状病毒引起的重大传染病(SARS、MERS 和 COVID⁃19),这深刻警示我们,必须加强对这类病毒的研究,重视对相关疾病的预防和治疗。
SARS⁃CoV⁃2 的基因组由 29 891 个核苷酸组成,共编码9 860 个氨基酸,具有典型的β⁃CoV 基因组结构:5′非翻译区(UTR)、ORF1ab、S 基因、E 基因、M 基因、N 基因、3′UTR 及一些不确定的非结构性开放阅读框[8]。SARS⁃CoV⁃2 基因组共包含 14个编码27 种蛋白质的开放阅读框。位于基因组5′末端的ORF1ab 基因约占基因组的2/3。这些基因编码的蛋白被木瓜蛋白酶样半胱氨酸蛋白酶(papain⁃like cysteine protease,PLpro)和 3C 样丝氨酸蛋白酶(3C⁃like serine protease,3CLpro)裂解,产生非结构蛋白,包括RNA 依赖性RNA 聚合酶(RNA⁃dependent RNA polymerase,RdRp)和解旋酶(helicase,Hel),它们是参与冠状病毒转录和复制的重要酶。基因组的 3′端编码 4 种结构蛋白(S、E、M 和 N 蛋白)和8 种辅助蛋白(3a、3b、p6、7a、7b、8b、9b 和 OFR14 蛋白)[9],见图1。结构蛋白对于病毒-细胞受体结合和病毒体装配至关重要,辅助蛋白除了参与病毒结构的组装外还可能具有免疫调节作用。SARS⁃CoV⁃2 的基因组与蝙蝠 SARS⁃like⁃CoVZXC21 具有 89%的核苷酸同源性,与人类SARS⁃CoV 具有82%的核苷酸同源性。它们之间的主要区别是在基因ORF3b、S 和 ORF8 中,尤其是 S1 和 ORF8[10]。
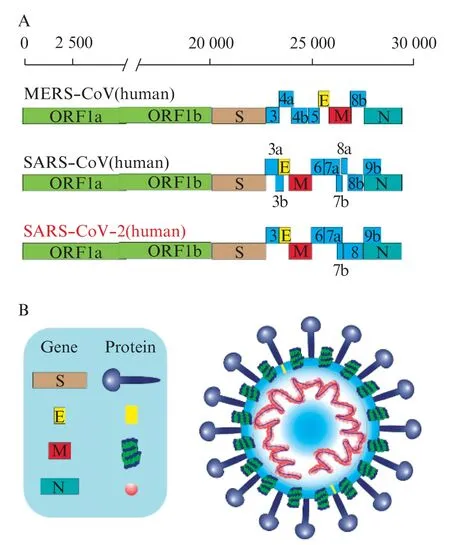
图1 冠状病毒结构示意图[9]Fig.1 Schematic representation of the coronavirus structure[9]
2 抗SARS⁃CoV⁃2药物的筛选
COVID⁃19 是历史上第3 次由冠状病毒引起的严重的重症呼吸道感染类疾病,相比于2003年暴发的SARS 和2012年暴发的MERS,在抗病毒药物筛选方面有了更多的经验可以参考,但也面临着新的挑战。目前,有4 种潜在的抗病毒药物筛选途径[11]。
2.1 从现有广谱抗病毒药物中筛选抗SARS⁃CoV⁃2药物
这些药物已用于治疗其他病毒感染,药效和副作用明确,生产和供应充足,是快速应对疫情的首选药物。例如洛匹那韦/利托那韦是一种固定剂量的蛋白酶抑制剂(protease inhibitor,PI)组合,原本用于治疗 HIV⁃1 感染[12],后来研究发现其对 SARS[13]和 MERS[14]均有明显治疗效果,目前正在用于COVID⁃19 的治疗[15];利巴韦林是一种合成的核苷类似物,在结构上类似于鸟苷,具有广泛的抗病毒活性,通常将其与α-干扰素或聚乙二醇化的α-干扰素联合起来用于治疗慢性丙型肝炎病毒感染[16],目前该方案同样被用于 COVID⁃19 的治疗[15];磷酸氯喹是一种用于治疗疟疾的老药,在中国进行的多中心临床试验中显示出对COVID⁃19 的明显疗效和可接受的安全性,目前已被纳入《新型冠状病毒肺炎诊疗方案(试行第六版)》[15,17];Arbidol(umifenovir)是在俄罗斯和中国批准用于预防和治疗流感的广谱抗病毒化合物。除了用于治疗流行性感冒,Arbidol在体外研究中显示对乙型肝炎病毒、丙型肝炎病毒、基孔肯雅病毒、呼肠孤病毒、汉坦病毒和柯萨奇病毒B5 具有抑制活性,目前该药物也被列入《新型冠状病毒肺炎诊疗方案(试行第六版)》[15,18];复旦大学基础医学院应天雷、武延亮和复旦大学附属中山医院杨振林等教授合作,首次发现SARS 冠状病毒特异性的人类单克隆抗体 CR3022 可以有效结合SARS⁃CoV⁃2 的受体结合域 RBD[19]。
2.2 从传统中药复方中筛选抗SARS⁃CoV⁃2药物
多种传统中药活性成分可通过降低机体炎症因子表达、抑制细胞因子风暴、减少氧化应激-自由基堆积和细胞凋亡、改善机体免疫功能等途径发挥抗病毒功效[20]。疫情发生以来尚未发现特异性的抗病毒药物,但在医生和科学家们的共同努力下,很多患者都成功治愈,中药复方在COVID⁃19 的治疗中发挥了重要的作用[21]。国家卫生健康委员会和国家中医药管理局联合发出通知,推荐在中西医结合救治 COVID⁃19 患者中使用“清肺排毒汤”。该方经国内几个省份推广应用,初步总结,总有效率达到90%以上[22]。另外,吕睿冰等[23]发现中药连花清瘟明显改善了COVID⁃19 疑似病例发热、咳嗽、乏力、气促等症状,并降低转重症比例。但由于中药成分复杂,具体的抗病毒机制还有待进一步研究。
2.3 从其他药物和化合物文库筛选抗SARS⁃CoV⁃2药物
通过药物和化合物文库可以快速高通量地进行抗病毒药物初步筛选,再结合抗病毒活性检测结果,进一步评估药效。如由蒋华良院士和饶子和院士牵头,20 余个课题组参与的中国科学院上海药物研究所和上海科技大学免疫化学研究所抗SARS⁃CoV⁃2病毒感染联合应急攻关团队,利用虚拟筛选和酶学测试相结合的策略,针对已上市药物以及自建的“高成药性化合物数据库”和“药用植物来源化合物成分数据库”进行了药物筛选,发现了30 种可能对SARS⁃CoV⁃2 有治疗作用的化学药物、天然活性产物和传统中药[24]。北京大学基础医学院的王月丹和初明团队,采用自主研发的人工智能药物靶向筛选系统,针对2 674 种已上市的药物以及1 500 种中药提取物进行了药物筛选,发现了多种潜在的ACE2 结合剂。所有这些探索,有望及早用于SARS⁃CoV⁃2 病毒感染的治疗[25]。这种方法的缺点是:尽管许多已鉴定的药物在体外均表现出抗冠状病毒活性,但大多数药物并不能应用于临床,因为它们要么具有免疫抑制作用,要么半数效应浓度(EC50)明显超过在治疗剂量下可达到的峰值血清浓度(Cmax)[11]。
2.4 根据SARS⁃CoV⁃2的特征设计新型靶向药物
可以根据SARS⁃CoV⁃2 的蛋白结构特异性,研发特异的疫苗或抗体;根据SARS⁃CoV⁃2 的基因组序列特异性,设计靶向病毒复制周期中关键酶或者关键结构蛋白的 siRNA 干扰分子;根据 SARS⁃CoV⁃2 感染宿主细胞所依赖的特异性受体,开发靶向宿主受体的mAb 或抗病毒肽;根据 SARS⁃CoV⁃2 被宿主细胞内吞及在宿主细胞中复制所依赖的特定蛋白酶,开发相应的蛋白酶抑制剂等[11]。这类方法设计的新药具有高度的特异性,且药物设计比较灵活。但问题在于,虽然这些药物中的大多数在体外和(或)体内具有较高的抗病毒活性,但它们的药代动力学、药效特性以及副作用等情况尚需在动物和人体试验中进行评估,从研发到临床应用有一个过程,很难用于病毒的突发性感染。尽管如此,针对 SARS⁃CoV⁃2 的疫苗和新药研发依旧刻不容缓,尤其在当前对病毒来源及传播途径尚不明确的情况下,病毒与人类长期共存及在特定环境下再次暴发都是可能的风险。疫苗和新药的研发,将有助于人类对SARS⁃CoV⁃2 及类似病毒感染的预防和治疗。
3 RNAi技术
RNAi 广泛存在于动植物体内,是生物进化过程中为了对抗外源病毒的侵犯、维护细胞正常发育所形成的一种保护机制,是小RNA 分子靶向特异性mRNA 并使其降解以抑制特定基因表达的过程(图2)[26]。双链 RNA(double strand RNA,dsRNA)进入细胞后,一方面与RNA 核酸酶相结合,被酶切成很多被称为小干扰RNA(short interfering RNA,siRNA)的小片段,这一过程被称为干扰的启动阶段;另一方面是和TRBP、Dicer 和Ago2 等蛋白形成多聚核酸酶复合物,该复合物结合于与siRNA 互补的mRNA 上,执行RNAi 的效应功能。与此同时,多聚核酸酶复合物以siRNA 作为引物、mRNA 作为模板,在 RNA 聚合酶的作用下自身扩增,再重复以上被酶切的过程。新生成的siRNA 同样具有诱发RNAi 的作用,通过这种聚合酶链式反应,细胞内siRNA 大量增加,可显著抑制基因的表达。由于RNAi 技术投入少、周期短、操作简单,几乎成为一种标准化分子生物学技术,被广泛应用于基因治疗和基因功能研究等领域[27]。与其他治疗方法相比,RNAi 技术能够高效、特异地下调靶基因的表达水平,这能有效降低或消除患者的不良反应、延长治疗效果、降低治疗成本,是一种十分有前景的疾病治疗方法[28⁃29]。目前,多家公司利用 RNAi的治疗潜力来研发新型治疗药物。美国食品药品监督管理局(FDA)已批准了2 款基于RNAi 技术研发的基因治疗药物:Givlaari(Givosiran sodium)和Onpattro(Patisiran sodium)。前者于 2019年 11月被批准用于治疗急性肝卟啉症,后者于2018年8月被批准用于遗传性转甲状腺素蛋白淀粉样变性[30⁃31]。
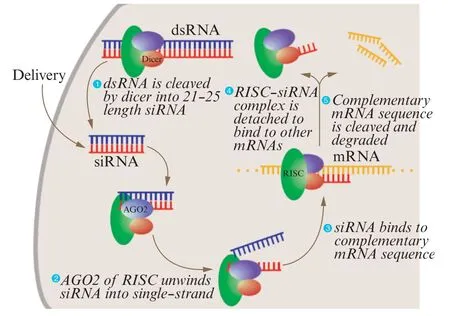
图2 siRNA 介导的 RNAi 干扰机制图[26]Fig.2 Schematic mechanism representation of the siRNA⁃mediated RNAi technique[26]
4 RNAi技术防治SARS⁃CoV⁃2的展望
抗病毒RNAi 的生物防御机制在植物和无脊椎动物中发挥着重要的作用,在哺乳动物中非序列特异性的干扰素反应可能已取代了天然抗病毒RNAi的功能[32⁃33]。越来越多的研究表明,哺乳动物中病毒容易受到人工合成的siRNA 的影响[34],这使通过人工合成siRNA 重激活哺乳动物的天然抗病毒RNAi 的功能进行抗病毒治疗成为可能。目前已有许多应用RNAi 技术进行抗病毒治疗的相关研究。
SARS⁃CoV⁃2 的 S 蛋白是识别宿主细胞受体和感染特定细胞的重要结构。SARS⁃CoV⁃2 正是通过S 蛋白识别人肺上皮细胞 ACE2 蛋白[35],结合到受体细胞,进而侵染细胞,因此不论采用什么手段,阻断病毒S 蛋白与人肺上皮细胞ACE2 蛋白的结合,都是抑制 SARS⁃CoV⁃2 扩散感染的有效途径。有研究显示,针对SARS⁃CoV 的S 基因设计的干扰RNA在细胞水平和恒河猴体内都显示出良好的抗病毒效果[36⁃38]。除 S 蛋白外,E 蛋白、M 蛋白和 N 蛋白也是冠状病毒重要的结构蛋白,对于病毒颗粒的包装至关重要。之前也有人针对SARS⁃CoV 的E 基因、M 基因以及N 基因设计了特异性的干扰RNA,并开发了表达短发夹RNA 分子的重组腺病毒载体,在细胞水平有效抑制了SARS⁃CoV 的基因复制和新病毒产生[39]。冠状病毒的辅助蛋白除参与病毒组装外还可能具有抑制宿主免疫反应以促进病毒复制等功能。例如,MERS⁃CoV 的辅助蛋白 4a、4b 和辅助蛋白5 表现出干扰素拮抗剂活性。尽管尚不能确定SARS⁃CoV⁃2 所有辅助蛋白的具体生物学功能,但这并不影响 RNAi 技术的应用。RNAi 可以从RNA 序列层面,对病毒RNA 进行特异性识别及降解,从根源上“剪切”病毒,达到消灭病毒的效果。在其他病毒已经有成功的报道,比如,针对SARS⁃CoV 的 ORF3a/3b、ORF7a/7b 和 ORF8a/8b 基因设计干扰 RNA,能有效降低辅助蛋白 3a/3b 或 7a/7b 和8a/8b 的表达,抑制 Vero E6 细胞中 SARS⁃CoV 的复制[40]。
RNAi 技术在临床应用方面也存在一些问题。首先是siRNA 的递送问题,涉及siRNA 感染效率,细胞或者病毒本身具有对外源基因的防御机制,因此必须提高siRNA 感染效率以达到治疗效果。其次是针对病毒基因组容易突变的特点,需要灵活设计siRNA 序列或者应用siRNA 组合,同时确保最低限度的脱靶效应。随着各种基因修饰、基因治疗的兴起,越来越多的材料学家们投身于相关递送材料的研究,为siRNA 在人体内高效、安全、靶向性的递送提供了可能[41]。虽然 RNA 病毒易发生突变,但正如前文所述,SARS⁃CoV⁃2 基因组中也存在许多保守的基因序列可以作为药物的稳定靶点,另外siRNA 合成方便,可以灵活应对病毒突变所产生的耐药性[42]。对于 siRNA 的脱靶问题,除了优化siRNA 设计外,提高药物递送的局部靶向性也是很好的解决方案[43]。
COVID⁃19 疫情暴发以来,虽然传统的抗病毒药物例如干扰素、洛匹那韦/利托那韦、利巴韦林及中药等显示了一定的疗效,但仍有不少重症患者因缺乏特异性有效药物而失去生命。目前科学家们正在努力研发特异性疫苗及中药、小分子化合物等抗病毒药物。RNAi 作为一种天然的抗病毒机制,其针对COVID⁃19 特异序列的研究已经启动,有望为COVID⁃19 的治疗带来新的曙光。
