miR-370靶向FoxO1抑制TNF-α 诱导的肝癌细胞增殖、迁移和侵袭
2020-05-12钱丽丽闫秀明张慧张改河南医学高等专科学校检验系微免教研室河南郑州451191
钱丽丽 闫秀明 张慧 张改 (河南医学高等专科学校检验系微免教研室,河南 郑州 451191)
肝癌为全球病死率最高的恶性肿瘤,中国每年约有38.3万人死于该病,其死亡数占世界肝癌死亡量的1/2,致死率仅次于肺癌居第二位〔1,2〕。肿瘤坏死因子(TNF)-α涉及细胞凋亡和细胞增殖,不仅作为促炎细胞因子参与广泛的人类疾病,包括炎症性疾病,也可导致肿瘤的发展〔3,4〕。miRNA为19~25 个核苷酸组成的短链内源性非编码RNA,在肿瘤的发生发展中具有重要的调控作用〔5〕。大量研究报道,miR-370在肝癌中发挥抑制癌症恶化的作用〔6〕,但其作用机制尚未完全清楚。叉头框基因(Fox)广泛存在于各种真核生物细胞中,其中FoxO1为Fox基因家族中的一员〔7,8〕。研究报道,促进FoxO1在肝癌中的转录可抑制肝癌的恶化〔9〕。本研究观察TNF-α处理后HepG-2细胞的增殖、迁移和侵袭情况,并观察过表达FoxO1、抑制miR-370、敲减FoxO1对HepG-2细胞的增殖、迁移和侵袭的影响。
1 材料与方法
1.1材料 人肝癌细胞HepG-2购自美国模式菌种收集中心;DMEM高糖培养基、胎牛血清(FBS)、溴化噻唑蓝四氮唑(MTT)、胰蛋白酶均购自美国Gibco公司;LipofectamineTM2000、二喹啉甲酸(BCA)蛋白定量试剂盒、逆转录试剂盒购自宝生物工程(大连)有限公司;聚偏氟乙烯(PVDF)膜购自德国罗氏诊断有限公司;基质胶、Transwell小室购自美国Corning公司;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)试剂盒、电化学发光液和放射免疫沉淀法(RIPA)蛋白裂解液均购自上海碧云天生物技术公司;双荧光素酶报告基因检测试剂盒购自美国Promega公司。
1.2细胞培养 将肝癌细胞HepG-2培养于含10%FBS的DMEM高糖培养基(含100 U/ml青霉素和100 μg/ml链霉素),置于37℃、5% CO2的恒温培养箱中常规培养,待细胞生长至融合度达到75%左右,用胰蛋白酶消化,每2 d传代1次。
1.3细胞处理与分组 用TNF-α (20 ng/ml)处理肝癌细胞HepG-2 48 h,标记为TNF-α组;pcDNA、pcDNA-FoxO1、anti-miR-con、anti-miR-370、anti-miR-370+si-con、anti-miR-370+si-FoxO1,按照LipofectamineTM2000转染说明书操作步骤转染至HepG-2细胞,转染后用20 ng/ml的TNF-α培养48 h,分别标记为TNF-α+pcDNA组、TNF-α+pcDNA-FoxO1组、TNF-α+anti-miR-con组、TNF-α+anti-miR-370组、TNF-α+anti-miR-370+si-con组、TNF-α+anti-miR-370+si-FoxO1组,实时荧光定量-聚合酶链反应(qRT-PCR)实验检测转染效率。确认转染成功后,用于后续试验。
1.4qRT-PCR实验 取适量对数生长期转染和(或)TNF-α处理的各组HepG-2细胞,遵照RNA抽提试剂盒说明书要求操作提取细胞RNA,检测含量,然后以RNA为模板按逆转录试剂盒说明书操作合成cDNA,检测浓度。最后根据qRT-PCR试剂盒说明书进行FoxO1 mRNA和miR-370的检测。用2-△△Ct法计算miR-370、FoxO1的表达水平。
1.5Western印迹实验 收集转染和(或)TNF-α 处理的各组HepG-2细胞,加入RIPA裂解液,裂解30 min。12 000 r/min离心10 min,收集蛋白上清。取适量蛋白上清至EP管,加入5×SDS蛋白上样缓冲液,煮沸10 min,进行SDS-PAGE后将蛋白条带用转膜仪转移至PVDF膜;置于5 %脱脂奶粉封闭2 h,洗膜3次,加入稀释的Ⅰ抗,4 ℃孵育过夜,洗膜3次,加稀释的酶标Ⅱ抗,4 ℃ 孵育2 h。加发光液,曝光。
1.6MTT实验 取对数生长期转染和(或)TNF-α 处理的各组HepG-2细胞,以2×103个细胞/孔接种于96微孔板中,在培养至24 h、48 h、72 h时进行 MTT 实验,每孔加入20 μl 5 g/L的MTT溶液,培养4 h,弃上清,每孔加入150 μl二甲基亚砜(DMSO),震荡,溶解结晶,酶标仪在490 nm波长下检测细胞吸光度(A)。
1.7Transwell小室检测细胞迁移侵袭 迁移实验:将转染和(或)TNF-α 处理的各组HepG-2细胞以106个/孔接种于6孔板,常规培养细胞融合度至80%,更换为无血清培养基过夜饥饿培养。培养液稀释各组细胞密度至105个/ml,Transwell上室加入100 μl细胞,下室加入600 μl含FBS的DMEM培养基,细胞常规培养12~18 h。取出上层小室,用棉签擦去上室内未迁移的细胞,PBS洗涤2次,甲醇固定迁移细胞30 min,0.1%结晶紫染色20 min。显微镜观察迁移细胞,随机选取3个视野拍照,计数,取平均数。侵袭实验:将Transwell上层小室内铺适量厚度的基质胶,后续步骤同迁移实验,显微镜观察并计数小室下表面附着的侵袭细胞。
1.8双荧光素酶报告基因检测实验 采用在线靶基因预测库target scan(http://www.targetscan.org/)检测到miR-370与FoxO1 3′非编码区(UTR)存在结合位点,为了验证这一预测,构建FoxO1 3′UTR-WT(含FoxO13′UTR片段)和FoxO1 3′UTR-MUT(含FoxO1 3′UTR片段突变体)的荧光素酶报告载体,根据1.3方法分别将FoxO1 3′UTR-WT和FoxO1 3′UTR-MUT与miR-370 mimics和miR-con共转染细胞,标记为miR-370组、miR-con组,培养24 h,根据双荧光素酶报告基因检测试剂盒说明书进行操作,检测萤火虫荧光素酶和海肾荧光素酶激发值,以两者的比值评价FoxO1基因突变型和野生型的荧光素酶相对活性。
1.9统计学处理 采用SPSS21.0软件进行单因素方差分析和t检验。
2 结 果
2.1TNF-α促进肝癌细胞增殖、迁移和侵袭 与Con组相比,TNF-α组肝癌HepG-2细胞在48 h和72 h细胞OD值显著升高,迁移和侵袭细胞数均显著升高(P<0.05,P<0.01,P<0.001)。见表1。


组别OD490 nm24 h48 h72 h迁移细胞数(个)侵袭细胞数(个)Con组0.36±0.040.52±0.060.79±0.0884.74±8.5664.37±7.13TNF-α组0.42±0.030.71±0.051.24±0.06188.32±15.43140.38±9.74t/P值2.079/0.1064.214/0.0147.794/0.00210.167/0.00110.907/0.000
2.2TNF-α抑制FoxO1表达 与Con组相比,TNF-α组HepG-2细胞FoxO1 mRNA和蛋白表达均显著降低(P<0.05,P<0.01)。见图1、表2。
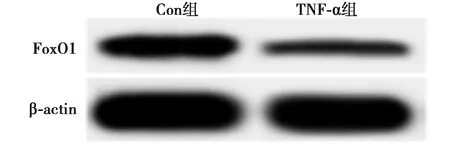
图1 Con组和TNF-α组肝癌细胞FoxO1蛋白的表达

表2 TNF-α对肝癌细胞FoxO1表达的影响

组别FoxO1 mRNAFoxO1蛋白Con组1.12±0.110.55±0.05TNF-α组0.45±0.310.26±0.03t/P值3.528/0.0248.614/0.001
2.3过表达FoxO1可抑制TNF-α对肝癌细胞增殖、迁移和侵袭的促进作用 与TNF-α+pcDNA组相比,TNF-α+pcDNA-FoxO1组HepG-2细胞中FoxO1蛋白表达显著上升(P<0.001)。在处理后48 h和72 h细胞OD值显著降低(P<0.05),迁移和侵袭细胞数均显著下降(P<0.01)。见表3和图2。
组别FoxO1蛋白细胞活性(OD490 nm)24 h48 h72 h迁移细胞数(个)侵袭细胞数(个)TNF-α+pcDNA组0.33±0.040.40±0.040.75±0.061.15±0.12175.63±17.94131.78±12.72TNF-α+pcDNA-FoxO1组0.86±0.030.37±0.030.58±0.050.84±0.0887.27±8.8369.59±7.47t/P值18.360/0.0001.039/0.3573.77/0.0203.723/0.0207.654/0.0027.302/0.002
2.4miR-370靶向FoxO1 运用target scan库预测miR-370与FoxO1的结合发现,miR-370与FoxO1 3′UTR序列中存在结合位点(图3A);双荧光素酶报告系统检测结果显示,与miR-con组相比,miR-370组的FoxO1野生型WT-FoxO1细胞中荧光素酶活性显著降低(P<0.01),而突变型MUT-FoxO1细胞中荧光素酶活性无显著变化(P>0.05),见表4。与miR-con组(0.56±0.05)相比,过表达miR-370组细胞中FoxO1蛋白表达(0.27±0.03)显著降低(P<0.05),与anti-miR-con组(0.58±0.06)相比,anti-miR-370组细胞中FoxO1蛋白表达(0.92±0.08)显著升高(P<0.05)。图3B。
2.5抑制miR-370可抑制TNF-α对肝癌细胞增殖、迁移和侵袭的促进作用 与TNF-α+anti-miR-con组相比,TNF-α+anti-miR-370组HepG-2细胞中miR-370表达显著降低(P<0.001),在处理后48、72 h细胞增殖显著降低(P<0.05),迁移和侵袭细胞数均显著降低(P<0.01)。见表5。

图3 miR-370靶向FoxO1

表4 双荧光素酶报告实验

组别WT-FoxO1MUT-FoxO1miR-con组1.03±0.111.07±0.11miR-370组0.42±0.061.11±0.13t/P值8.432/0.0010.407/0.705


组别miR-370细胞活性(OD490 nm)24 h48 h72 h迁移细胞数(个)侵袭细胞数(个)TNF-α+anti-miR-con组0.93±0.090.41±0.040.76±0.061.19±0.11174.74±15.56134.32±11.13TNF-α+anti-miR-370组0.23±0.020.39±0.030.55±0.050.89±0.09101.32±6.4380.75±5.81t/P值13.151/0.0000.693/0.5274.657/0.0103.656/0.0227.553/0.0027.390/0.002
2.6抑制miR-370和沉默FoxO1对TNF-α促进肝癌细胞增殖、迁移和侵袭的影响 与TNF-α+anti-miR-con组相比,TNF-α+anti-miR-370组HepG-2细胞在处理后48和72 h细胞OD值显著降低(P<0.05),迁移和侵袭细胞数均显著降低(P<0.05);与TNF-α+anti-miR-370+si-con组相比,TNF-α+anti-miR-370+si-FoxO1组HepG-2细胞在处理后48和72 h细胞OD值显著升高(P<0.05),迁移和侵袭细胞数均显著升高(P<0.05)。见表6。
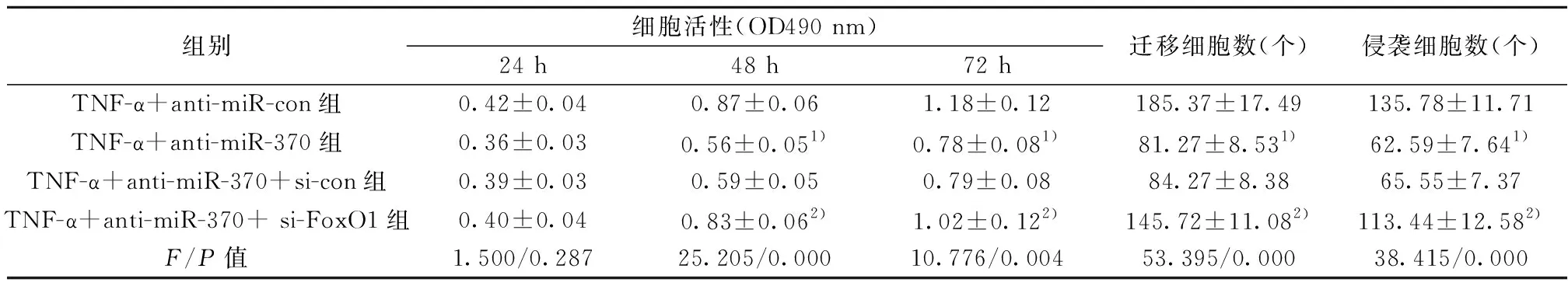
组别细胞活性(OD490 nm)24 h48 h72 h迁移细胞数(个)侵袭细胞数(个)TNF-α+anti-miR-con组0.42±0.040.87±0.061.18±0.12185.37±17.49135.78±11.71TNF-α+anti-miR-370组0.36±0.030.56±0.051)0.78±0.081)81.27±8.531)62.59±7.641)TNF-α+anti-miR-370+si-con组0.39±0.030.59±0.050.79±0.0884.27±8.3865.55±7.37TNF-α+anti-miR-370+ si-FoxO1组0.40±0.040.83±0.062)1.02±0.122)145.72±11.082)113.44±12.582)F/P值1.500/0.28725.205/0.00010.776/0.00453.395/0.00038.415/0.000
与TNF-α+anti-miR-con组比较:1)P<0.05;与TNF-α+anti-miR-370+si-con组比较:2)P<0.05
3 讨 论
TNF-α由巨噬细胞、自然杀伤细胞及中性粒细胞等分泌的促炎因子,在人类多种疾病中发挥作用,包括肿瘤〔10〕。有研究报道,TNF-α在肿瘤中具有双向的作用,其抗肿瘤作用或促肿瘤作用与TNF-α的浓度有很大关系,高浓度TNF-α可通过分泌特异性T细胞、破坏肿瘤血管生成而发挥抗肿瘤作用,低浓度TNF-α可激活核细胞因子(NF)-κB信号通路发挥促肿瘤作用〔11,12〕。Hu等〔13〕报道,聚碳酸酯磁性微球对TNF-α具有强磁响应性和高TNF-α负载浓度,且对异种植瘤的裸鼠体内具有高抑制和抗肿瘤作用。雷一鸣等〔14〕在肝癌的研究中发现,TNF-α在肝癌组织中表达升高,且可通过上调苄氟素(BECN)1、微管相关蛋白(LC3B)、增殖细胞核抗原(PCNA)的表达,促进癌细胞增殖。
miRNA在肿瘤中发挥肿瘤基因或肿瘤抑制基因的作用,这在国内外均得到普遍认可〔15〕。miR-370在肿瘤中的调节较复杂,兰敏〔16〕报道,miR-370在多种肿瘤的发生、发展、转移及耐药中均具有调节作用,如在肝癌、口腔癌、膀胱癌中下调发挥抑癌作用,在甲状腺癌、子宫内膜癌中上调发挥致癌作用,而在胃癌、肺癌中既具有上调作用也具有下调作用〔17〕。孙戈等〔18〕报道,miR-370在肝癌中表达显著下调,且与肝癌的恶性指标及生存率密切相关。Pan等〔19〕在肝癌的研究中发现,miR-370在肝癌组织中的表达显著降低,且与肿瘤的淋巴转移、分期及总体生存率显著相关,提示,miR-370的水平可作为临床评估的独立预后标志物。本研究发现,抑制miR-370可抑制肝癌细胞的增殖、迁移和侵袭,推测其可能与调控TNF-α的表达有关。
FoxO1基因在机体各种组织器官中广泛表达,参与细胞凋亡、DNA损伤修复、免疫调节及氧化应激等生物学过程〔20,21〕。FoxO1在多种肿瘤中表现为下调,发挥抑癌作用,其中包括肝癌〔22,23〕。张国强等〔24〕在肝癌的研究中发现,LINC00598、FoxO1在肝癌中表达均异常降低,且可上调肝癌的风险系数,提示LINC00598可抑制肝癌的恶化,其可能与顺势调控FoxO1的表达有关。Jiang等〔25〕在肝癌的研究中发现,三氟拉嗪(TFP)可抑制肝癌细胞的活力,诱导细胞周期停滞于G0/G1期和细胞凋亡,下调细胞迁移或侵袭的能力,且将FoxO1的细胞质定位逆转为核定位并增加其在核中的表达,敲低FoxO1可显著逆转TFP诱导的细胞凋亡,此外,TFP可增加FoxO1的核定位,提示上调FoxO1在肝癌中可发挥抗肿瘤作用。本研究发现,过表达FoxO1在肝癌的恶性进程中发挥抑制作用,敲减FoxO1可促进肝癌细胞的增殖、迁移、侵袭。
综上,miR-370可靶向FoxO1调控TNF-α对肝癌细胞增殖、迁移、侵袭的影响,miR-370可能是肝癌的新靶标。
