BDNF和TrkB在食管癌组织中表达及BDNF对食管癌细胞生物学行为的影响
2020-05-12冶俊玲苟笑丹韩静绮郭新建王丰梅青海大学附属医院病理科青海西宁810001
冶俊玲 苟笑丹 韩静绮 郭新建 王丰梅 (青海大学附属医院病理科,青海 西宁 810001)
脑源性神经营养因子(BDNF) 是神经生长因子家族的主要成员之一,对神经元的生长,分化起着至关重要的作用〔1〕。但研究发现BDNF与酪氨酸蛋白激酶受体(Trk)B结合导致TrkB磷酸化从而激活细胞内的丝裂原活化蛋白激酶(MAPKs)、磷脂酰肌醇3激酶/蛋白激酶B(PI3K/AKT)和磷脂酶(PL)C等多条信号通路来参与肿瘤细胞的增殖、凋亡及侵袭转移〔2,3〕。有研究显示在肝癌、胰腺癌、卵巢癌等肿瘤中BDNF和TrkB呈高表达,并且与疾病的发生发展及预后关系紧密,因此BDNF/TrkB可能作为肿瘤的生物治疗的靶点〔4,5〕。但是国内外关于BDNF和TrkB在食管癌中的表达,参与食管癌侵袭转移相关的研究报道较少。因此本研究分别在食管癌组织中检测BDNF、TrkB蛋白的表达,并检测它们在食管癌细胞中的mRNA水平,分析两者的表达与患者的临床病理特征之间的联系,同时观察外源性BDNF对食管癌TE-1细胞增殖与侵袭的影响,探讨BDNF和TrkB在食管癌发生、发展中的作用,为临床上食管癌的治疗提供新的方向。
1 材料与方法
1.1材料 人食管癌细胞株ECA109、TE-1和正常食管永生化上皮细胞株HET-1A均购置于南京凯基生物。BDNF鼠抗人单克隆抗体、TrkB兔抗人多克隆抗体、辣根酶过氧化物标记的二抗购自美国Santa Cruz公司,外源性人重组BDNF蛋白购自美国Peprotech公司,由Invitrogen公司提供Trizol Reagent,MBI Fermentas公司提供逆转录试剂盒和cDNA扩增试剂盒,CCK8试剂盒购自南京凯基生物有限公司,Transwell小室购自美国corning公司。
1.2方法
1.2.1组织标本采集 选取2015年10月至2017年12青海大学附属医院食管癌手术切除标本及对应的癌旁组织各52例,其中男32例,女20例,年龄61~83岁,平均(69.28±5.74)岁,患者术前均未接受化疗、放疗等其他疗法,组织标本分别取自癌旁组织4 cm内、无坏死癌灶及正常黏膜组织,经4%多聚甲醛固定,脱水,包埋后连续切片,厚度4 μm,随后进行苏木素-伊红染色,经专业病理科老师诊断确诊为食管癌。高分化21例,中分化15例,低分化16例;浸润深度:浅层19例,深层33例;伴淋巴结转移者23例,无淋巴结转移者29例;TNM分期:Ⅰ~Ⅱ期21例,Ⅲ~Ⅳ期31例。标本采集经医院伦理委员会的审批和认可。
1.2.2细胞培养 ECA109和HET-1A使用含10%血清的高糖DMEM培养基,TE-1使用含10%血清的完全RPMI1640培养基,37℃、5%CO2条件培养。
1.2.3食管癌组织及癌旁组织中BDNF和TrkB的表达 采用免疫组织化学两步法检测食管癌和对应的癌旁组织中BDNF、TrkB的表达。染色步骤严格参照试剂盒说明书。一抗BDNF(1∶200),TrkB (1∶250) 4℃过夜,采用DAB进行染色,由苏木素复染及分化。以磷酸盐缓冲液(PBS)代替一抗作为阴性对照。结果判定如下,BDNF和TrkB阳性表达均在细胞质或细胞膜上呈棕黄色或黄色,随机选取6个视野在400倍镜下(Leica,德国)观察,结合细胞着色深浅和阳性细胞占总细胞数的百分率进行判定。(1)细胞着色深浅评分:阴性为0分;呈浅黄色为1分;呈棕黄色为2分;呈棕褐色为3分。(2)阳性细胞数百分率评分:0%~30%为1分,31%~70%为2分,71%~100%为3分。两项评分的乘积大于或等于3分记为阳性表达,反之为阴性表达〔6〕。
1.2.4RT-PCR检测ECA019、TE-1和HET-1A细胞中BDNF、TrkB mRNA的表达 采用Trizol试剂一步法提取对数生长期细胞中的RNA,将细胞RNA反转录成cDNA,然后扩增成DNA(所有步骤严格按照逆转录试剂盒和扩增试剂盒说明书操作)。BDNF引物序列:上游:5-CTGTATCAAAAGGCCAACTGAA-3,下游:5-GTGTCTATCCTTATGAATCGCCA-3;TrkB引物序列:上游:5-CCAAGAGGCTAAATCCAGTCC-3,下游:5-CCAGGTTACCAACATCCCAATA-3;以GAPDH作为内参,引物序列:上游:5-CATGGGGTGTGAACCATGAGA-3;下游:5-GTCTTCTGGGTGGCAGTGAT-3。引物序列均由上海生物工程技术有限公司合成。RT-PCR条件如下:95℃预变性10 min,循环(95℃,30 s;50℃,30 s;:70℃,1 min)40次,最后70℃延伸10 min结束。制1%琼脂糖凝胶,扩增产物点样后100 v电泳25 min,采用凝胶成像分析系统(Bio-Rad,USA)测定条带灰度值,以目的基因(BDNF、TrkB)与内参基因GAPDH灰度值的比值作为目的基因的相对表达量。
1.2.5Western印迹检测ECA019、TE-1和HET-1A细胞中BDNF、TrkB蛋白的表达 取处于对数生长期的细胞,PBS清洗2遍后,加入预冷的RIPA试剂提取细胞中的总蛋白。采用BCA法对提取的总蛋白进行蛋白的定量。配置浓缩胶,分离胶,取20 μg总蛋白点样,分离总蛋白后转膜,室温封闭1 h,加入鼠抗人BDNF单克隆抗体(1∶2 000)或兔抗人TrkB多克隆抗体(1∶1 500)4℃过夜,辣根过氧化物酶标记的二抗孵育2 h,采用电化学发光(ECL)试剂显影。检测蛋白条带光密度值。
1.2.6CCK8检测外源性BDNF对食管癌细胞的增殖情况 取处于对数生长期的细胞,胰酶消化后用培养基重悬细胞至4×105~5×105个/ml。于96孔板每孔中加入100 μl细胞悬液,每组5个复孔,培养箱中放置24 h后待细胞完全贴壁。分别加入含20、40、80、160 ng/ml BDNF的1%血清的RPMI1640培养基,加入不含BDNF的1%血清的RPMI1640培养基作为0 ng/ml BDNF浓度对照,分别在培养1 d、2 d、3 d、4 d、5 d时,向每孔中加入10 μl的CCK8试剂,摇床上轻摇1 min后放置于培养箱中避光反应1 h,BIO-RAD680酶标仪上检测450 nm波长处各组的吸光度值(即OD值),以每组复孔的平均值作为该组的OD值。
1.2.7Transwell检测外源性BDNF对食管癌细胞的侵袭情况 首先培养基润洗Transwell小室1遍,用不含血清的DMEM培养基配置基质胶至浓度为10 μg/μl,取50 μl均匀铺于小室上面,37℃培养箱中放置1 h确认凝固后加入无血清培养基重悬后的细胞200 μl,细胞数量控制在1×104个左右。将实验分为实验组和对照组,实验组下室内加入含80 ng/ml BDNF的培养基,对照组下室中则加入不含BDNF的培养基。药物处理24 h后,取出小室置于甲醇中固定20 min,将小室倒置风干后,0.1%结晶紫染色10 min,PBS清洗2遍后用棉签擦拭小室基质胶上面残留的细胞。于倒置显微镜(Leica,德国)下观察Transwell小室,100倍镜下随机选取6~8个视野计数的平均值作为穿过基底膜的平均细胞数。
1.3统计学方法 采用SPSS22.0软件进行χ2检验、t检验。
2 结 果
2.1BDNF和TrkB在食管癌组织中的表达 BDNF和TrkB阳性主要表达在食管癌细胞的胞质和胞膜上,阳性部分呈现棕黄色或黄色。食管癌组织标本中,BDNF、TrkB的阳性表达率显著高于癌旁组织(P<0.05)。见图1、图2、表1。
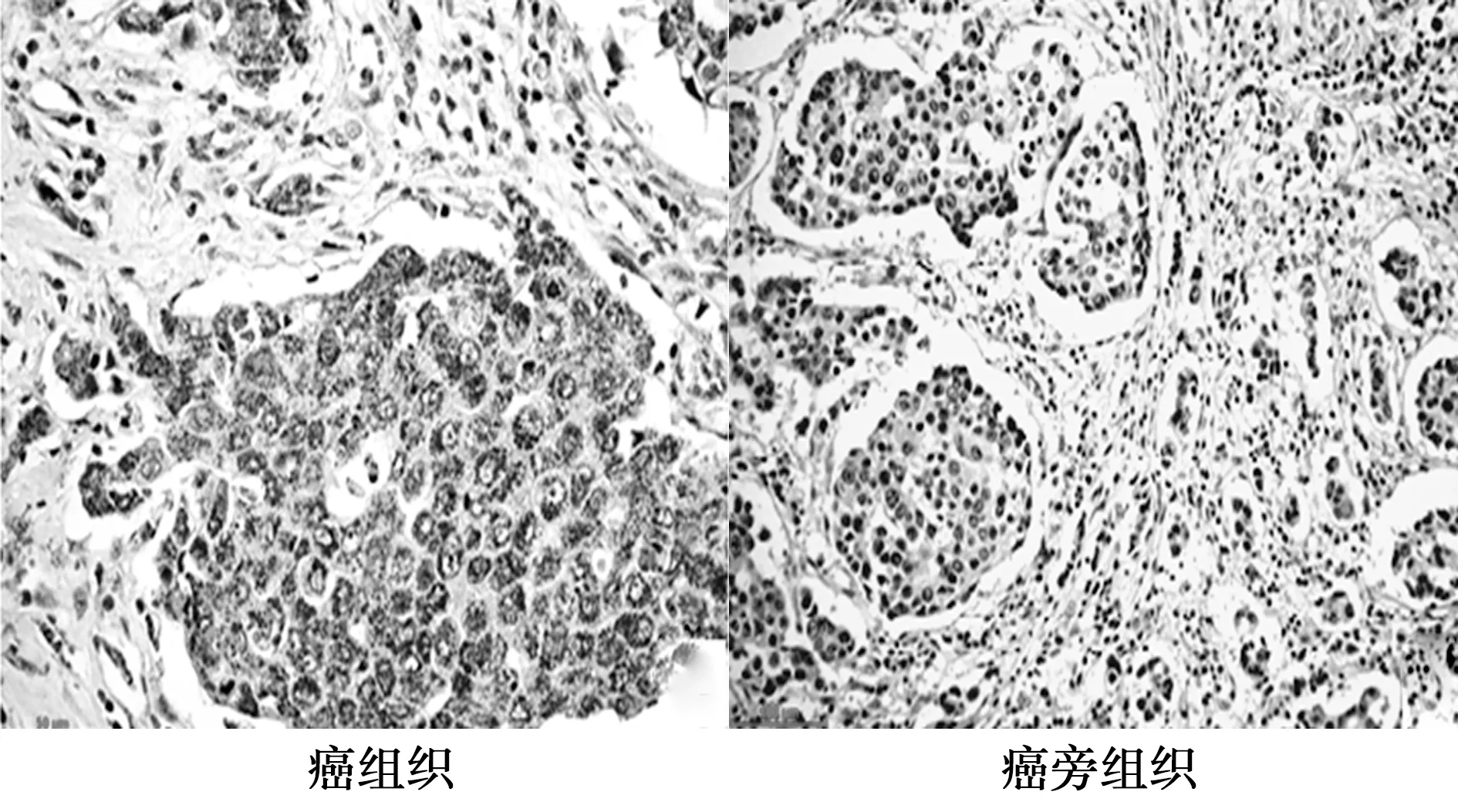
图1 BDNF在食管癌组织和癌旁组织中的表达 (SP,×400)
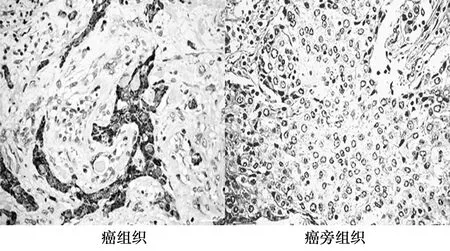
图2 TrkB在食管癌组织和癌旁组织中的表达 (SP,×400)
2.2食管癌组织中BDNF和TrkB的表达与临床病理特征的关系 食管癌组织中BDNF和TrkB的表达与患者的性别和年龄无显著相关性(P>0.05);与肿瘤浸润深度、TNM分期、组织学分级、淋巴结转移有显著相关性(均P<0.05)。见表2。
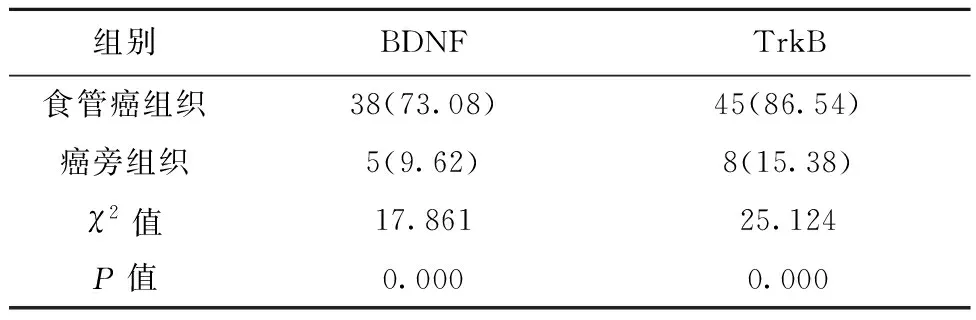
表1 BDNF和TrkB在食管癌组织及癌旁组织中的阳性表达 〔n(%),n=52〕
2.3不同食管细胞中BDNF和TrkB mRNA的表达 食管癌细胞ECA109和TE-1中BDNF及TrkB mRNA的表达明显高于食管正常细胞HET-1A(P<0.05)。见表3。
2.4不同食管细胞中BDNF和TrkB蛋白的表达 食管癌细胞ECA109和TE-1中,BDNF和TrkB蛋白的表达显著高于食管正常细胞HET-1A。见表4和图3。

表2 BDNF和TrkB的表达与食管癌临床病理特征的关系〔n(%)〕
表3 不同食管细胞中BDNF和TrkB mRNA的表达
与HET-1A比较:1)P<0.05;表4同
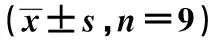
表4 不同食管细胞中BDNF和TrkB蛋白的表达
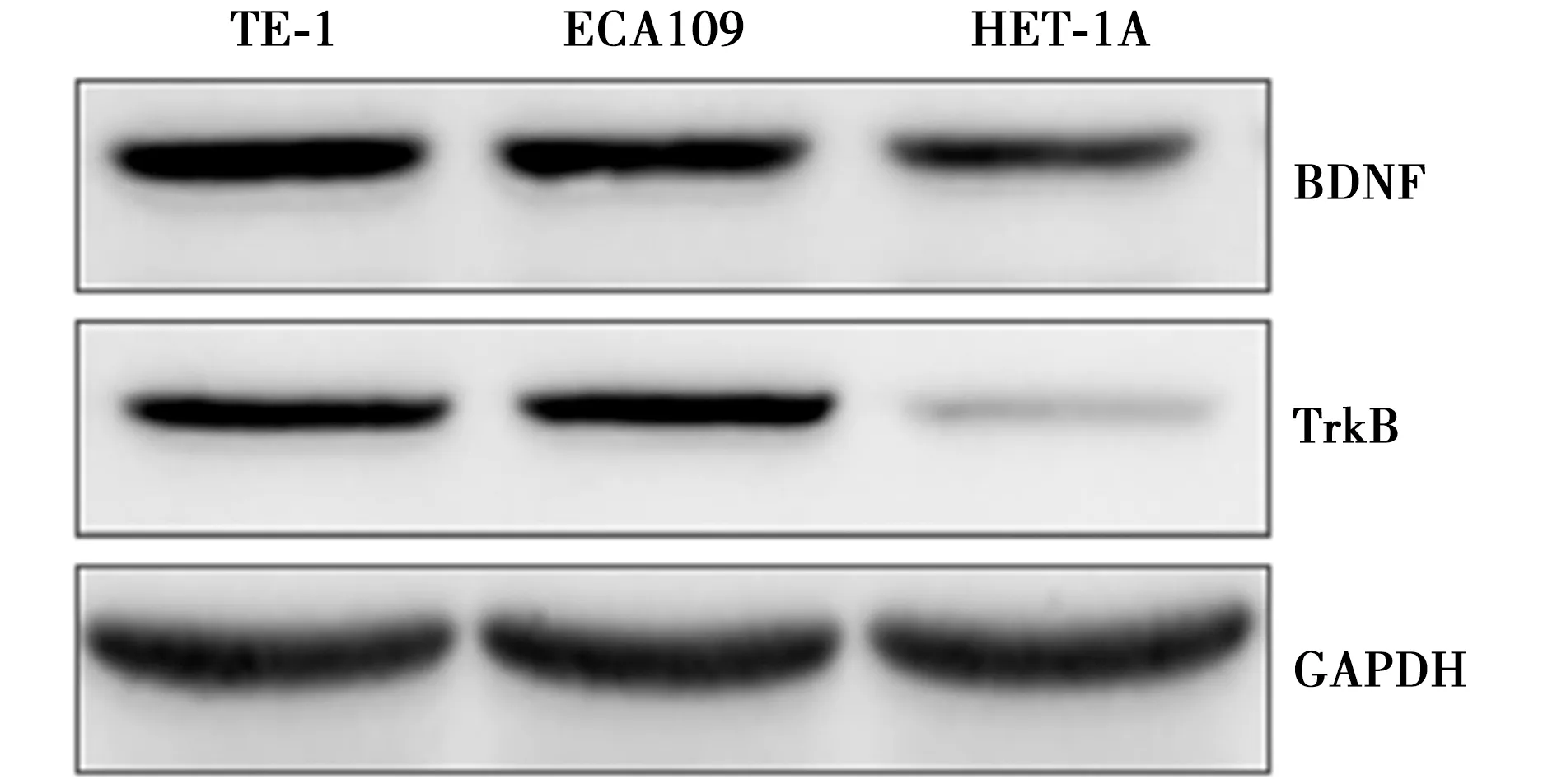
图3 不同食管细胞中BDNF和TRKB蛋白的表达
2.5BDNF影响食管癌细胞TE-1的增殖 在第1天、第2天,不同浓度BDNF的细胞OD值变化不明显,第3、4、5天,40、80和160 ng/ml浓度BDNF的细胞OD值明显高于0 ng/ml BDNF浓度(P<0.05),20 ng/ml和0 ng/ml BDNF浓度的细胞OD值比较差异无统计学意义(P>0.05)。见表5。

培养时间0 ng/ml20 ng/ml40 ng/ml80 ng/ml160 ng/ml第1天0.51±0.040.53±0.060.52±0.050.54±0.070.62±0.09第2天0.72±0.080.75±0.070.79±0.110.76±0.080.80±0.12第3天0.98±0.121.02±0.141.28±0.151)1.31±0.141)1.52±0.171)第4天1.16±0.171.17±0.191.46±0.191)1.52±0.171)1.87±0.191)第5天1.35±0.201.39±0.181.95±0.221)2.02±0.211)2.24±0.211)
与同时间点的0 ng/ml 比较:1)P<0.05
2.6BDNF影响食管癌细胞TE-1的侵袭能力 实验组穿过基底膜的细胞数目〔(952.21±165.39)个〕显著高于对照组〔(206.24±12.67)个,P<0.05〕。见图4。
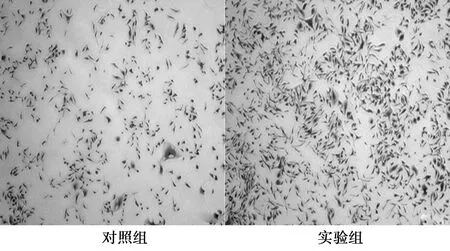
图4 BDNF对食管癌TE-1细胞侵袭能力的影响(×100)
3 讨 论
食管癌是消化道中最常见的肿瘤之一,近些年食管癌在全球的发病率和死亡率急剧上升〔7〕。目前治疗食管癌的手段还是首选手术切除,但是由于食管癌的具有高侵袭,高转移的生长特性导致患者治疗效果和预后不佳〔8,9〕。因此,寻找与食管癌生长特性相关的新靶点,深入对食管癌侵袭转移的分子机制研究可能,改善患者的预后,对临床治疗具有重要意义。
研究显示,BDNF能够与高亲和力的受体TrkB结合参与多种恶性肿瘤的发生发展〔10~12〕。魏秀娟等〔13〕的研究发现,在舌鳞癌组织中BDNF和TrkB的表达率远高于在正常舌黏膜组织。有研究报道在子宫内膜增生和子宫内膜癌组织中BDNF和TrkB呈现高表达,而在正常子宫内膜组织中两者的表达率很低甚至不表达,并且BDNF和TrkB的表达与患者子宫内膜的病变关系密切〔14〕。本研究结果发现在食管癌组织中BDNF和TrkB的表达显著高于癌旁组织,并且对食管癌患者的相关病理特征分析得出BDNF和TrkB与肿瘤的组织学分级、浸润深度、淋巴结转移和TNM分期密切相关,提示BDNF、TrkB可能参与了食管癌的增殖与转移。有研究发现食管癌TE-1细胞的增殖迁移能力高于食管癌ECA109细胞〔15〕。而本研究在mRNA和蛋白水平分别检测了两种食管癌细胞株ECA109和TE-1中BDNF、TrkB的表达,发现BDNF和TrkB在TE-1细胞系中的表达高于ECA109,提示BDNF和TrkB可能调节食管癌细胞的增殖与转移。研究表明〔16,17〕,在大鼠肝癌模型中外源性BDNF可以通过调节热休克蛋白HSP90刺激细胞内源性BDNF分泌增加,促进肿瘤的增殖,侵袭与转移。在多发性骨髓瘤细胞中,外源性BDNF能够结合磷酸化细胞表面的TrkB受体,促进肿瘤细胞的增殖、迁移,在肿瘤细胞的发生发展中发挥重要作用〔18,19〕。本研究通过外源性BDNF刺激BDNF/TrkB信号轴,观察BDNF对食管癌细胞生物学行为的影响。结果显示,随着外源性BDNF处理浓度的增加和处理时间的延长,TE-1细胞的增殖能力明显增强,具有剂量时间依赖性。在众多BDNF与其他恶性肿瘤的研究中同样发现相同的结果,推测BDNF可能是通过激活TrkB受体,从而增强肿瘤细胞的增殖能力〔20〕。Transwell实验结果显示,外源性BDNF能够增加TE-1细胞穿过基底膜的数量,使其侵袭能力增强。因此BDNF/TrkB可能作为食管癌治疗的新靶点。但是有关BDNF/TrkB调节肿瘤细胞增殖与转移的分子作用机制尚不明确,有待后续深入研究。
综上所述,食管癌组织中BDNF、TrkB异常高表达,且BDNF/TrkB在食管癌的发生发展中发挥着重要的作用,有可能成为抗癌治疗的新靶点。
