线粒体基因m.3243A>G突变致线粒体糖尿病1例并文献复习
2020-05-12宋小婷薛存希袁慧娟
宋小婷,薛存希,袁慧娟
(1.锦州医科大学河南省人民医院研究生培养基地 内分泌科,河南 郑州 450003;2.河南省人民医院 内分泌科,河南 郑州 450003)
糖尿病是一种以葡萄糖代谢紊乱为特征,广泛影响全球4亿多成年人最常见的代谢性疾病[1]。线粒体基因3243突变糖尿病占一般糖尿患者群的0.5%~2.8%,因该病通常具有母系遗传和神经性耳聋的临床特征,故又被母系遗传糖尿病伴耳聋综合征 (maternally inherited diabetes and deafness syndrome,MIDD)[2]。线粒体基因突变糖尿病属于胰岛β细胞功能遗传性缺陷所致特殊类型的糖尿病,是最多见的单基因突变糖尿病,占中国成人糖尿病中的0.6%。绝大多数(85%)线粒体基因突变糖尿病是由线粒体亮氨酸转运RNA基因[tRNALeu(UUR)]上的线粒体核苷酸序位3243上的A→G(A3243G)突变所致[3-4]。此外,MIDD还可由m.9267G>C、m.1555A>G、m.14530T>C、m.14709T>C、m.3421G>A突变引起[4]。现报道1例典型线粒体糖尿病患者,探讨其临床变现及诊治经过,并结合文献复习总结其临床特征,以提高临床医生对该病的认知,降低误诊漏诊率。
1 病例资料
患者,女,31岁,职员。以“口干、多饮、多尿14 a,耳鸣伴听力下降8 a”为主诉入院。患者14 a前出现口干、多饮、多尿、体质量减轻,于当地医院确诊为2型糖尿病,并给予口服降糖药二甲双胍联合拜糖平治疗,血糖控制不佳,空腹血糖10 mmol·L-1。遂改为诺和灵R 30 U皮下注射,每日2次,血糖控制仍差。8 a前出现耳鸣伴听力下降,饮食睡眠差,体质量减轻7 kg。其母亲及外祖母患有糖尿病。为进一步诊治,入住河南省人民医院内分泌科。入院后查体:身高159 cm,体质量60 kg,体质量指数:23.7 kg·m-2,慢性面容,双眼视力无明显下降,双耳听力下降,双足均有胼胝体形成,四肢触觉。位置觉、凉温觉未见明显异常,双侧足背动脉搏动无明显减弱,双下肢无明显水肿。常规检查:肾功能检查示空腹血糖为20.5 mmol·L-1,尿常规示尿糖(+++),酮体(-),血脂检查示总胆固醇6.22 mmol·L-1,甘油三酯3.83 mmol·L-1,高密度脂蛋白胆固醇0.95 mmol·L-1,低密度脂蛋白胆固醇3.86 mmol·L-1,彩超提示脂肪肝,血常规、肝功能、电解质、甲状腺功能、性激素未见明显异常,心电图、胸片均未见明显异常。糖尿病相关检查:糖化血蛋白10.6 %,尿蛋白检查示尿微量白蛋白/尿肌酐82.9 mg·g-1,24小时尿蛋白0.21 g,胰岛素抗体检查:抗胰岛素抗体(-),抗胰岛细胞抗体(-),抗谷氨酸脱氢酶抗体(-)。眼底照相未见明显异常,四肢肌电图检查示双上肢神经感觉传导通路异常,听力阈值测定示神经性耳聋。糖耐量及胰岛功能检查结果见表1。初步诊断:2型糖尿病伴多发症(神经性耳聋、周围神经病变、肾脏病变);高脂血症;脂肪肝。对患者予以糖尿病教育,胰岛素泵控制血糖,口服硫辛酸、甲钴胺、依帕司他胶囊改善神经系统症状,厄贝沙坦改善尿蛋白,阿托伐他汀控制血脂,入院治疗1周左右,血糖趋于平稳,口干、多饮、多尿症状改善,耳鸣、听力下降症状改善不明显。故重新回顾患者病史,调整诊断思路,行肌酶谱检测,未见明显异常,血乳酸检测:静息状态为4.3 mmol·L-1,活动后血乳酸为8.7 mmol·L-1(正常值0.1~2.7 mmol·L-1),行血液和尿液标本的基因检测,线粒体基因存在m.3243A>G突变(见图1),故该患者最终诊断:线粒体糖尿病伴多发症(神经性耳聋、周围神经病变、肾脏病变);高脂血症;脂肪肝。调整治疗方案:(1)糖尿病教育:不严格控制饮食,避免剧烈运动;(2)降糖:赖脯胰岛素+诺和灵N;(3)改善线粒体功能、抗氧化:辅酶Q10、硫辛酸胶囊、维生素C;(4)降脂:阿托伐他汀片。患者耳鸣、听力下降症状改善,病情稳定后出院继续对症支持治疗。
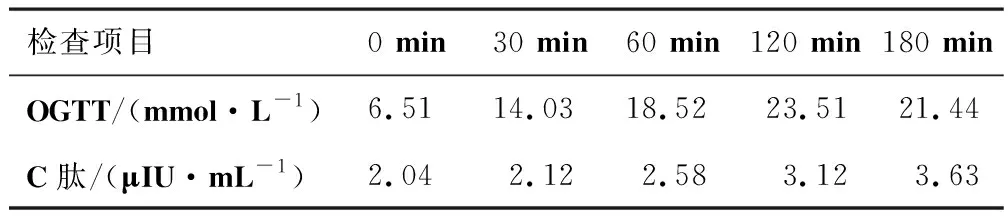
表1 糖耐量试验及胰岛功能检查结果
注:OGTT—口服葡萄糖耐量试验。

图1 线粒体基因存在m.3243A>G突变
2 讨论
本例患者被误诊为2型糖尿病,有以下临床特点:(1)青少年起病,病程长,口服降糖药物控制血糖不佳转为胰岛素治疗,病程中胰岛β细胞功能进行性减低,近8 a体质量逐渐下降,胰岛自身抗体阴性;(2)合并中枢神经病变,神经性耳聋;(3)合并周围神经病变,四肢肌电图检查示双上肢神经感觉传导通路异常;(4)尿微量白蛋白/肌酐提示肾脏损害;(5)家系中3代均有糖尿病患者,40岁以上起病,提示母系遗传;(6)血乳酸水平升高;(7)行血液和尿液标本的基因检测,线粒体基因存在m.3243A>G突变;(8)患者无明显胰岛素抵抗,无其他胰腺相关疾病,无特殊体征。此外,该患者无高血压、甲状腺激素、性腺激素、电解质未见明显异常;无药物及其他化学物品接触史;患者母亲孕期无特殊感染史;患者无反复低血糖发作,血胰岛素升高不明显,无明显视神经萎缩等眼部症状,无尿崩症,多尿症状随血糖控制后缓解,尿比重正常。
线粒体糖尿病患者起病早,多在40岁以前发病,母系遗传,体型偏瘦,体质量指数低,胰岛自身抗体检测阴性,口服降糖药物治疗不佳,需要胰岛素治疗,多伴有神经性耳聋,耳聋可发生在糖尿病前或之后,血乳酸水平升高,本例患者的“三多一少”症状和2型糖尿病极为相似,容易误诊漏诊,故需要和1型、2型及其他特殊类型的糖尿病进行鉴别诊断,可参考目前国际上采用WHO(1999年)的糖尿病病因学分型体系,中华医学会建议对疑似者首先应行tRNALeu(UUR)A3243G突变检测[3]。
线粒体氧化磷酸化产生ATP是有核细胞重要的能量来源,线粒体DNA突变引起线粒体功能障碍,进而线粒体无法产生足够的ATP,会导致多器官功能缺陷,影响对新陈代谢能量需求很高的组织器官,如神经、骨骼肌肉组织、视网膜、肾脏和胰腺[5-6]。线粒体疾病是罕见的,由线粒体DNA或核DNA突变引起的异质性疾病,可表现出多种临床症状。其中线粒体DNA突变引起的线粒体疾病更为常见,比例为20∶1 000 000,为母系遗传。核DNA突变较少见(2.9∶100 000),并以常染色体显性或隐性遗传[5]。临床上,线粒体DNAm.3243A>G突变可引起线粒体脑肌病伴乳酸性酸中毒和类中风发作、母系遗传性糖尿病伴耳聋综合征、肌阵挛性癫痫伴肌肉破碎红纤维综合征、Leigh综合征、Kearns-Sayre综合征等多种线粒体疾病[7]。
MIDD最为常见的临床表现为母系遗传、糖尿病或伴耳聋[3]。(1)母系遗传:线粒体DNA主要通过母体卵母细胞遗传,MIDD中的遗传异常与母体遗传有关[8]。MIDD的这一特点表明,家系内女性基因突变者的子女均可能遗传此病变基因而得病,而男性基因突变者的子女不可能得病。故而根据此特点,尽早进行基因检测,可通过优生优育指导,阻断此病在子代的延续。(2)神经性耳聋:感音神经性耳聋是线粒体DNA突变的常见表现之一。张博等[9]研究指出由于内耳细胞内突变的线粒体DNA不断积累,ATP生成不能满足细胞能量需求,致使神经传导受阻,听力逐渐丧失。另一项研究显示,在A3243G突变的患者中,30%~75%的患者存在感音神经性耳聋[7]。A3243G突变导致听力受损的临床特征是双侧对称性感音性感音神经性耳聋,最初较高频率听力受损,随后较低频率听力受损。(3)糖尿病:大多数MIDD患者糖尿病起病隐匿,类似2型糖尿病,此外,高达8%的MIDD病例可表现为1型糖尿病,这取决于胰岛功能受损的严重程度。在MIDD患者中,由于胰岛素敏感性正常,二甲双胍疗效不如2型糖尿病患者,且二甲双胍治疗使乳酸性酸中毒风险增高[10]。(4)其他系统表现:在MIDD的最初研究报道中指出,该病对胰岛功能和中枢神经系统造成影响,但在随后几年的研究证明,MIDD不仅局限于2个器官,而是线粒体多器官功能紊乱综合征,除中枢神经系统和内分泌器官受累外,MIDD还可表现为周围神经系统、前庭功能、眼睛、心脏、胃肠道和肾脏等多系统脏器受到影响[11]。
鉴于线粒体糖尿病的临床特点,一旦临床上发现早发糖尿病、体质量减轻、母系遗传、口服降糖药效果不佳、较快行胰岛素治疗或伴神经性耳聋的患者,应及时行基因检测,尽早明确诊断,调整治疗方案,改善患者生活质量,指导优生优育,降低误诊率。
