脑小血管病总体负担对大动脉粥样硬化型脑梗死患者长期预后的影响
2020-05-11赵丽贤阎文静孟心怡赵仁亮
赵丽贤, 朱 慧, 阎文静, 孟心怡, 赵仁亮
最新中国脑卒中流行病学调查研究显示,脑卒中是我国成年人致死、致残的首位病因[1]。缺血性卒中是脑卒中的常见类型,占我国脑卒中的69.6%~70.8%[2]。TOAST分型目前仍是国内外缺血性卒中最常用的病因分型[3]。研究显示,大动脉粥样硬化型(large artery atherosclerosis,LAA)脑梗死的发病率自2011年开始下降,从31.1%降至2015年的24.1%,而小血管病变型(small vessel disease,SVD)脑梗死发病率则逐年上升,从2007年的15.5%升至2015年的39.6%[4]。研究显示,颅内、外动脉狭窄的患者常与脑小血管病(cerebral small vessel disease,CSVD)并存,且狭窄的严重程度与CSVD总分的增加独立相关[5,6]。CSVD是病变累及脑内小血管,如小动脉、微动脉、毛细血管、微静脉、小静脉而导致的一系列病理、影像及临床综合征,其主要影像学为脑白质高信号(white matter hypertensity,WMH)、脑微出血(cerebral microbleeds,CMBs)、腔隙(lacune)及扩大的血管周围间隙(enlarged perivascular space,EPVS)[7]。研究表明,CSVD的病理过程是广泛的脑内小血管病变,为了评估和反映脑内小血管病变对大脑的整体损伤程度,2014年Staals[8]提出了CSVD总体负担(the total burden of CSVD)的概念,表示CSVD是一种累积效应,较单一的影像学表现具有更高的临床预测价值。脑卒中的高致死、致残率,给社会及家庭带来沉重的负担,因此,早期全面评估脑梗死患者的神经功能预后具有重要意义。既往研究大多局限于单一的CSVD影像学表现对缺血性卒中患者神经功能预后的影响[9,10],关于CSVD总体负担对LAA型脑梗死患者的神经功能预后的研究迄今鲜见报道。本研究旨在探讨CSVD总体负担与LAA型脑梗死患者的长期预后的关系,为预测脑梗死患者的临床转归提供依据。
1 对象和方法
1.1 研究对象 纳入2016年6月-2018年1月在我院住院治疗的LAA型脑梗死的患者148例。纳入标准:(1)符合《中国急性缺血性脑卒中诊治指南2014》诊断标准[11],由MRI证实;(2)首次发病,发病72 h入院;(3)根据TOAST分型,确定为LAA型脑梗死,MRA及CTA证实存在与神经功能缺损相对应的颅内或颅外大动脉狭窄(>50%)或闭塞,血管病变为动脉粥样硬化[3];(4)颈内动脉系统脑梗死;(5)意识清晰,智能正常,能配合完成各项量表评分及影像学检查;(6)临床资料完整;(7)患者知情同意。排除标准:(1)曾有短暂性脑缺血发作、脑出血、硬膜下血肿、蛛网膜下腔出血、中枢神经系统疾病等病史;(2)其他病因分型的脑梗死;(3)合并结核、梅毒等可明确导致血管损害的病史;(4)接受静脉溶栓或血管内治疗的患者;(5)伴有其他重要脏器功能障碍;(6)年龄<45岁。
1.2 资料收集 入院当天收集患者的人口学资料,如性别、年龄等;血管危险因素:如吸烟史、饮酒史;既往史:如高血压、糖尿病、高脂血症、冠心病等;实验室检查数据:如空腹血糖、三酰甘油、总胆固醇、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇;入院当天行美国国立卫生研究院卒中量表(National Institute of Health Stroke Scale,NIHSS)评分[12];完善头部MRI检查、头部MRA检查、头颈部CTA检查及CSVD总体负担评分。吸烟史定义为连续3个月及以上,每日至少1支。饮酒史定义为连续5 y以上(乙醇量:男性≥40 g/d、女性≥20 g/d ,或者14 d内有大量饮酒史(乙醇量≥80 g/d)。高血压诊断标准:满足以下任意一条:(1)未服用降压药情况下,3次非同日测量,收缩压≥140 mmHg和(或)舒张压≥90 mmHg;(2)既往诊断高血压,正在服用降压药物的患者[13]。糖尿病的诊断标准:满足以下任意一条:(1)典型的糖尿病症状(多饮、多尿、多食、体重下降)加上随机血糖≥11.1 mmol/L;(2)空腹血糖≥7.0 mmol/L;(3)葡萄糖负荷后2 h血糖≥11.1 mmol/L(无糖尿病症状者,需改日重复检查);(4)既往诊断糖尿病,正在治疗的患者[14]。高脂血症的诊断标准:满足以下任意一条:(1)总胆固醇>5.18 mmol/L;(2)甘油三酯>1.7 mmol/L:(3)低密度脂蛋白胆固醇>3.37 mmol/L;(4)入院前已明确诊断为高脂血症且正在服用降脂药[15]。
1.3 脑结构与脑血管影像学评估 全部入组患者均完善3.0 T的头部MRI、MRA检查及头颈部CTA检查。头部MRI成像序列包括:T1和T2加权自旋回波轴向图像(T1WI和T2WI)、液体衰减反转恢复序列(FLAIR)、弥散加权成像(DWI)以及磁敏感加权成像(SWI)。T1WI:时间重复(TR)/时间回波(TE)=1750/24 ms,T2WI:TR/TE=3280/110 ms,FLAIR:TR/TE=9000/150 ms,DWI:TR/TE=5300/81.4 ms,b=(0,1000)。层间距1.5 mm,层厚5 mm,视野(FOV)=240 mm×240 mm。收集T1WI和T2WI冠状位及横轴位,T2-FLAIR、DWI和SWI的横轴位。头部MRA检查运用三维时间飞跃法(3D-TOF)技术,采用水平位及斜位的扫描方法,扫描后经最大强度投影法(MIP)重建获得MRA图像。其中层厚6 mm,间距1.2 mm,矩阵465×512。成像范围包括椎动脉V4段及以远、基底动脉和全部颅内大血管的主要分支。头颈部CTA应用64排螺旋CT联合三维血管造影完成,扫描参数:管电压120 kv,管电流200 mA,层厚0.625 mm,螺距0.984∶1,矩阵256×256,扫描时间6~7 s,扫描范围:自主动脉弓至脑顶部。包括颈内动脉、椎动脉、基底动脉和全部颅内大血管的主要分支。向患者静脉注射对比剂,于轴位、冠状位及矢状位进行摄片,获取CTA图像后,应用螺旋CT行三维立体重建。颅内血管病变:狭窄率(%)=(1-狭窄最重处血管直径/狭窄近端正常血管直径)×100%;颅外血管病变:狭窄率(%)=(1-狭窄最重处血管直径/狭窄远端正常血管直径)×100%。纳入头部MRI显示梗死直径>1.5 cm和头部MRI上脑梗死部位相对应的颅内或颅外大动脉狭窄(>50%)或者闭塞的患者。CSVD总体负担评分参照Staals[8]建立的量表进行(见表1),总分0~4分,分数越高,表示CSVD对大脑损伤越大。WMH按部位分为深部白质高信号(deep white matter hypertensity,DWMH)和脑室周围白质高信号(periventricular white matter hypertensity,PVWMH)。CSVD的评分由经验丰富的2名放射科医生和2名神经内科医生共同评定完成。

表1 CSVD总体评分
1.4 神经功能缺损严重程度及预后的判定方法 NIHSS评分因具有良好的信度和效度在临床工作中被广泛应用,是评估急性卒中患者神经功能缺损严重程度的评价工具。改良的Rankin量表(modified Rankin Sale,mRS)[19]在临床中具有较好的可靠性和真实性,可作为功能预后的判定指标。在发病后90 d、1 y行mRS评分,预后良好为0~2分,预后不良为>2分。
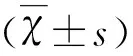
2 结 果
2.1 预后良好与预后不良两组患者的基线资料分析 研究期间入组LAA型脑梗死患者148例,男性91例,女性57例。随访90 d时,预后良好72例,预后不良76例,两组单因素分析结果显示,预后不良与高血压、空腹血糖、入院时NIHSS评分、WMH、EPVS及CSVD总体负担相关,差异具有统计学意义(P<0.05)。随访1 y时,预后良好88例,预后不良60例,两组单因素分析结果显示,预后不良与高血压、糖尿病、入院时NIHSS评分、WMH、CMBs、EPVS及CSVD总体负担相关,差异具有统计学意义(P<0.05)(见表2)。
2.2 预后良好与预后不良两组多因素Logistic回归分析 将表2中P<0.1的变量作为自变量,预后不良为应变量,进行多因素Logistic回归分析。卒中后90 d随访分析显示,CSVD总体负担评分和入院时NIHSS评分是LAA型脑梗死患者神经功能预后不良的独立危险因素;卒中后1 y随访分析显示,入院时NIHSS评分、EPVS及CSVD总体负担评分是LAA型脑梗死患者神经功能预后不良的独立危险因素(见表3)。
2.3 CSVD 0~1组与CSVD 2~4组两组患者的基线资料分析 入组患者中,CSVD 0分18例(12.16%);CSVD 1分45例(30.41%);CSVD 2分38例(25.67%);CSVD 3分33例(22.30%);CSVD 4分14例(9.46%)。基线时,根据CSVD评分分组,CSVD 0~1组63例(42.57%);CSVD 2~4组85例(57.43%)。单变量因素分析,CSVD 2~4组的年龄、高血压比例、入院时NIHSS评分及发病后90 d、1 y mRS评分高于CSVD 0~1组,差异有统计学意义(P<0.05)(见表4)。

表2 预后良好与预后不良两组患者的基线资料比较
NIHSS:美国国立卫生研究院卒中量表;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;CSVD:脑小血管病;n:例数;M:中位数;IQR:四分位间距,随访90 d,与预后良好组比较*P<0.05,#P<0.001;随访1 y,与预后良好组比较☆P<0.05,▲P<0.001

表3 脑梗死患者卒中后90 d、1 y的临床转归的Logistic回归分析
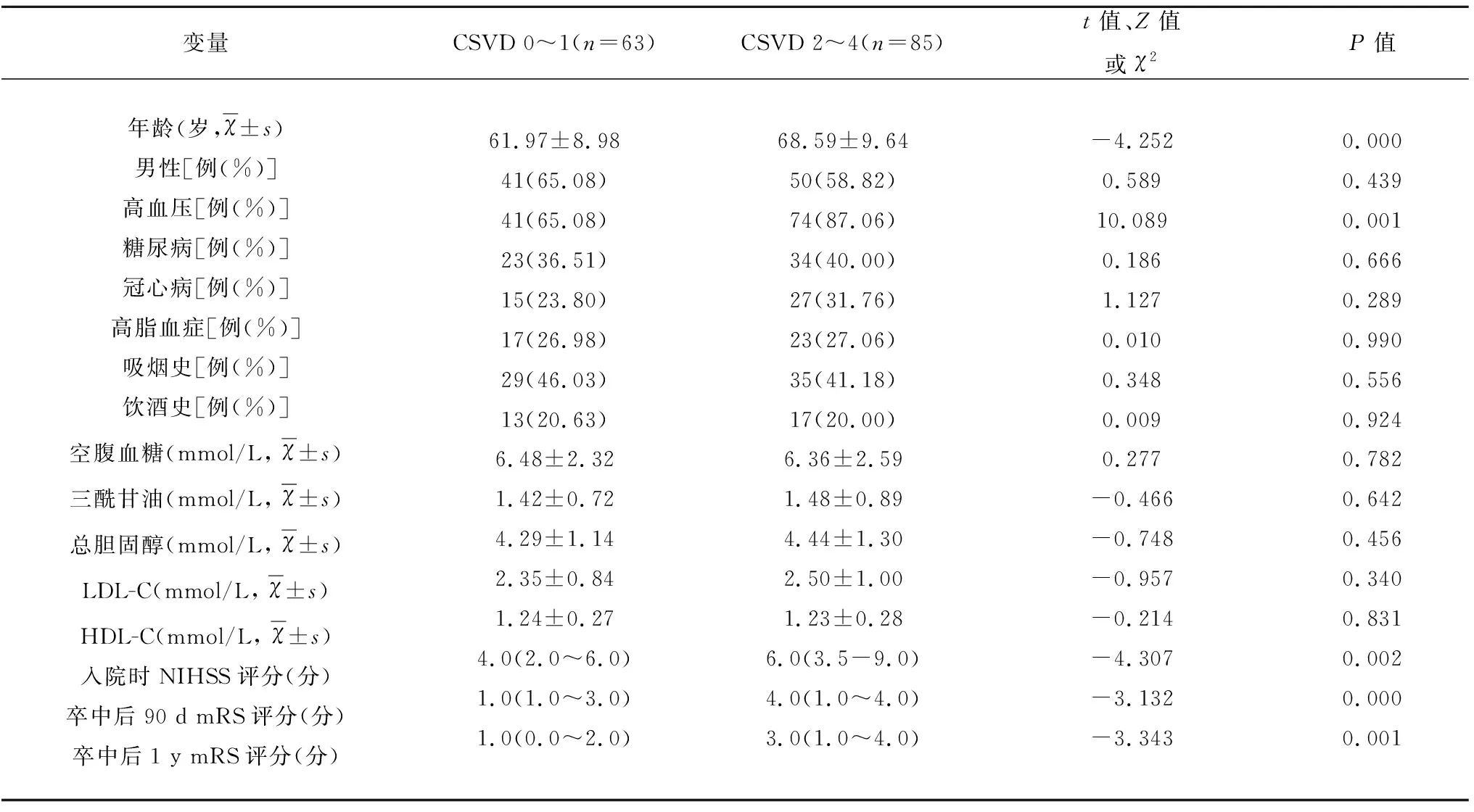
表4 CSVD 0~1组与CSVD 2~4组两组患者的基线资料比较
LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇;NIHSS:美国国立卫生研究院卒中量表;mRS:改良的Rankin量表
3 讨 论
脑卒中是一种严重威胁全球人类健康的疾病。2018年新英格兰杂志最新报告,全球≥25岁人群卒中终生风险为24.9%,不同区域和国家存在差异,中国人群风险最高为39.3%[20]。根据TOAST分型,LAA型是缺血性卒中常见的病因分型,TOAST分型包括:大动脉粥样硬化型、心源性栓塞型、小血管闭塞型、其他病因型和不明原因型[3]。研究表明,LAA型脑梗死早期更易出现神经功能恶化,且预后不良[21]。本研究纳入LAA型脑梗死患者,探讨CSVD总体负担与LAA型脑梗死患者的神经功能预后的相关性。
脑梗死患者预后不良与多种因素相关,如年龄、急性期血压、高血压、糖尿病、冠心病、既往卒中史、入院NIHSS评分、良好的侧支循环、脑白质高信号、脑微出血及扩大的血管周围间隙等[9,10,22~25]。本研究显示,卒中后90 d预后不良与高血压、空腹血糖、入院时NIHSS评分、WMH及EPVS相关;卒中后1 y,预后不良与高血压、糖尿病、入院时NIHSS评分、WMH、CMBs及EPVS相关,与既往研究结果一致。系统回顾研究显示,约75%的急性卒中患者合并高血压,急性期血压升高可能与既往高血压病史、神经内分泌系统的激活(如交感神经系统、肾素-血管紧张素轴、糖皮质激素系统)、心输出量的增加等密切相关,血压升高加重脑水肿及出血转化的风险,继而影响卒中患者的预后[26]。急性缺血性卒中患者血压升高与预后不良相关,适当控制血压可改善预后。研究显示,2型糖尿病患者发生缺血性卒中的风险是正常人的2.27倍,2型糖尿病是卒中预后不良的独立危险因素[27]。卒中患者可能合并急性期空腹血糖升高,可能是既往糖尿病史而血糖控制不佳或急性应激事件所致。血糖升高,促进机体炎症反应,引起内皮功能障碍,还可加速血小板聚集,促进动脉粥样硬化,进而导致预后不良[28]。
研究发现,缺血性卒中患者常同时合并不同程度的CSVD影像学表现,卒中预后不良与CSVD密切相关。本研究显示,卒中后90 d预后不良与WMH、EPVS及CSVD总体负担相关;卒中后1 y预后不良与WMH、CMBs、EPVS及CSVD总体负担相关。WMH特征性表现为头部MRI上T2、T2-FLAIR上为高信号的病变。研究发现[10,21],急性缺血性卒中患者基线WMH严重程度与卒中后3个月神经功能预后不良相关。葛成东等[29]研究发现,PVWMH与缺血性脑卒中6个月后mRS评分相关。WMH存在可增加急性梗死的体积,原因可能为遗传因素、机体高凝性、血小板活化和炎症反应等。CMBs是脑内微小血管破裂导致的含铁血红素沉积,在SWI序列上表现为边界清楚的圆形或卵圆形的直径2~10 mm的均质性的低信号。目前,高血压和脑淀粉样血管病被公认为是导致CMBs的两个主要危险因素。Meta分析显示,CMBs的存在会增加卒中后溶栓患者预后不良的风险[9]。EPVS是早期CSVD的重要影像学表现,与脑小血管病变的严重程度相关,在MRI所有序列上显示为直径小于3 mm圆形、卵圆形或线性的脑脊液样信号。EPVS的病因目前尚未阐明,基底节区EPVS周围出现脑组织的破坏,且伴有一定程度的胶质增生;且EPVS同时多合并腔隙或脑白质病变,这些可能参与或导致脑卒中患者神经功能的损伤。对急性缺血性卒中患者行1 y的门诊随访,发现基线EPVS是预后不良、生活质量差的独立预测因子[25]。本研究结果与既往研究结果一致。以上研究均是探讨单一CSVD影像学表现与卒中预后不良或卒中复发风险的关系,关于CSVD总体负担与两者关系少有研究。由于CSVD总体负担较单一CSVD的影像学表现更能反映脑小血管病变对大脑损伤的严重程度,遂逐渐引起临床医师的关注。
近年来,有作者探讨了CSVD总体负担与缺血性卒中预后的关系。Huo等[23]研究发现,CSVD总体负担与急性缺血性卒中90 d预后不良有关;腔隙、WMH、EPVS及CSVD总体评分与缺血性卒中预后良好呈负相关,但此研究未探讨CSVD总体评分对不同病因分型的卒中患者是否具有同样预测价值,且CSVD总体评分未纳入CMBs影像学表现,可能低估了CSVD总体负担对卒中后神经功能预后的影响。Liu等[30]研究发现,CSVD总体负担是接受静脉rt-PA治疗的缺血性卒中患者90 d预后不良的可靠预测指标。本文首次探讨CSVD总体负担与LAA型脑梗死患者长期预后的关系,结果发现,CSVD总体负担是LAA型脑梗死患者长期预后不良的独立危险因素。本研究还显示,CSVD 2~4组的年龄、高血压的比例明显高于CSVD 0~1组,差异有统计学意义(P<0.05),与既往研究结果一致。NIHSS为常用的判断脑卒中患者发病后神经功能受损严重程度的工具,可靠性较好。本研究发现,CSVD 2~4组与CSVD 0~1组相比,NIHSS评分有统计学差异,提示CSVD严重程度可能会影响卒中的严重程度,本研究多因素Logistic回归分析结果提示,CSVD总体负担是脑梗死患者90 d及1 y后预后不良的独立危险因素。
CSVD总体负担如何影响患者的神经功能恢复,机制尚不清楚。CSVD常见的危险因素有年龄、吸烟史、高血压、糖尿病、阻塞性睡眠呼吸暂停等[31]。CSVD总体负担与年龄、高血压、糖尿病及既往卒中史相关[23]。推测可能原因为:上述危险因素导致长期小血管慢性损伤,使得脑内神经储备功能下降。较高的CSVD负荷伴发急性脑血管病,破坏脑白质组织的显微结构,破坏脑的网络结构,降低脑组织的可塑性和代偿机制,继而阻碍了卒中患者的神经功能的恢复[32]。更重要的是,CSVD可能通过破坏对学习和神经康复很重要的运动/认知网络来影响神经功能的康复[23]。
综上所述,本研究阐明了CSVD总体负担与LAA型脑梗死患者神经功能缺损严重程度和临床结果的关系,CSVD总体负担有望作为判断脑梗死患者神经功能预后的潜在影像学标志,对临床医师早期评估卒中患者的转归及总体预后有重要的临床意义。
