可见分光光度法测定α-淀粉酶活力
2020-05-07张雪娇刘春叶
张雪娇,田 欢,刘春叶,尤 静
(西安医学院药学院,陕西 西安 710021)
在人体的正常生长发育过程中,淀粉是非常重要的供能物质。α-淀粉酶是人体内专一性分解淀粉糖苷键的一类生物活性酶。摄入人体的淀粉在淀粉酶的作用下水解成易于吸收的葡萄糖,葡萄糖进入血液后再与氧气作用产生热量为人体的各个器官活动提供能量,从而保证机体的正常运行。探讨准确度高、灵敏度好的α-淀粉酶活力的测定方法,不但在临床医学的生理学研究中有重要的意义[1-2],而且在生产实践中也有一定的应用价值[3-4]。

1 实验
1.1 试剂与仪器
碘化钾、碘,AR,天津科密欧化学试剂有限公司;盐酸,GR,开封东大化工(集团)有限公司;柠檬酸,AR,无锡第二制药厂;磷酸氢二钠,AR,成都新区木兰镇工业开发区;氯化铜,AR,北京东风化学试剂有限公司;可溶性淀粉,AR,天津风船化学试剂有限公司;α-淀粉酶,AR,邢台万达生物化学试剂有限公司;实验用水为蒸馏水。
UV-757型紫外可见分光光度计,上海尤尼柯有限公司;ALC-210.4型电子天平,赛多利斯科学仪器(北京)有限公司;AnkeTGL-16C型离心机,上海安亭仪器厂;PB-10型酸度计,德国Acculab公司;DZKW-6-9型电热恒温水浴锅,北京永光明医疗厂。
1.2 溶液的配制
碘液:精密称取1.002 1 g碘化钾和0.401 4 g碘,用少量的蒸馏水完全溶解,定容至100 mL,摇匀,贮于棕色瓶中。实验前精确移取该溶液3.00 mL,再用蒸馏水稀释至100 mL,贮于棕色瓶中,备用。
磷酸氢二钠-柠檬酸缓冲溶液(pH值6.5):分别配制0.2 mol·L-1的磷酸氢二钠溶液和0.1 mol·L-1的柠檬酸溶液,借助pH计配制不同pH值的缓冲溶液,备用。
酶解反应终止液[8]:精密称取氯化铜1.003 2 g,用蒸馏水定容至10 mL;量取37% 盐酸9 mL,用蒸馏水稀释至90 mL,将二者混合即为终止液,备用。
0.01 g·mL-1淀粉溶液:精密称取1.000 9 g烘干之后的可溶性淀粉,先加一定量的缓冲溶液,加热溶解至透明,冷却后再用缓冲溶液定容至100 mL,常温保存,备用。实验前根据浓度需要用缓冲溶液稀释。
0.01 g·mL-1α-淀粉酶母液:精密称取α-淀粉酶1.001 8 g,用缓冲溶液溶解后定容至100 mL,置于4 ℃冰箱保存,备用。实验前根据浓度需要用缓冲溶液稀释。
1.3 方法
1.3.1 吸收波长的确定
分别配制一定浓度的碘溶液、淀粉溶液和碘-淀粉络合物溶液,分别以相应试剂空白作参比,在400~800 nm区间进行扫描,以确定碘-淀粉络合物溶液的最大吸收波长。
1.3.2 淀粉测定浓度的确定
在一系列比色管中分别加入5.00 mL不同浓度的淀粉溶液,置于37 ℃水浴中恒温10 min,依次加入同温度预热的pH值6.5缓冲溶液及终止液各1.00 mL。摇匀后冷却至室温,分别取0.2 mL于试管中,再分别加入7 mL碘液,充分摇匀后立即在580 nm处测定吸光度,以确定淀粉的最佳浓度测定范围。
1.3.3 α-淀粉酶活力的测定
样品管:在一系列比色管中分别加入1.00 mL不同浓度的α-淀粉酶溶液;标准管:用1.00 mL的缓冲溶液代替酶液。将所有试管置于37 ℃水浴中恒温2 min后,依次加入同温度预热的0.008 g·mL-1淀粉溶液5.00 mL,立即混匀。37 ℃反应10 min后,立即加入1.00 mL终止液。摇匀后冷却至室温,分别取0.2 mL于试管中,再分别加入7 mL碘液,充分摇匀后立即在580 nm处测定吸光度,根据相同浓度淀粉在加入不同量α-淀粉酶前后吸光度的变化测定α-淀粉酶活力。
1.3.4 方法学考察

2 结果与讨论
2.1 吸收光谱及测定波长的选择
碘溶液、淀粉溶液和碘-淀粉络合物溶液的吸收光谱如图1所示。

图1 吸收光谱Fig.1 Absorption spectra
由图1可以看出,在580 nm处碘溶液和淀粉溶液均无明显吸收,而碘-淀粉络合物溶液有一较强的吸收峰。说明碘与淀粉所形成的络合物在580 nm处产生了特征吸收。因此,选择580 nm作为测定波长。
2.2 淀粉测定浓度的确定
2.2.1 淀粉浓度与吸光度的关系
根据Lambert-Beer定律,采用紫外可见分光光度法对物质含量进行测定时,吸光度应控制在0.2~0.8之间[9],一般不宜超过1.0,否则测定结果将会产生较大偏差。故而在本实验中,参照1.3.2项下方法,分别配制不同浓度的淀粉溶液,与过量的碘液充分显色后测定其吸光度,结果如图2所示。

图2 淀粉浓度与吸光度的关系Fig.2 Relationship between concentration of starch and absorbance
由图2可以看出,当淀粉浓度在0.001~0.008 g·mL-1时,淀粉与碘所形成的络合物在580 nm处所产生的特征吸收与淀粉浓度呈正相关性。以淀粉浓度(c)为横坐标、吸光度(A)为纵坐标绘制标准曲线,得标准曲线方程:A=129.49c+0.0097,R2=0.9962,线性关系良好。表明淀粉浓度在0.001~0.008 g·mL-1范围内,可以利用碘与淀粉的显色反应对淀粉含量进行测定。
2.2.2 方法学考察
为确定2.2.1中方法的可靠性,分别对上述方法的稳定性、精密度、重现性及加样回收率进行考察。结果表明,使用该方法测定淀粉含量,其结果在3 h内稳定性良好,测定结果的重现性和精密度RSD值分别为0.3%和0.2%,加样回收率在104.7%~114.5%之间,符合《中华人民共和国药典》所规定的90%~120%范围内。说明采用该法对淀粉含量进行测定,结果准确,方法可靠。
2.3 α-淀粉酶活力的测定
2.3.1 酶活力的计算方法
以每分钟降解1 mg淀粉所消耗的酶量定义为一个酶活力单位(U)。每毫克α-淀粉酶中所含有的酶活力单位数定义为比活力(U·mg-1)。
前期研究发现,淀粉与碘所形成的络合物在580 nm处能够产生特征吸收,并且在一定范围内,所测得的吸光度值与淀粉浓度呈良好的线性相关,故而可以利用可见分光光度法考察在其它条件相同时,对比添加α-淀粉酶和不添加α-淀粉酶时发生水解之后的淀粉剩余量,并根据该剩余量计算酶活力。
参照1.3.3项下的方法,设酶的质量用me表示,样品管中淀粉量和吸光度分别用mx和Ax表示,标准管中淀粉量和吸光度分别用ms和As表示,则有:
(1)

(2)
根据1.3.3项下方法,样品管和标准管中淀粉量均为5 mL 0.8%的淀粉,即40 mg,则样品管中淀粉降解量为(40-mx)mg,该样品管内的酶活力为:

(3)

(4)
2.3.2 酶活力的测定
参照1.3.3项下的方法进行操作,计算酶活力和比活力,结果如表1所示。
表1 酶量与酶活力的关系
Tab.1 Relationship between enzyme amount and enzyme activity

试管编号酶加入量/mg吸光度酶活力/U比活力/(U·mg-1)标准管00.991900样品管10.010.89040.41 40.9 样品管20.020.78630.83 41.5 样品管30.030.67951.26 42.0 样品管40.040.57691.67 41.8 样品管50.050.49112.02 40.4 样品管60.060.38832.43 40.6 样品管70.070.30652.76 39.5 样品管80.080.21533.13 39.1
根据表中的数据,将酶浓度与酶活力进行线性拟合,结果如图3所示。
从图3可以看出,当α-淀粉酶浓度在0.001~0.008 mg·mL-1之间时,酶活力(y)与α-淀粉酶浓度(x)线性关系良好,拟合标准曲线方程为:y=375.75x+0.1208,R2=0.9939。表明α-淀粉酶浓度在0.001~0.008 mg·mL-1范围内,可以利用碘与淀粉的显色反应对酶活力进行测定。
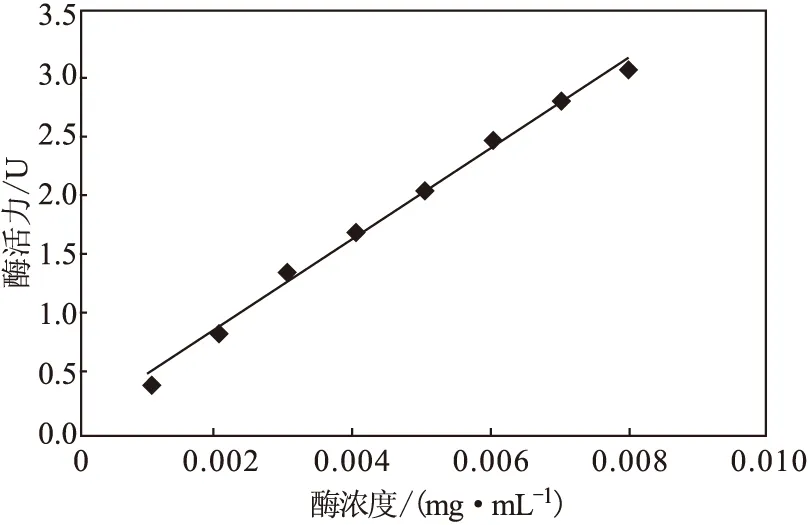
图3 酶活力随酶浓度的变化曲线Fig.3 The curve of enzyme activity with the change of enzyme concentration
2.3.3 方法学考察
为确定1.3.3中方法的可靠性,分别对上述方法的稳定性、精密度、重现性进行考察。结果表明,使用该方法测定α-淀粉酶活力在3 h以内稳定性良好,测定结果的重现性和精密度RSD值分别为3.8% 和2.6%。说明采用该法在一定的浓度范围内可对α-淀粉酶活力进行测定。
3 结论

该法操作简单,反应条件也比较容易控制,结果准确可靠,且重现性好。受可见分光光度法测定方法的限制,当淀粉浓度较大时可考虑稀释后采用此方法进行测定。
