Notch信号通路对前列腺癌PC-3细胞增殖侵袭和迁移能力的影响
2020-05-07李传贵
李传贵, 王 强
(河北省保定市第一中心医院泌尿外一科, 河北 保定 071000)
前列腺癌(prostate cancer)是西方男性最常见的肿瘤疾病,每年发病超16万,死亡约2.7万,是北美和欧洲男性癌症死亡的第三大原因[1]。前列腺癌的高发区主要在西方发达国家,但是近年中国男性前列腺癌的发病率有逐年上升的趋势[2]。Notch信号通路是一条介导相邻细胞间相互作用的高度保守的信号通路,其由Notch受体、配体以及细胞内效应分子组成,广泛存在于各种生物中。研究表明,在非小细胞肺癌中, Notch配体DLL4可促进肿瘤血管的发育和成熟,改善其结构和功能,促进肿瘤的生长[3];研究发现65%以上的T细胞极性淋巴细胞白血病(T-ALL)患者的Notch1基因呈高表达,可直接激活MYC的表达,Notch1和MYC调节前馈环路中的常见转录靶标,促进T-ALL肿瘤细胞的增殖和自我更新,提示Notch信号通路的激活可促进某些肿瘤的发生发展[4]。但是Notch信号在前列腺癌中的作用机制以及下游分子机制仍然有待于进一步阐明,本文通过研究阻断和激活Notch信号通路对前列腺癌细胞的增殖、侵袭和迁移的影响和作用机制,为前列腺癌的治疗提供新的方向。
1 材料与方法
1.1细胞株和主要试剂:前列腺癌PC-3细胞购自ATCC细胞库,DAPT购自Sigma公司,过表达Notch1胞内段病毒AdNICD腺病毒和对照AdCtrl病毒购自汉恒生物,DMEM培养基、胎牛血清购自Gibico公司,胰蛋白酶、RIPA裂解液购自碧云天公司,Trizol购自Invitrogen公司,反转录试剂盒和实时定量PCR试剂盒购自Takara公司,EdU试剂盒购自广东锐博公司,Matrigel (1∶8稀释)基质胶购自BD公司,Transwell小室购自Millipore公司,4%多聚甲醛购自谷歌生物公司,5 %结晶紫购自Sigma公司,AKT和P-AKT抗体(1∶1000稀释)购自CST公司,二抗HRP标记抗兔IgG (1:2000稀释)购自CST公司。
1.2细胞培养和细胞感染:用含10%胎牛血清的DMEM培养基在37℃、5%CO2、饱和湿度的孵箱中培养前列腺癌PC-3细胞。取对数生长期的PC-3细胞,离心后培养基重悬,以5×105细胞/孔密度接种于含有圆玻片的24孔板。12h细胞贴壁后加入50μM的DAPT,DMSO作为对照组;或者12h细胞贴壁后加入AdNICD和AdCtrl对照腺病毒,8h换液,48h后进行后续实验。每组设3个复孔。
1.3qRT-PCR:细胞培养72h后,利用Trizol法提取总RNA,并检测其浓度和纯度。后续根据mRNA反转录试剂盒的说明书进行反转录。以反转录后的产物作为模板,进行实时定量PCR实验。内参GAPDH上游引物为:5'-TGCACCACCAACTGCTTAGC-3',下游引物为:5'-GGCATGGACTGTGGTCATGAG-3';Hes1上游引物为:5'-AAGAAAGATAGCTCGCGGCAT-3',下游引物为:5'-CCAGCACACTTGGGTCTGT-3';Hes5上游引物为:5'-AGCTACCTGAAGCACAGCAAAG-3',下游引物为:5'-AGGCACCACGAGTAACCCTC-3'。
1.4EdU实验检测细胞增殖能力:添加DAPT和DMSO或AdNICD和AdControl处理72h后,弃废旧培养基,根据EdU试剂盒说明书进行实验。将A液与培养基按1∶1000稀释,将配好的培养基加入24孔板,于培养箱中孵育2h。弃培养基,PBS洗三次,加入4%PFA室温固定30min。弃固定液,加入2%甘氨酸中和,使用Apollo室温染色30min。染核,封片,荧光显微镜下观察。每组设3个复孔。
1.5Transwell小室实验检测细胞侵袭能力:DAPT组和DMSO组或AdNICD组和AdCtrl组每组分别设3个小室,每小室提前铺入Matrigel基质胶。将处理72h后的PC-3细胞以1×105/孔的密度接种于Transwell小室中,下层为完全培养基,培养24h后取出小室。4%PFA室温固定20min,利用5%结晶紫染色20min,PBS洗三遍,荧光显微镜下观察。
1.6划痕实验检测细胞迁移能力:DAPT组和DMSO组或AdNICD组和AdCtrl组每组分别以1×106/孔的密度将细胞接种于六孔板(背面用笔提前画好直线),继续培养24h,用1mL枪头垂直于板底和直线划痕。PBS洗三次,加入培养基继续培养,于0和24h取样拍照。每组设3个复孔。
1.7Western blot检测蛋白水平变化:使用RIPA裂解法提取细胞总蛋白,经SDS-PAGE电泳后,PVDF转膜,5%脱脂奶粉室温封闭1-2h,一抗于4℃孵育过夜,室温孵育二抗2h,经化学发光后进行结果分析。

2 结 果
2.1qRT-PCR验证DAPT阻断和AdNICD激活Notch信号通路的效率:通过qRT-PCR实验对DMSO和DAPT或AdCtrl和AdNICD处理过的前列腺癌PC-3细胞中的Notch信号通路的下游靶分子Hes1和Hes5的含量进行检测,结果显示,DAPT加入PC-3细胞作用72h后,Hes1和Hes5的mRNA水平显著下调(图1A,*P<0.001,#P<0.05),表明DAPT阻断Notch信号通路有效。AdNICD作用PC-3细胞72h后,Hes1和Hes5的mRNA水平显著上升(图1B,*P<0.01,#P<0.05),表明NICD有效激活Notch信号通路。
2.2EdU实验检测添加DAPT和AdNICD对PC-3细胞增殖能力的影响:将PC-3细胞分为两组,分别添加DMSO和DAPT或AdNICD和AdCtrl,作用72h后对其进行EdU实验,检测细胞增殖能力的变化。结果显示,添加DAPT作用72h后前列腺癌PC-3细胞的增殖能力下降(图2A,P<0.01);感染AdNICD作用72h后前列腺癌PC-3细胞的增殖能力增强(图2B,P<0.05)。
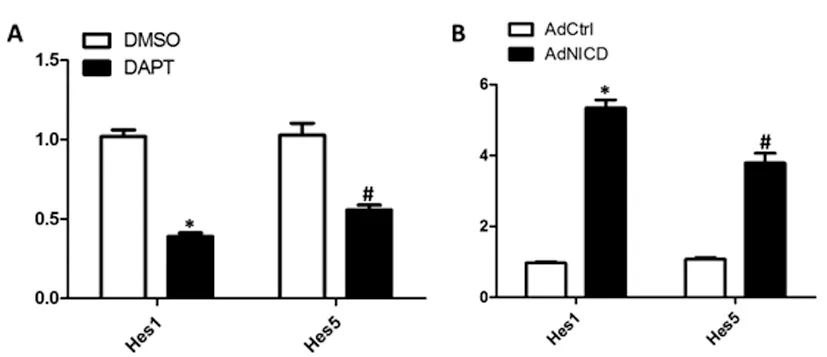
图1 DAPT阻断或NICD激活Notch信号通路的效率
注:A.前列腺癌PC-3细胞添加DAPT后,采用qRT-PCR检测Notch信号通路的下游靶分子Hes1和Hes5的表达水平变化,验证阻断Notch信号通路的效率;B.前列腺癌PC-3细胞感染AdNICD后,采用qRT-PCR检测Notch信号通路的下游靶分子Hes1和Hes5的表达水平变化,验证激活Notch信号通路的效率。

图2 DAPT阻断或NICD激活Notch信号通路后PC-3细胞增殖能力变化
注:A.前列腺癌PC-3细胞添加DAPT后,采用EdU实验方法检测细胞增殖能力变化;B.前列腺癌PC-3细胞转染AdNICD后,采用EdU实验方法检测细胞增殖能力变化。
2.3Transwell小室实验检测添加DAPT和AdNICD对PC-3细胞侵袭能力的影响:将PC-3细胞分为两组,分别添加DMSO和DAPT或AdNICD和AdCtrl,作用72h后对其进行transwell小室实验,检测细胞侵袭能力的变化。结果显示,DAPT处理后细胞的侵袭能力减弱(图3A,P<0.01);AdNICD感染后细胞侵袭能力增强(图3B,P<0.05)。

图3 DAPT阻断或NICD激活Notch信号通路后PC-3细胞侵袭能力变化
注:A.前列腺癌细胞PC-3添加DAPT后,采用Transwell小室实验方法检测细胞侵袭能力变化;B.前列腺癌PC-3细胞转染AdNICD后,采用Transwell小室实验方法检测细胞侵袭能力变化。
2.4划痕实验检测添加DAPT和AdNICD对PC-3细胞迁移能力的影响:将PC-3细胞分为两组,分别添加DMSO和DAPT或AdNICD和AdCtrl,作用72h后对其进行划痕实验,检测细胞迁移能力的变化。结果显示,DAPT组细胞迁移能力下降(图4A,P<0.01);感染AdNICD后细胞迁移能力增强(图4B,P<0.01)。
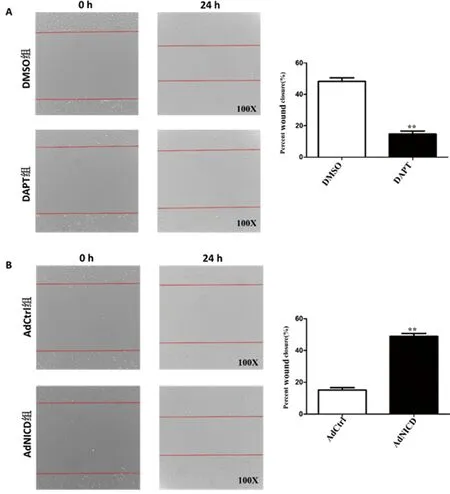
图4 DAPT阻断或NICD激活Notch信号通路后PC-3细胞迁移能力变化
注:A.前列腺癌细胞PC-3添加DAPT后,采用划痕实验方法检测细胞迁移能力变化;B.前列腺癌PC-3细胞转染AdNICD后,采用划痕实验方法检测细胞迁移能力变化。
2.5Western blot检测添加DAPT和AdNICD作用于PC-3细胞后AKT信号通路的变化:DAPT和AdNICD分别作用于PC-3细胞72h后,收集细胞提取蛋白,进行Western blot实验,检测AKT信号通路分子的表达水平变化。结果显示,添加DAPT后,细胞的磷酸化AKT蛋白表达水平明显下降,但总AKT蛋白表达水平无明显变化(图5A,P<0.01);感染AdNICD后,细胞的磷酸化AKT蛋白表达水平明显升高,但总AKT蛋白表达水平无明显变化(图5B,P<0.05)。
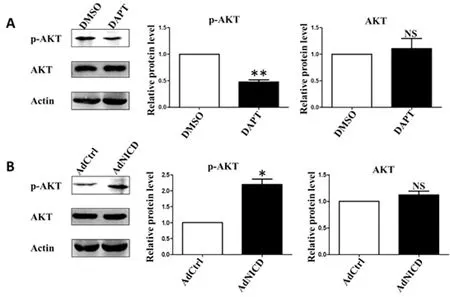
图5 DAPT阻断或NICD激活Notch信号通路后AKT信号通路相关分子水平变化
注:A.前列腺癌细胞PC-3添加DAPT后,采用Western blot实验方法检测AKT信号通路的变化;B.前列腺癌PC-3细胞转染AdNICD后,采用Western blot实验方法检测AKT信号通路的变化。
3 讨 论
前列腺癌目前已经成为我国男性的常见疾病,国内前列腺癌发病呈现显著的地域差异,发达地区发病率增加尤为显著,同时,前列腺癌的生存率较差,尤其是广大农村地区。国内前列腺癌发病率的增高和人口老龄化、生活方式西方化有关[5]。前列腺癌在所有癌症中的预后最差,2012年在全球癌症死亡率方面排名第二,有证据表明这可能是由于前列腺癌更倾向于转移,淋巴结和骨骼是70~80%前列腺癌相关死亡病例中转移的目的地。然而,目前缺乏对晚期或转移性前列腺癌的有效治疗,导致患者的高死亡率。雄激素剥夺治疗是转移性前列腺癌的一线标准治疗,但是大部分患者应用雄激素治疗后2~3年内发展成为趋势抵抗性前列腺癌[6]。晚期或转移性前列腺癌在临床上缺乏有效的治疗手段,如何提高患者生存率,延长生存期成为前列腺癌研究领域的热点。
Notch信号通路在癌症的发生发展中起着重要作用,调控紊乱可引起组织发育异常,可能导致肿瘤的发生,对肿瘤细胞的增殖、分化、凋亡、血管生成等过程发挥重要作用[7]。而具体的致癌或抑癌作用根据癌症类型而不同,例如,对脑部肿瘤起始细胞(brain tumor-initiating cells,BTICs)的研究发现肌腱蛋白C(Tenascin C,TNC)激活Notch信号通路,从而调控其增殖和成球能力[8];关于三阴性乳腺癌(triple-negative breast cancer ,TNBC)的研究发现miR-3178靶向调控Notch1抑制上皮细胞-间充质转化(epithelial-to-mesenchymal ,EMT)而抑制肿瘤细胞的增殖、侵袭和迁移[9];另外,Notch1可激活AKT信号通路,部分通过直接激活主要穹窿蛋白(major vault protein,MVP)促进EMT[10]。而在前列腺癌中,已有研究表明Jagged1在晚期前列腺癌组织中表达上调,Jagged1和Notch1的表达水平在转移和复发的前列腺癌中明显高于正常前列腺组织和初发前列腺癌,提示Notch信号通路的激活可能对前列腺癌的发展具有促进作用[11]。
研究表明,阻断Notch信号通常与前列腺癌的增殖相关,同时能够抑制癌细胞的克隆球形成能力,促进对化疗的敏感性,但是对肿瘤细胞的迁移和侵袭研究较少[12]。Notch信号通路的激活需要γ-分泌酶对受体进行切割,γ-分泌酶抑制剂(γ-secretase inhibitor,GSI)DAPT可阻断Notch信号通路。本研究对前列腺癌PC-3细胞加入DAPT后,RT-PCR实验结果显示前列腺癌PC-3细胞的Hes1、Hes5的mRNA水平较对照组明显下降,提示干预有效。对细胞进行EdU检测发现,DAPT组的细胞增殖能力减弱,后续的Transwell和划痕实验显示,DAPT组的列腺癌细胞系PC-3侵袭和迁移能力降低。实验证实,DAPT阻断Notch信号通路后前列腺癌细胞系PC-3的增殖、侵袭和迁移能力减弱。相反,前列腺癌PC-3细胞感染过表达Notch1胞内段病毒AdNICD腺病毒后,细胞的增殖、侵袭和迁移能力增强。
Notch信号作用于前列腺癌细胞的下游分子机制。AKT是一种丝氨酸/苏氨酸特异性蛋白激酶,在肿瘤细胞增殖、侵袭、转移、血管生成等过程中发挥重要作用。研究发现AKT信号通路与前列腺癌的进展密切相关,42%的原发性前列腺癌和所有的转移性肿瘤中发现了AKT通路的改变[13]。DAPT阻断Notch信号通路后,前列腺癌PC-3细胞的AKT磷酸化水平下降,感染AdNICD激活Notch信号通路后,前列腺癌PC-3细胞的AKT磷酸化水平升高,我们的研究显示,阻断/激活Notch信号分别降低/增加AKT磷酸化水平,提示Notch信号通路调控前列腺癌细胞行为可能通过活化AKT通路实现的。
综上所述,本研究证实,阻断/激活Notch信号通路分别抑制/促进前列腺癌细胞PC-3的增殖、侵袭和迁移能力;此外,Notch信号通路激活与AKT磷酸化水平呈正相关。在前列腺癌细胞中,Notch信号可能通过调控AKT信号通路从而影响细胞增殖、侵袭和迁移,进而影响前列腺癌进展。本研究结果为下一步体内实验的进行提供了基础,也为前列腺癌新的分子治疗策略提供了理论依据。
