超声造影与MRI图像融合虚拟导航技术在肝癌精准治疗中的应用研究
2020-05-07钱纪江朱锦龙董怡费迎明沈华江孟德莉朱国方丁凤锋
钱纪江 ,朱锦龙 ,董怡 ,费迎明 ,沈华江 ,孟德莉 ,朱国方 ,丁凤锋
(1.绍兴文理学院附属医院,浙江 绍兴 312000;2.复旦大学附属中山医院,上海200030)
近年来,通过超声造影(contrast enhanced ultrasound,CEUS)对肿瘤微血管灌注的介入治疗已广泛应用于肝脏肿瘤中[1]。CEUS与MRI图像融合导航技术是源自影像融合与定位追踪技术的一种实时虚拟导航技术,与导航系统相匹配的超声探头和动态磁定位系统GPS是其核心,可将MRI的DICOM图像通过三点对应法投射到超声图像上,并对图像进行匹配融合实现实时、动态对应及准确定位[2-3]。本研究通过对比常规超声(US)、CEUS及CEUS-MRI图像融合导航技术探讨图像融合虚拟导航技术在肝癌射频消融(radiofrequency ablation,RFA)治疗中的应用价值。
1 资料与方法
1.1 一般资料 选择2018年6月-2019年12月本院收治的拟行RFA治疗的原发性肝癌患者共60例(83个病灶)。入组标准:(1)病灶均经术前穿刺活检及病理确诊;(2)肿瘤最长径<3cm,肝功能Child-Pugh分级A-B级;(3)影像资料齐全整。排除标准:(1)肿瘤远处转移、凝血异常者(INR>1.5);(2)有心肺肾等严重功能障碍、身体状况无法耐受者。共纳入60例,其中男34例,女26例;年龄35-72 岁,平均(50.7±4.9)岁;肿瘤长径 1.26~2.94cm,平均(1.86±0.37)cm。按照随机数字表法将60例分为US组、CEUS组和CEUS-MRI组。三组年龄、性别构成比、肿瘤长径等基本资料比较差异无统计学意义(P>0.05)。详见表1。本研究经过医院伦理委员会审批通过且患者知情同意。

表1 三组一般资料比较
1.2 方法 (1)US组。对肝癌患者分别进行常规灰阶超声、彩色多普勒超声检查,观察灰阶超声表现及彩色血流情况,并记录超声检出病灶情况,在常规超声引导下对肝癌进行射频消融治疗。(2)CEUS组。采用实时超声造影匹配技术与造影软件,造影剂为Bracco公司的Sono Vue,用0.9%氯化钠溶液5ml加入59mg干粉剂后振荡均匀制成混悬液。经肘正中静脉团注造影剂1.5~2.4mL,快速推注0.9%氯化钠溶液5mL冲管。持续观察5~10分钟,明确病灶部位及范围,并在超声造影引导下对肝脏肿瘤进行射频消融治疗。(3)CEUS-MRI组。采用图像融合虚拟导航技术(Volume Navigation system,version R1.0.5,GE Healthcare)。先对肝癌患者行 MRI检查,以确定病灶的位置及清晰度,并获得薄层DICOM数据资料。连接磁感应器并靠近患者,在体表磁片处确定最佳放置方位与距离,将DICOM数据导入超声仪器,以双幅显示超声、MRI图像。利用超声探头选择对位结构,分别在超声、MRI图像上确定合适参照物位置,通常选用门脉右支分支处、门脉矢状段、胆囊颈、肝囊肿等图像进行匹配。匹配成功后,微调缩小匹配差异,使超声和MRI的断面图像融合达到最佳效果。当两种图像叠加后,同一解剖结构间的距离差<5mm视为融合成功。选用超声造影剂SonoVue1.5~2.0mL,对超声图像上与MRI图像上相对应的病灶进行超声造影检查,进一步明确病灶的位置、毗邻结构及增强消退表现,在多模态虚拟导航技术引导下穿刺及行射频消融治疗。详见图1。

图1 三组影像表现。1A:常规灰阶超声图像,病灶显示不清;1B:病灶 MRI图像(白箭);1C:采用实时导航将病灶MRI图像与超声图像对位融合,注射造影剂后与MRI对应的部位动脉期出现了显著增强高回声病灶(左图白箭)。
1.3 观察指标 (1)穿刺情况。观察各组调针次数、定位时间、穿刺时间、总手术时间,每例患者穿刺3次若仍未成功则放弃穿刺。(2)疗效。RFA术后1个月利用CEUS复查病灶,评估病灶消融的完整性和复发率。若肿瘤呈完全坏死征象,甲胎蛋白(AFP)值降至10ng/mL以下、MRI显示肿瘤消失和(或)肝动脉造影未见肿瘤染色视为病灶消融完全坏死。(3)并发症。记录各组RFA术中及术后1周胸水、肝被膜血肿、腹腔出血等并发症的发生情况。
1.4 统计学处理 采用SPSS17.0进行统计分析,计量资料以(±s)表示,采用单因素方差分析或LSD-t检验;计数资料以百分率表示,采用χ2检验。
2 结果
2.1 穿刺情况 三组定位时间、穿刺时间、总手术时间及调针次数差异均有统计学意义(P<0.01),与US组、CEUS组比较,CEUS-MRI组定位时间、穿刺时间及总手术时间均明显缩短,调针次数明显减少,差异均有统计学意义(P<0.05)。详见表2。
表2 三组穿刺情况及手术时间比较(±s)

表2 三组穿刺情况及手术时间比较(±s)
与 US组比较 *P<0.05,与 CEUS组比较△P<0.05
组别 n 病灶数 调针次数 穿刺时间(min) 定位时间(min) 总手术时间(min)US 组 20 27 1.87±0.51 12.26±2.61 15.33±1.76 62.64±14.51 CEUS 组 20 28 1.61±0.56 10.37±2.55 13.16±1.65 55.49±12.68 CEUS-MRI组 20 28 1.38±0.44*△ 8.50±2.17*△ 10.25±1.40*△ 42.67±9.28*△F- - 3.07 2.84 7.43 13.43 P- - 0.003 0.006 <0.001 <0.001
2.2 疗效 三组完全消融坏死率比较差异有统计学意义(P<0.01),术后 1个月 CEUS复查显示,CEUS-MRI组完全消融坏死率显著高于US组、CEUS组,差异均有统计学意义(P<0.05)。三组复发率比较差异无统计学意义(P>0.05)。详见表3。
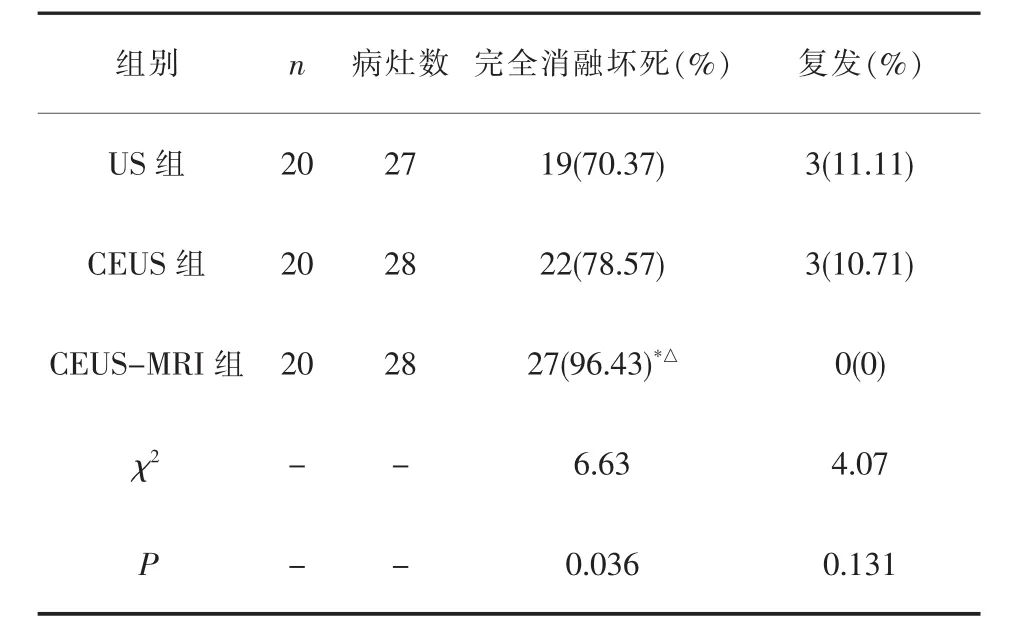
表3 三组完全消融坏死率及复发率(%)
2.3 并发症 射频消融术中及术后1周,三组胸水、肝被膜血肿、腹腔出血的发生率差异均无统计学意义(P>0.05)。 详见表 4。

表4 三组术中及术后1周并发症比较[n(%)]
3 讨论
临床实践表明,影像学技术在肝脏占位病变射频消融治疗中的术前病灶评估、术中穿刺引导、消融过程监控及术后疗效评价等全过程中发挥着重要作用[4]。早期或复发肝癌病灶在常规超声上的表现越来越不典型,某些隐匿性病灶在肝硬化背景下呈等回声改变,加上受部分小肝癌位置特殊(肝包膜下、肝门区或近大血管等)、肺气或肋骨遮挡、操作手法等多方面因素影响,常规超声甚至超声造影均难以显示和定位,从而影响超声引导下的局部射频消融等微创治疗顺利实施。
超声造影与MRI图像融合导航技术是基于影像融合和定位追踪技术发展的一项崭新的实时虚拟导航技术。其核心技术包括一个与导航系统相匹配的超声探头及一个动态磁定位系统GPS。利用超声探头及超声仪器上配置的磁感应传感器产生一个磁场区域,将MRI的DICOM图像通过三点对应法映射至实时超声扫描图像上,通过特定的软件对每一帧图像进行对位融合,实现实时对应,使MRI上显示的肝癌病灶也能在超声图像上准确定位。已有研究表明,超声造影与MRI图像融合虚拟导航技术有效综合了CEUS与MRI两种影像学检查优势,既凸显了CEUS实时监测消融优势,又充分利用了MRI良好的空间分辨率,为小肝癌的术前定位、定性及术中引导微创治疗提供了新的途径,可精确引导穿刺针或消融针到达病灶,对常规超声或超声造影难以显示病灶的视频消融治疗成功率达90%以上[5]。有研究显示,CEUS与MRI多模态虚拟导航技术实现图像融合的成功率为100%,对超声难以显示病灶的定位准确率为95.9%,显著高于常规超声 42.9%(P<0.05)[6]。 本研究结果显示,与 US组、CEUS组比较,CEUS-MRI组定位时间、穿刺时间及总手术时间均明显缩短(P<0.05),调针次数明显减少(P<0.05),说明CEUS与MRI多模态虚拟导航技术通过实时可视、图像融合,可提供更为精准的穿刺定位,从而在最短的时间内完成肿瘤病灶的消融。
结合CEUS-MRI术前精准定位,观察目标病灶的内部增强-消退表现,避免损伤其毗邻的重要结构或大血管等,消融后术中即时评价消融范围,必要时对残留病灶补充消融,尽可能利用一次穿刺完成彻底消融和完全坏死,减少肿瘤播散机会[7]。本组中,三组视频消融术中及术后1周胸水、肝被膜血肿、腹腔出血等穿刺相关并发症发生率比较差异均无统计学意义(P>0.05),而术后1个月CEUS-MRI组完全消融坏死率均显著高于US组和CEUS组(P<0.05),与 Martin 等[8]的研究结果相符,与 CEUSMRI引导下肝肿瘤消融更为彻底,有效阻断了肿瘤的复发和转移有关。但是,多模态融合影像技术也存在一定的局限性,尤其对病灶直径<10mm的肝局灶性病变,因其易被肺部、胸膈等部位遮盖。故手术体位尽量与检查时保持一致,并选择在平静呼气末或吸气末行定位穿刺,并随时验证及微调,确保图像精准融合。
综上所述,基于CEUS与MRI的多模态虚拟导航技术在肝肿瘤精准治疗中具有较高的可行性与安全性,尤其对常规超声及超声造影无法显示或显示不佳的病灶,该技术可提高定位准确性及消融完整性,不增加术后复发率,可作为肝肿瘤视频消融治疗的辅助方法。
