DWI联合磁化传递对比成像评估强直性脊柱炎骶髂关节病变活动性
2020-05-07宁秋萍王文生赵宁唐今扬任华叶慧义
宁秋萍,王文生,赵宁,唐今扬,任华,叶慧义
检测强直性脊柱炎(ankylosing spondylitis,AS)的活动性对于疾病的治疗和随访是十分必要的,可减少疾病的致残率[1-2]。MRI可以检测急性骶髂关节炎导致的骨炎、骨髓水肿、起止点炎、滑囊炎和滑膜炎等异常改变。MRI对炎症程度的分级与穿刺活检病理检查显示的组织学程度分级之间具有良好相关性[3]。根据目前国内外文献报道,DWI可应用于AS患者骶髂关节炎的病情评估和疗效随访等[4-5]。磁化传递(magnetization transfer,MT)技术在神经学领域已是一个普遍接受的工具[6-7]。目前MT成像应用于体外关节软骨的定量检测的文献较少[8-9],尚未检索到MT应用于骶髂关节软骨研究的外文文献。国内文献报道磁化传递率在检出骶髂关节炎阴性的脊柱关节炎患者中的敏感度约83.3%,但特异度较低[10]。本研究将DWI和MT成像相结合,探讨二者评估骶髂关节(sacroiliac joint,SIJ)病变活动性的价值,旨在为骶髂关节炎的早期诊断和AS患者骶髂关节炎的疗效评估提供依据。
材料与方法
1.研究对象
本研究为前瞻性诊断研究,通过中国中医科学院西苑医院伦理委员会的审核。2017年4月-2017年11月将符合纳入标准和排除标准的患者纳入本研究。所有入组患者在检查前签署了知情同意书。
纳入标准:符合强直性脊柱炎国际协会(Ankylosing Spondylitis International Society,ASAS)的诊断标准[11],且具有骶髂关节炎表现(均检出骨髓水肿)。排除标准:①骶髂关节患有原发肿瘤、转移瘤、结核等病变;②有甲状腺、甲状旁腺功能亢进及骨代谢相关疾病;③有服用影响骨质代谢药物的病史;④可能产生骶髂关节炎的类似疾病,如类风湿关节炎、痛风性关节炎和银屑病关节炎等;⑤图像信噪比差,不能进行数据分析;⑥有磁共振检查相关禁忌症,如金属植入物、幽闭恐惧症等。
2.诊断标准实验室检查指标
采集静脉血,进行红细胞沉降率(erythrocyte se-dimentation rate,ESR)、C反应蛋白(C- reactive protein,CRP)及人类白细胞抗原-B27(human leukocyte antigens B-27,HLA-B27)检查(EPICS ELITE,Beckman Coulter,Brea,CA,USA)。
本研究中的诊断金标准为临床诊断,根据强直性脊柱炎国际协会(Ankylosing Spondylitis internatio-nal Society,ASAS)的诊断标准[11],平均Bath AS活动性指数(Bath ankylosing spondylitis disease activity index,BASDAI)>6分,或BASDAI为4~6分并且ESR≥20 mm/h(Westergren法)或CRP≥6.0 mg/L的患者纳入活动组,否则为非活动组[12]。由2位主治医师职称以上风湿科医师在不知晓MRI检查结果的情况下,根据BASDAI、ESR和CRP的结果及临床病史独立对患者进行分组,意见不一致时经讨论取得一致意见。
3.检查方法
使用 GE Discovery 750 3.0T磁共振成像仪和8通道体部线圈。患者取仰卧位,除采集常规斜轴位T1WI及T2WI之外,DWI及MT具体扫描序列及参数如下。①斜轴位DWI:脂肪抑制SE-EPI序列,2D采集,b值分别为0和800 s/mm2,TR 2400 ms,TE 10.0 ms,层厚4 mm,层间距0.4 mm,矩阵128×128,视野38 cm×38 cm,激励次数2,扫描时间1 min 17 s。②斜冠位MT成像:TR 50.0 ms,TE 12.0 ms,层厚2.0 mm,层间距0.0 mm,视野38 cm×38 cm,矩阵256×224,激励次数1;MT脉冲时间8 ms,频率补偿12200 Hz,翻转角670°,脉冲类型Fermi;采用扰相梯度回波技术,2D采集,分别于施加预饱和脉冲前后各采集一次图像,2次扫描时间均为2 min 17 s。所有患者MRI检查与临床实验室检查的时间间隔<2周,期间患者未进行任何治疗。
4.MR图像分析
由两位分别具有7年和10年骨肌系统影像诊断经验的放射医师,在不知晓患者临床情况及分组的情况下分析和观察MR图像。由同一位放射医师手动勾画ROI。放置ROI前阅读常规MR图像,分别观察骨髓水肿区、脂肪沉积区、硬化区和骨髓正常区。
DWI图像分析:利用ADW 4.6工作站的MADC软件计算生成ADC图,并将b=0 s/mm2的图像与T2WI图像配准(图1),取配准后图像上病变最大的层面勾画ROI,面积15~30 mm2,ROI边缘距髂骨、骶骨骨皮质1 mm以内,同时避开骨质侵蚀、血管和囊变区。分别测量骨髓水肿区(bone marrow edema,BME)、硬化区(sclerosis,Sc),脂肪沉积区(fat depo-sit,FD)、骨髓正常区域(normal-appearing bone marrow,NABM)的ADC值[13-14]。每个病变重复测量两次取平均值。对正常区域的测量,在斜冠状位图像上,取双侧骶髂关节显示相对清晰完整的层面(约第5~9层),于每侧骶髂关节骶骨面及髂骨面分别放置3个ROI,连续测量2个层面,每侧共6个ROI,取平均值。
MT图像分析:使用viewer功能分别分析施加未施加(M0)及施加预饱和脉冲(Ms)的图像,ROI放置于双侧骶髂关节前下部腹侧关节软骨的相同部位[15],面积1~3 mm2(图2),测量软骨的信号强度(M0,Ms),重复测量3次取平均值,并根据公式(1)计算软骨的磁化传递率(magnetization transfer rate of cartilage,MTRc):
(1)
5.统计学分析
使用SPSS 22.0软件和Medcalc 15.2.2软件进行统计学分析。对2位影像医师对骨髓水肿区、脂肪沉积区、硬化区和正常骨髓区的判断及ADC值的测量一致性采用Kappa分析和组内相关系数(intra-class correlation coefficient,ICC);活动组和非活动组间各部位ADC值和MTRc值的比较采用独立样本t检验;采用ROC曲线分析各参数预测AS活动性的价值;采用logistic回归将有预测价值的指标联合,通过Z检验比较3个联合指标的ROC曲线下面积(areas under the curve,AUC)的差异。以P<0.05(双侧)为差异具有统计学意义。
结 果
1.临床特点
最终共39例AS患者纳入本研究,活动组26例,非活动组13例,两组患者的临床资料及组间比较结果见表1。活动组和非活动组HLA-B27阳性率、BASDAI和CRP的差异均具有统计学意义(P<0.001),两组间年龄、性别、发病年龄、病程和ESR的差异均无统计学意义(P>0.05)。
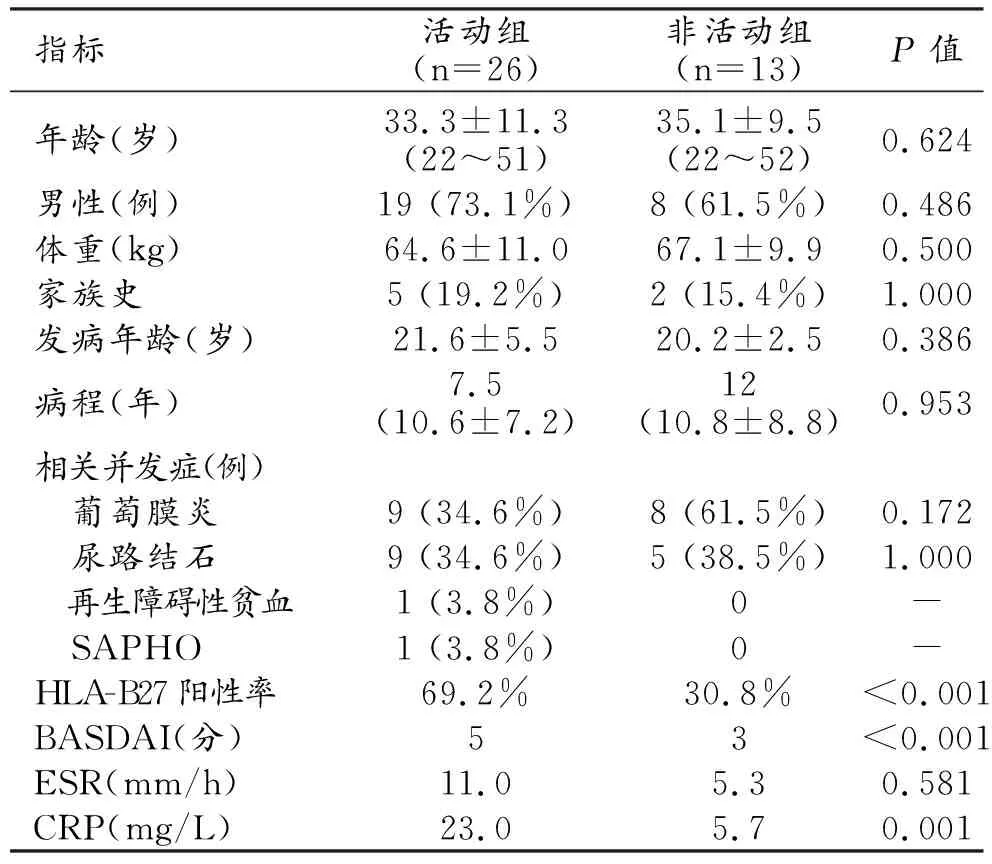
表1 两组AS患者的临床资料
注:SAPHO为滑膜炎、痤疮、脓疱病、骨肥厚和骨髓炎综合征。“-”因病例数太少,无法进行有效检验,无相应的P值。
2.ADC值和MTRc值测量一致性分析
活动组和非活动组中两位医师对ADC图和MT图上5个定量指标测量的一致性分析结果见表2。两组中两位医师对骨髓水肿区和正常区的ADC值和MTRc的测量值具有较高一致性,而对活动组中硬化区和脂肪沉积区ADC值的测量一致性较差。

表2 两组中两位医师对测量ADC值和MTRc的一致性分析
3.骶髂关节病变的判断
本研究中活动组和非活动组中均检出骨髓水肿区,其中活动组共70处,非活动组共29处。活动组中12例无硬化病变,其余14例共检出78处硬化灶(图1a);非活动组13例患者均可见硬化灶,共89处。活动组14例无脂肪沉积,其余12例共检出35处脂肪沉积;非活动组患者均可见脂肪沉积,共75处。两位医师判断活动组中骨髓水肿区、硬化区、脂肪沉积区、骨髓正常区和软骨有无病变的Kappa系数分别为0.913、0.300、0.530、0.506和0.308,P值分别为<0.001、0.262、0.010、0.009和0.116;非活动组中评估相应征象的Kappa系数分别为0.683、0.395、0.567、0.843和0.552,P值分别为0.009、0.135、0.041、0.002和0.026。两位医师对于骨髓水肿区的判断一致性高,而对于活动组和非活动组中硬化区以及活动组中软骨有无病变的判断两位医师的一致性一般。
活动组和非活动组中各部位的ADC值及MTRc及组间比较结果见表3。两组间ADCBME、ADCNABM和 MTRc的差异具有统计学意义(P<0.05),而ADCSc和ADCFD值的差异无统计学意义(P>0.05)。
4.DWI和MT预测活动性的价值
各项临床、DWI和MT成像定量参数对AS活动性的诊断效能见表4。结果显示MTRc、ADCBME和ADCNABM可以预测AS骶髂关节炎的活动性(图3~4)。
将3个有预测意义的MRI参数两两联合,3个联合参数对AS活动性均具有预测价值(图5),其中ADCBME联合ADCNABM的AUC值最高,AUC=0.885,P<0.0001;ADCBME联合MTRc、ADCNABM联合MTRc的AUC分别为0.864和0.849,均高于两个指标单独的预测价值。ADCBME+ADCNABM与ADCNABM+MTRc 的AUC差值为0.0355,95%CI为-0.028~0.099,Z值为1.105,P值为0.27;ADCBME+ADCNABM与ADCBME+MTRc的AUC差值为0.0207,95%CI为-0.108~0.149,Z值为0.316,P值为0.75;ADCNABM+MTRc与ADCBME+MTRc的AUC差值为0.0148,95%CI为-0.144~0.174,Z值为0.182,P值为0.86。三个联合参数的AUC两两比较,差异均无统计学意义(P均大于0.05)。

表4 DWI和MT成像参数和实验室指标预测AS骶髂关节炎活动性的效能
注:95%可信区间(confidential interval,CI)。
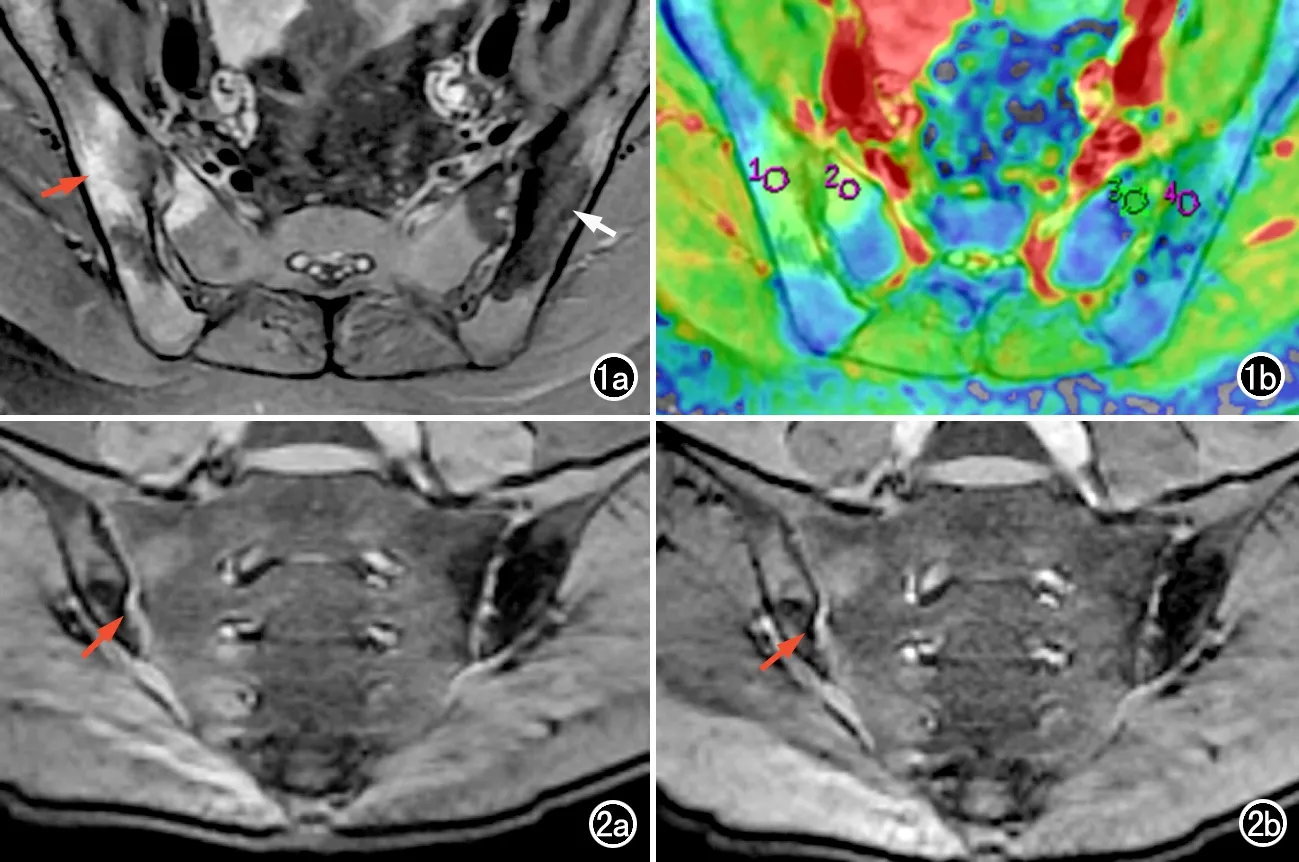
图1 AS患者骶髂关节炎。a)FS-T2WI显示双侧骶髂关节间隙变窄,关节面欠光整,右侧骶髂关节髂侧及骶侧面大片长T2水肿区(红箭),双侧骶髂关节多发片状短T2硬化区,左侧骶髂关节为著(白箭);b)T2WI和DWI配准后图像,ROI分别放置于髂侧和骶侧距关节面1mm以内。 图2 MT图像,ROI放置于关节下部腹侧软骨部(红箭)。a)施加预饱和脉冲前图像;b)施加预饱和脉冲后图像。

表3 两组的ADC值和MTRc的比较
注:ADC的单位为×10-3mm2/s。
讨 论
MRI对于早期骶髂关节炎病变的检出优于平片和CT检查[16]。相关研究结果显示DCE-MRI比STIR序列和FS-T2WI能提供更有效的信息[17-18],DWI和DCE-MRI对于AS骶髂关节炎治疗后的定量评估具有较高价值[4]。AS患者常常合并IgA肾病和其它AS相关肾病[19]。在这类患者中,反复使用对比剂可能导致肾纤维化,加重肾功能不全、肾淀粉样变性等疾病[20-21]。因此,本研究中没有使用对比剂。
Benton等[22]发现骨髓水肿是骨质破坏的标志,并且能反映炎症的活动性。研究显示机械性后背痛患者的ADC值高于早期骶髂关节炎的ADC值,表明DWI可检出AS的病变并判断疾病活动性[4,23]。本研究显示,活动组ADCBME高于非活动组,考虑细胞内和/或细胞外水的增加导致水的扩散加速、骨小梁微观结构孔隙增大,使ADC值增加。此外,活动组ADCNABM低于非活动组。临床观察中发现大部分骨髓水肿区并非单独存在,周围常常伴随骨质侵蚀、硬化和脂肪沉积,因此单独依靠ADC值或者ADC值的联合判断AS骶髂关节炎活动性价值有待进一步研究。我们推测ADCNABM可以改善活动性病变与非活动性病变鉴别的敏感度。
本研究中硬化区的ADC值的测量者间一致性(ICC)较低,可能由于骨髓水肿常常合并骨质硬化,二者同时存在时容易混淆。MRI可以的显示脂肪沉积和骨质硬化,但是缺乏特异性。此外,脂肪沉积在许多衰老和退行性病变的自然过程中出现[24]。在实际工作中,当骨质硬化和BME同时出现时,MRI检出炎症的特异度低于单纯BME[18,25-26]。此时通过多次测量和缩小ROI的方法可使测量准确性得到一定程度的改善。
本研究中非活动组患者发现29处骨髓水肿,范围多较小,散在分布,呈点状、小片状,以单侧分布为主;而活动期患者骨髓水肿的面积较大,呈斑片状,单侧或双侧分布。非活动组的ADCSc和ADCFD高于活动组,但差异无统计学意义。一项骶髂关节细针穿刺的研究显示关节软骨表面血管翳形成,软骨下骨区可见黏液样骨髓,但是在有黏液或肉芽组织存在的情况下,或在骨硬化被替代的情况下,骨髓含有较少的脂肪[27]。此外SIJ血管翳可形成于BME、骨质侵蚀、骨质硬化和脂肪沉积区。BME也可发生于非活动组,因为滑膜炎和/或软骨下骨导致的软骨破坏是一个慢性炎性反应过程[27],这也是非活动组CRP或ESR升高的原因。有研究报道随访12例BME患者,其中9例经临床治疗后实验室指标转阴,其BME依然存在,但ADC值下降[28],原因在于骨髓内脂肪的增加可限制水分子扩散,组织内含水量因水肿和黏液样改变而增加,因纤维化和骨质硬化而减少。在本研究中,非活动组的ADCFD高于活动组。脂肪化生已在健康SIJ、脊柱和退行性疾病的患者中发现[29],因此,ADCFD和ADCSc对预测骶髂关节炎活动性的价值不大。

图3 MTRc预测AS骶髂关节炎活动性的ROC曲线。 图4 ADCBME、ADCNABM、ADCSc和ADCFD预测AS骶髂关节炎活动性的ROC曲线。 图5 联合指标预测AS骶髂关节炎活动性的ROC曲线,以ADCBME联合ADCNABM的AUC最高,AUC=0.885。
DWI易于产生与长回波链相关的几何变形和扭曲,因此空间分辨率较低,需要进一步优化技术。作为补偿方法,本研究中采用将ADC图和FS T2WI进行配准的方法,可以更精确的放置ROI。目前对于骶髂关节成像的最合适b值尚无统一认识,本研究中b值为800×10-3mm2/s,除ADCSc之外,ADCNABM、ADCBME和ADCFD测量值的可重复性好(ICC>0.75),所有病变显示清晰,可满足诊断要求。另外,我们推测钙化和骨质增生会影响骨质硬化区ADC值的准确测量。
MT成像可对组织基本大分子动力学和化学定量提供定量分析[30],研究报道水分子含量下降会导致MTR值升高[31]。由于SIJ前下滑膜部的透明软骨含有大量的细胞外基质成分,如胶原、糖胺聚糖[31],因此此处MT作用较为明显[32]。与病理结果相对照,病变区域T2W SE序列和MT图像的信号减低,对应区域胶原蛋白增加,因此导致MTR增加[33]。随着炎症的进展,软骨基质损伤程度加剧,大分子蛋白含量会显著降低,MTR甚至会降低到接近于0。本研究活动组MTRc明显低于非活动组,这一结果与之前的研究一致[10]。MTRc判断AS活动性的敏感度为96.2%,高于ADCBME和ADCNABM,但是特异度却较低,仅53.9%。DWI和STIR序列对检出BME均比较敏感,图像上呈高信号可初步判断病变具有活动性。DWI检查的作用在于发现病变,进一步结合病史、家族史以及实验室检查可明确诊断,因此其检查病变活动性敏感性高的优势对于风湿科医师判断病情具有很大帮助,本研究显示,结合骨髓水肿和软骨的破坏,可改善临床工作中诊断AS活动性的特异度,将MT和DWI参数联合后,ADCBME+MTRc的AUC大于ADCNABM+MTRc,但是两者间的差异无统计学意义。另外,ADCBME+ADCNABM也可判断AS活动性。但由于骨髓水肿病变并非单独病变,有时与其它病变混杂同时出现,检测效能受到一定影响。本研究中测得的MTRc值较既往文献报道的数值偏高[16],笔者考虑与MR场强、患者的年龄范围、骶髂关节的脂肪含量等影响骨髓信号的因素有关[34]。近年来,糖胺聚糖的病理生理学技术已得到发展,如软骨钆延迟增强MRI和糖胺聚糖化学交换饱和转移[35-37],但技术上的局限性如应用高场强MR、扫描时间较长和复杂的后处理都均阻碍了以上技术的普及和应用。
本研究存在一些局限性。首先,这是一项前瞻性研究,AS患者样本量较小,可能存在选择偏倚。其次,部分容积效应可能影响对较小病变ADC值测量的准确性。第三,一些病变主要表现为囊性改变和坏死,可能使得ADC值测量不准确。第四,我们采用单指数模型DWI,所测量的ADC值可能受到组织灌注因素的影响。最后,由于伦理原因,没有获得病理结果作为参照。
总之,DWI和MT成像对AS骶髂关节炎活动性的检测具有一定价值。ADCNABM和ADCBME可用于AS患者骶髂关节炎的活动性判断,联合指标ADCNABM+MTRc和ADCBME+MTRc的诊断效能高于单个指标。
