宰后不同冷却方式对羊肉品质的影响
2020-05-04孙苏军王维婷杜鹏飞王守经柳尧波
胡 鹏,孙苏军,汝 医,王维婷,杜鹏飞,王守经,周 萌,柳尧波,*
(1.山东省农产品精深加工技术重点实验室,山东济南 250100;2.山东省农业科学院农产品研究所,山东济南 250100;3.济南市畜产品质量安全监测中心,山东济南 250100)
羊肉的品质主要由食用品质、营养品质以及安全品质等组成,其中食用品质决定着羊肉的商品价值,肉的嫩度是食用品质中重要的因素[1]。影响肉嫩度的因素包括宰前因素(品种、年龄、宰前管理等)和宰后处理(冷却温度、pH变化、肉的成熟等)[2],其中宰后24 h内的温度和pH变化是肉食用品质分析的关键控制点[3],而且宰后24 h温度变化对肉食用品质的影响远大于基因调控[4]。
目前,国内外学者对宰后冷却温度对肉品质的影响也做了大量研究。Fields等研究发现将牛胴体在14~19 ℃下放置20h与常规冷却处理相比,肉的颜色和嫩度评分较高[5];Kim[6]研究表明宰后僵直前期高温(38 ℃)引起肌节过度收缩,降低了肉的嫩度。还有学者研究认为僵直前期高温引起蛋白质变性,限制了μ-calpain酶水解蛋白质的活性,降低了随后的成熟潜力[7]。Devine等[8]研究发现在35 ℃条件下,羊肉的硬度显著增加,但也有学者研究发现将36 ℃处理的牛肉,嫩度要好于5 ℃或者15 ℃[9]。目前,宰后较高温度处理对肉嫩度的影响仍存在争议,对嫩度的影响机制有待深入研究。
本研究以湖羊为研究对象,通过研究宰后不同冷却方式对羊肉品质的影响,探讨宰后较高温度处理影响羊肉品质的机制,为优化冷却方式、改善羊肉品质提供参考依据。
1 材料与方法
1.1 材料与仪器
公湖羊选取8月龄,体重为50 kg左右的公湖羊15只,由临清润林清真食品有限公司提供;牛血清蛋白、5,5′-二疏代双(2-销基)苯甲酸(DTNB)、盐酸胍、2,4-二硝基苯肼、考马斯亮蓝均为分析纯,上海生工生物工程股份有限公司。
MP-120型酸度计 梅特勒-托利多仪器有限公司;T6型紫外可见分光光度计 北京普析通用仪器有限责任公司;CR-400型便捷式色差仪 日本柯尼卡美能达公司;SCR20BC型高速冷冻离心机 湖南平凡科技有限公司;FSH-2型可调高速匀浆机 金坛市鸿科仪器厂;TA-XT2型质构仪 英国Stable Micro Systems公司;No.11063穿刺式温度计 Deltatrak公司。
1.2 实验方法
1.2.1 样品处理 采用清真方式屠宰后取羊的背最长肌,用灭菌自封袋进行封口,将每只羊的背肌进行编号,放入带有冰盒的保温箱中,30 min内带回实验室。将带回的15份羊背最长肌随机分成3组,每组5份,按照分组分别于0~4 ℃冷却96 h(常规冷却);(15±0.5) ℃先冷却8 h,然后在0~4 ℃条件下冷却至96 h(延迟冷却);(25±0.5) ℃冷却2 h,然后放置在0~4 ℃条件下继续冷却至96 h(高温冷却),分别于宰后2、8、16、24、48、72、96 h测定羊肉的品质指标,所有样品均要避光保存。
1.2.2 蒸煮损失率的测定 将肉块称重W1后,封口包装,在80 ℃水浴中加热至肉块中心温度达到75 ℃,保持20 min,0~4 ℃过夜,用滤纸吸干肉块表面汁液,称质量,记作W2;按公式计算蒸煮损失率。
蒸煮损失率(%)=(W1-W2)/W1×100
1.2.3 剪切力值的测定 用Warner-Bratzler法测定样品的剪切力值。样品水浴加热至中心温度75 ℃,保持20 min,0~4 ℃冰箱过夜。用直径1.27cm的中空取样器沿肌纤维方向取样(注意避开筋腱),测定剪切力值(n=6)。
1.2.4 肉色测定 取厚约1 cm,长宽各3 cm左右的长方体肉样,在空气中暴露30 min,用便携式色度仪测定L*(亮度)、a*(红度)、b*(黄度)值。
1.2.5 菌落总数测定 依照国标GB 4789.2-2016食品微生物菌落总数的测定方法测定。
1.2.6 肌原纤维蛋白氧化指标的测定 肌原纤维蛋白的提取:参考潘君慧[10]的方法提取,并用提取液将蛋白浓度稀释为2 mg/mL,稀释后的蛋白溶液用以羰基含量和巯基含量的测定。
羰基含量的测定:参考Levine等[11]方法并略作修改。取0.1 mL 稀释后的蛋白溶液,然后加入0.5 mL 2 mol/L HCl溶液(含10 mmol/L 2,4-二硝基苯肼),空白样品中加入0.5 mL 2 mol/L HCl溶液。溶液混匀于室温下静置40 min后,再加入0.5 mL 20%的三氯乙酸混匀,于11000×g,4 ℃条件下离心5 min,弃去上清液,沉淀用乙醇-乙酸乙酯溶液(体积比为1∶1)洗涤3次后,再将沉淀悬浮于1 mL 6 mol/L盐酸胍溶液中,在37 ℃水浴中保温30 min 后,于370 nm波长下测定吸光值,蛋白羰基含量(nmol/mg)使用摩尔吸光系数22000 L/(mol·cm)计算。
巯基含量的测定:参考李银等[12]方法并稍作修改。取1 mL稀释后的蛋白溶液,加入1 mL 50 mmol/L Tris-HCl缓冲液(pH8.3)(含6 mol/L盐酸胍、1 mmol/L EDTA)及10 μL 100 mmol/L Tris-HCl溶液(pH7.6)(含10 mmol/L DTNB),将上述溶液混匀后室温下静置25 min,于 412 nm波长下测定吸光值,巯基含量(nmol/mg)使用摩尔吸光系数13600 L/(mol·cm)计算。
1.3 数据处理
采用SPSS 20.0软件进行数据分析,测定结果以平均值±标准差表示。实验数据采用ANOVA进行邓肯氏(Duncan’s)差异分析,以P<0.05为差异显著。
2 结果与分析
2.1 不同冷却方式对羊肉蒸煮损失率的影响
如图1所示,各组处理的羊肉蒸煮损失率随宰后时间的延长呈先上升后下降的趋势,这说明通过羊肉的成熟,保水性均得到改善。宰后2和96 h,延迟冷却和高温冷却处理的羊肉蒸煮损失率均与常规冷却处理无显著差异(P>0.05),但产生的原因有所不同,宰后2 h羊肉均处于僵直前期,各处理的保水性相差不大。但宰后96 h,各处理的羊肉处于成熟后期,内源酶释放并消耗殆尽,肌原纤维蛋白快速降解,羊肉的保水性也趋于稳定;宰后8 h,延迟冷却和高温冷却处理的羊肉蒸煮损失率显著高于常规冷却组(P<0.05),至宰后16 h,两处理组的羊肉蒸煮损失率却显著低于常规冷却组(P<0.05),这可能是延迟冷却和高温冷却处理较高的温度使羊肉先于常规冷却处理进入尸僵造成的;宰后24、48、72 h,延迟冷却和高温冷却羊肉蒸煮损失率显著高于常规冷却组(P<0.05),这可能由于较高的温度引起了蛋白变性程度加大而导致羊肉失水率增加,说明延迟冷却和高温冷却显著增加了羊肉的蒸煮损失率,这与王玉宁等[13]的研究结果一致,而刘腾等[14]研究却认为延迟冷却对牛肉的蒸煮损失没有影响,与本研究相矛盾,可能原因是延迟冷却温度、冷却时间以及冷却速率等不同所引起的。
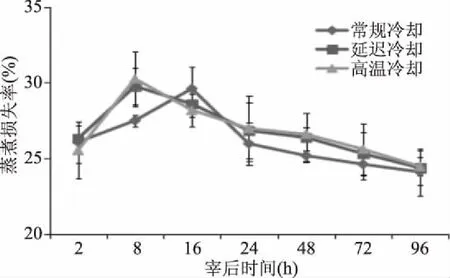
图1 不同冷却方式对羊肉蒸煮损失率的影响Fig.1 Effects of different cooling methods on cooking loss of mutton
2.2 不同冷却方式对羊肉嫩度的影响
图2所示,随着宰后时间的延长,各处理组的羊肉剪切力值呈现先上升后下降的趋势,这说明羊肉的成熟显著改善了嫩度。延迟冷却和高温冷却处理的羊肉剪切力最大值出现在宰后8 h左右,而常规冷却组的最大剪切力值延后至宰后16 h,这说明延迟冷却和高温冷却加速了羊肉进入尸僵期,随后进入了成熟过程;宰后16、24、48和72 h,延迟冷却和高温冷却处理组羊肉的剪切力值显著低于常规冷却组(P<0.05),这说明延迟冷却和高温冷却处理加快了羊肉的成熟过程,缩短了羊肉的成熟时间,明显提高了羊肉嫩度;宰后96 h,三组处理之间剪切力值差异不显著(P>0.05),嫩度趋于稳定,可能成熟处于末期。

图2 不同冷却方式对羊肉剪切力值的影响Fig.2 Effects of different cooling methods on shearing force of mutton
2.3 不同冷却方式对羊肉肉色的影响
肉色是评价羊肉品质的重要指标之一,它主要由肌肉中的肌红蛋白含量决定的。如图3所示,随着宰后成熟时间的延长,羊肉的L*值随之增大,这表明肉样因汁液渗出导致表面含水率增高,对光的反射作用增强[15]。高温冷却和延迟冷却处理的羊肉L*值显著高于常规冷却处理(P<0.05),这可能是宰后羊肉进入僵直前在较高温度下进行冷却,蛋白质发生部分变性对羊肉颜色有一定改善作用;随宰后时间的延长,a*值均呈现先升高后降低的趋势,在宰后48 h达到最大值。这说明宰后初期,肌红蛋白与空气中的氧气结合,形成了鲜红色的氧合肌红蛋白,a*值升高;随着宰后时间的延长,氧合肌红蛋白被进一步氧化成褐色的高铁肌红蛋白,a*值降低[16];宰后48 h内,高温冷却、延迟冷却与常规冷却处理之间羊肉的a*值差异显著(P<0.05),且温度越高,a*值越大。这可能是由于较高的温度导致氧气消耗速率降低或者增加了高铁肌红蛋白还原酶的活性[17]。随着进一步的成熟,各处理的羊肉a*值趋于一致(P>0.05);不同冷却方式对宰后羊肉的b*值影响不显著(P>0.05),随宰后时间的不断延长,羊肉的b*值先增加后减小,这与Aalhus[18]的研究结果一致。
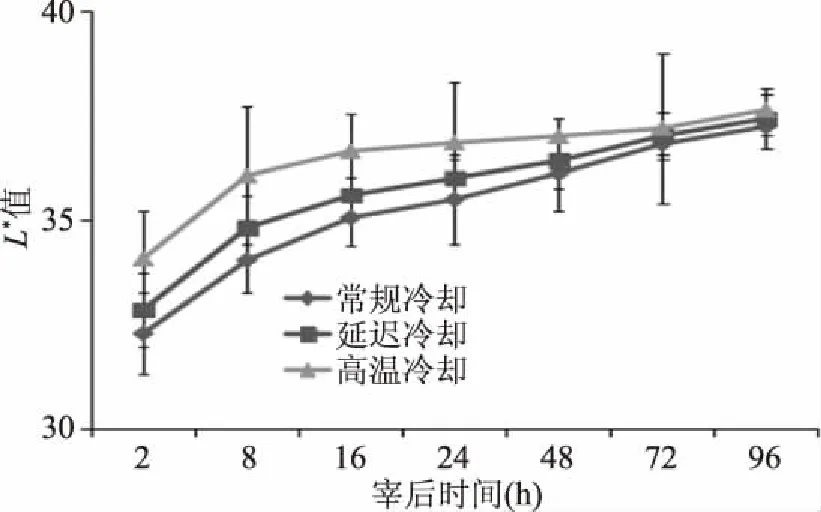
图3 不同冷却方式对羊肉L*值的影响Fig.3 Effects of different cooling methods on L* value of mutton

图4 不同冷却方式对羊肉a*值的影响Fig.4 Effects of different cooling methods on a* value of mutton
2.4 不同冷却方式对菌落总数的影响
如图6所示,宰后羊肉的初始菌落总数为4.1lg CFU/g。在宰后2 h,高温冷却的羊肉菌落生长较快,达到了5.1lg CFU/g,而延迟冷却仅为4.5lg CFU/g,对照组(0~4 ℃)生长速度最慢,为4.3lg CFU/g。宰后8~48h,三组的羊肉菌落总数生长速度趋缓,排列顺序为高温冷却>延迟冷却>对照组;宰后48~96 h,延迟冷却组和对照组生长速度没有明显变化。而高温冷却组羊肉菌落数有个加速增殖的过程,至96 h,菌落总数达6.3lg CFU/g,据报道当肉中菌落数达7~9lg CFU/g时,肉品开始腐败[19],这说明高温冷却处理的羊肉在宰后96h存在腐败的风险。
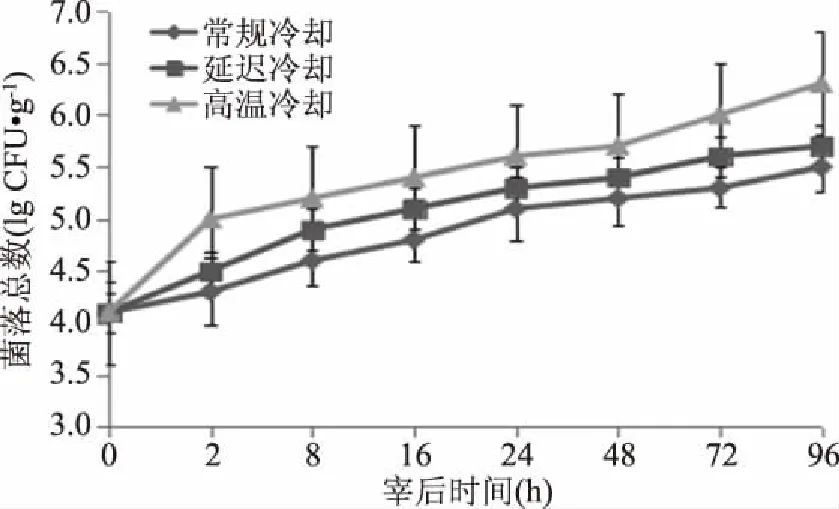
图6 不同冷却方式对羊肉菌落总数的影响Fig.6 Effects of different coolingmethods on the total number of bacterial colonies in mutton
2.5 不同冷却方式对羊肉肌原纤维蛋白氧化程度的影响
羊肉蛋白带有氨基基团的氨基酸侧链由于受到自由基的攻击断裂形成羰基,羰基含量越高蛋白氧化程度越大,它是蛋白氧化的重要指标。由图7显示,随着宰后时间的延长,各处理的羊肉肌原纤维蛋白羰基含量均呈增加的趋势;宰后2~24 h,三组处理的羊肉肌原纤维蛋白羰基含量差异显著(P<0.05),且温度越高,羰基含量越高,肌原纤维蛋白氧化程度越大;宰后48h,高温冷却处理组羰基含量显著高于对照组和延迟冷却组(P<0.05),而延迟冷却组与对照组之间差异不显著(P>0.05);至宰后72和96 h,三组处理的羰基含量趋于一致,无显著差异(P>0.05)。
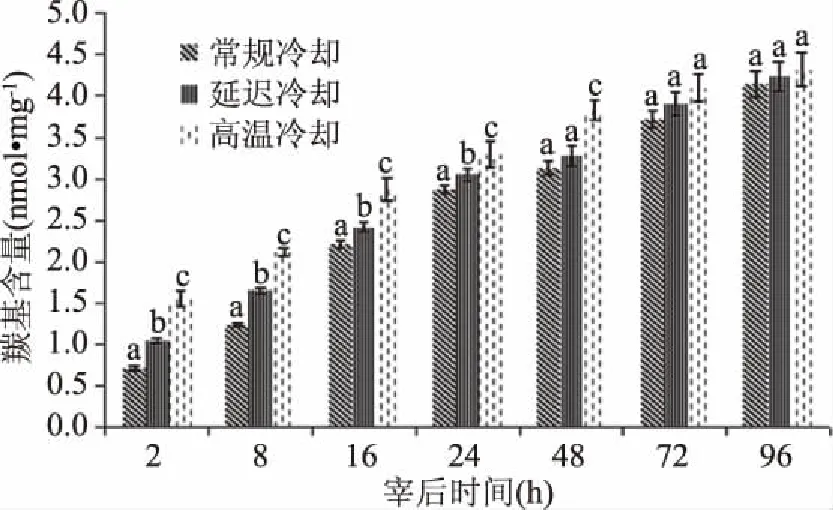
图7 不同冷却方式对羊肉肌原纤维蛋白羰基含量的影响Fig.7 Effect of different cooling methods on carbonyl content of mutton myofibrin注:不同冷却方式同一时间柱形图肩标小写字母不同表示差异显著(P<0.05),含相同小写字母表示差异不显著(P>0.05);图8同。
肌原纤维蛋白主要由肌球蛋白和肌动蛋白构成,这两种蛋白都还有大量的巯基,它是肌原纤维蛋白空间结构的稳定剂,因此通过分析巯基含量的变化可以反映出蛋白质的氧化程度。由图8可知,不同冷却方式处理的羊肉肌原纤维蛋白巯基含量随宰后时间的延长而逐渐减少,宰后2~48 h,三组处理的巯基含量差异显著(P<0.05),且温度越高,巯基含量越低。巯基含量的显著降低可能是由于蛋白质空间结构伸展,使得临近的-SH相互作用形成二硫键[20]。
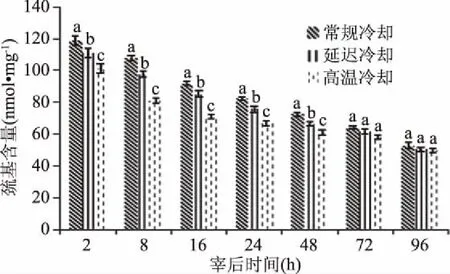
图8 不同冷却方式对羊肉肌原纤维蛋白巯基含量的影响Fig.8 Effect of different cooling methods on sulfhydryl content of mutton myofibrin
3 结论
延迟冷却和高温冷却明显降低了羊肉的剪切力值,提高了羊肉嫩度,有利于改善羊肉的色泽,但增加了羊肉的蒸煮损失率,对羊肉肌原纤维蛋白氧化有明显影响,尤其是高温冷却,而且考虑到高温冷却微生物腐败的风险因素,延迟冷却处理更适合宰后羊肉的冷却,建议将羊肉在(15±0.5) ℃先冷却8 h,再在0~4 ℃放置72 h,嫩度最佳,而常规冷却达到此嫩度却需96 h,延迟冷却大大缩短了羊肉的成熟时间。
