内源性蛋白酶对鱼糜凝胶的影响及其抑制方法研究进展
2020-05-05陈海强梁钻好周爱梅冯均元梁凤雪
陈海强,梁钻好,周爱梅,冯均元,梁凤雪,余 铭,*
(1.阳江职业技术学院,广东阳江 529566;2.华南农业大学食品学院,广东广州 510642;3.广东省食品低温加工工程技术研究中心,广东阳江 529566;4.广东浩洋速冻食品有限公司,广东阳江 529566)
鱼糜制品主要是采用白色鱼肉[1-2]经多次漂洗、脱水、擂溃成型,再煮制而成的高蛋白低脂肪水产食品[3]。衡量鱼糜蛋白的指标主要有保水性、粘着性、乳化性以及凝胶特性,其中最主要的是凝胶特性[4]。但长期以来,凝胶劣化现象一直是困扰鱼糜制造商的一大难题[4-5],使其无法满足消费者对高品质鱼糜制品的需求。肌原纤维蛋白,尤其是肌球蛋白重链(Myosin heavy chain,MHC)的降解被认为是凝胶劣化的主要原因,而肌原纤维蛋白的降解主要是由水产品的内源性蛋白酶引起的[6-8]。
与哺乳动物不同,水产动物体内含有丰富的内源性蛋白酶,且活性更高[9-11],其对蛋白水解进而影响鱼糜等其它产品的加工品质的作用[12]不容忽视。根据国内外大量研究显示,造成鱼糜制品凝胶劣化的内源性蛋白酶主要是钙蛋白酶[13]、组织蛋白酶[14-16]、肌原纤维结合型丝氨酸蛋白酶[17-20]。本文概述了这三大类内源性蛋白酶的性质及其对鱼糜凝胶特性的影响,并对抑制剂及其它加工方法进行讨论,为鱼糜生产提供理论指导。
1 钙蛋白酶
1.1 钙蛋白酶的性质
钙蛋白酶(Calpain)是一种依赖钙离子的蛋白酶,没有钙离子结合时以异二聚体的酶原方式存在,无蛋白分解能力,当与钙离子结合时酶原形式被激活,开始分解蛋白。根据所需钙离子浓度可分为μ-Calpain级和m-Calpain级[21]。钙蛋白酶是一种中性半胱氨酸内肽酶,pH6.5~7.5时会缩短鱼肉的货架期,加速鱼肌肉软化,影响鱼肉制品品质[12,22],最佳作用温度为6 ℃,即使2~4 ℃低温条件下仍保留一定的活性[12,23]。
1.2 钙蛋白酶对鱼糜凝胶特性的影响
钙蛋白酶对肌肉蛋白的早期降解起重要作用[24-25]。骨骼肌的钙蛋白酶存在于肌细胞内部,富集在Z带附近,其特点是可降解原肌球蛋白、肌钙蛋白、肌间线蛋白、肌联蛋白等,但不能降解α-肌动蛋白、α-辅肌动蛋白和肌球蛋白重链(MHC)[9]。由于不能水解MHC,Calpain并不直接参与鱼糜凝胶劣化,但它对鱼肉肌原纤维Z带的降解[26],尤其是鱼死后的最初的24 h[27],会增加肌原纤维蛋白对其它内源性蛋白酶的敏感度[22]。具体机理为:Calpain首先攻击肌原纤维的肌节(两个相邻Z带之间的一段肌原纤维)部位,释放肌丝降解为小片段,这些小片段极容易被溶酶体组织蛋白酶捕获并进一步降解[28]。另一方面,肌肉蛋白是鱼糜制品的天然的乳化器,鱼糜制品中95%的保水能力和75%~95%的乳化能力都是源于肌肉蛋白[9],其中又以肌球蛋白的乳化性最好,钙蛋白酶对肌球蛋白的降解必然会导致鱼糜制品的乳化性大大降低,进而影响保水性。再者,钙蛋白酶通过降解肌联蛋白降低鱼糜制品的弹性[26]。但有研究把纯化的钙蛋白酶添加到鲭鱼肌肉中并制成鱼糜,55 ℃、2 h后发现鱼糜破断力、抗变形能力和凝胶强度均没有明显改变[29]。那是因为,通常鱼肌肉中高活性钙蛋白酶往往伴随有钙蛋白酶抑制蛋白和其它钙蛋白酶抑制剂的存在,如鲈鱼肌肉中的钙蛋白酶抑制蛋白(Calpastatin)的活性是钙蛋白酶活性的17倍[30]。
2 组织蛋白酶
水产动物死后溶酶体会破裂并释放出一种蛋白酶系,称为组织蛋白酶,可分解肌肉蛋白,表现为水产动物的自溶现象。组织蛋白酶对肌球蛋白、肌钙蛋白、辅肌动蛋白、原肌球蛋白、肌联蛋白和肌动蛋白等鱼肉硬度相关的关键结构蛋白均具有不同程度的降解能力[31],其中影响鱼糜品质的主要是半胱氨酸组织蛋白酶(组织蛋白酶B、H、L)[32]和天冬氨酸组织蛋白酶D[31,33]。
2.1 半胱氨酸组织蛋白酶
2.1.1 半胱氨酸组织蛋白酶的性质 半胱氨酸组织蛋白酶最大的特点是分子活性中心含有半胱氨酸残基的活性巯基(-SH),主要包括组织蛋白酶B、组织蛋白酶H和组织蛋白酶L[34],其中组织蛋白酶B和L是引起鱼肉质构劣化的关键内源性蛋白酶,组织蛋白酶H在肉类中活性相对较弱,仅为组织蛋白酶B和L的1%[30]。组织蛋白酶B最佳作用pH为6.0,组织蛋白酶L的最佳作用pH为5.0,均为中性或弱酸性条件[12],接近鱼糜凝胶形成pH(pH为6.0~8.0),但最佳作用温度略有差异,组织蛋白酶B为35 ℃[35],组织蛋白酶L为50~60 ℃[36-38]。鱼糜从凝胶形成(40~50 ℃)到升温定型(90 ℃)时正好要经过组织蛋白酶最佳温度段50~60 ℃,容易造成鱼糜凝胶劣化,这也是组织蛋白酶L比组织蛋白酶B对鱼糜凝胶劣化影响更大的原因之一。
2.1.2 半胱氨酸组织蛋白酶对鱼糜凝胶特性的影响 组织蛋白酶B、H、L普遍存在于海水鱼和淡水鱼的肌动球蛋白中[39],其中组织蛋白酶L的活性最高,而且红肉鱼中的组织蛋白酶L活性总体上比白肉鱼高[15],这也是目前鱼糜制品原料通常为白肉鱼的主要原因之一。组织蛋白酶通过对鱼肌肉MHC和其他肌肉纤维蛋白进行不同程度的降解,破坏鱼糜凝胶三维网络结构,从而削弱鱼糜破断力、抗变形能力、凝胶强度、持水力等多项鱼糜凝胶特性,而且与组织蛋白酶B、H相比,组织蛋白酶L在鱼糜凝胶劣化中发挥着更为重要的作用。免疫印迹法证明,鱼肉MHC和辅肌动球蛋白极容易被组织蛋白酶降解成低分子蛋白,原肌球蛋白和肌动蛋白对组织蛋白酶L极敏感,肌间线蛋白也可被组织蛋白酶B、L降解[31]。添加了组织蛋白酶B、L的银鲤鱼鱼糜凝胶会产生大量气孔,质地松散,鱼糜破断力、抗变形能力和凝胶强度均显著下降[35],结合凝胶电泳图证实了组织蛋白酶可降解肌球蛋白和肌动蛋白[40],使蛋白分子量变小,空间结构松散,形成的鱼糜凝胶三维网络结构不紧致,从而削弱鱼糜的持水能力,是造成凝胶劣化的主要酶系之一。组织蛋白L对MHC的降解,在太平洋牙鳕鱼鱼糜[14]、蓝圆鲹鱼糜[18]、狭鳕鱼鱼糜[41]等多种鱼糜制品中已得到证实。
2.1.3 抑制由半胱氨酸组织蛋白酶引起的鱼糜凝胶劣化的方法
2.1.3.1 添加半胱氨酸蛋白酶抑制剂 由于半胱氨酸组织蛋白酶的分子活性中心为半胱氨酸,因此生产上可通过添加半胱氨酸蛋白酶抑制剂抑制这类蛋白酶活性,可有效阻止其对MHC的降解而引起的鱼糜凝胶劣化。E-64是一种典型的半胱氨酸蛋白酶抑制剂,通过与活性半胱氨酸的巯基形成硫醚键来起作用,能迅速抑制组织蛋白酶B、H、L的活性,而对丝氨酸蛋白酶和金属蛋白酶没有影响[42]。而亮抑酶肽是一种较为熟知的既可以抑制半胱氨酸蛋白酶,又可以抑制丝氨酸蛋白酶的可逆性抑制剂[5]。抗痛素(Antipain),又名抗痛素二盐酸盐,也能抑制多种半胱氨酸蛋白酶和丝氨酸蛋白酶,其抑制作用与亮抑酶肽相似。Hu等人[40]从肌动蛋白中提取出纯化的组织蛋白酶L并添加到红色黑鳍大眼鲷鱼糜中,在pH5.0和7.0条件下对MHC有显著的降解作用,2 h后MHC即被完全降解,肌动蛋白也被明显降解[43]。但添加E-64(0.1 g/kg 肌动球蛋白)后约1 h,只有pH5.0条件下的MHC有轻微降解,说明低浓度的E-64即可明显抑制MHC的降解。在鱼糕制作工艺的二段加热过程中发现,由于内源性蛋白酶对肌原纤维蛋白的降解,导致凝胶化强度较低,添加组织蛋白酶L后凝胶化强度会进一步下跌,主要原因是MHC几乎完全被降解,但E-64和亮抑酶肽可有效抑制MHC的降解,使凝胶化强度均有大幅提升,TCA可溶性肽含量也有一定的降幅,说明两种抑制剂均能明显抑制鱼糜凝胶劣化,但亮抑酶肽对组织蛋白酶L的抑制效果比E-64好[40]。从大部分研究报道来看,E-64、亮抑酶肽(Leupeptin)和抗痛素是三种常用的半胱氨酸蛋白酶抑制剂,可有效抑制由组织蛋白酶B、H、L引起的鱼糜凝胶劣化,其抑制效果大小顺序为:亮抑酶肽>抗痛素>E-64,同时使用两种抑制剂可起到增效作用[33,40]。
2.1.3.2 多次漂洗 溶酶体及其释放的组织蛋白酶存在于肌浆中,因此鱼糜制作过程中可通过多次清水或碱水漂洗除去绝大部分可溶性溶酶体组织蛋白酶[17]。大量研究表明,多次漂洗可大大降低鱼糜中的组织蛋白酶B、H活性,使凝胶特性得到改善。但并不能完全抑制凝胶劣化,因为漂洗不能除去组织蛋白酶L[14-15],而且漂洗次数应控制在2~3次,否则会导致蛋白质损失增大,而且鱼肉亲水膨胀而不容易脱水。如银鲤鱼[16]和太平洋鳕鱼[44]经3次循环漂洗后,组织蛋白酶B几乎丧失活性,而组织蛋白酶L仍然保留有相对较高的活性,表明多次重复漂洗可除去绝大部分组织蛋白酶B。由此可推断,与组织蛋白酶B相比,组织蛋白酶L与肌原纤维蛋白结合的更加紧密,不容易洗脱,从而导致水洗后活性保留率相对较高[45]。
2.2 天冬氨酸组织蛋白酶D
2.2.1 天冬氨酸组织蛋白酶D的性质 组织蛋白酶D活性中心含有天冬氨酸残基[34],合成于细胞的粗糙型内质网并转移到溶酶体中。鱼体内的组织蛋白酶D在第90和105个氨基酸残基中缺乏β-发夹环,因此该酶都是单链多肽,分子量为36~40 kDa[46],属于酸性蛋白酶,在45 ℃[33]、pH2.5~3.7[46]条件下表现出最大活性。
2.2.2 组织蛋白酶D对鱼糜凝胶特性的影响 组织蛋白酶D普遍存在于鱼体内[39],是鱼肌肉蛋白降解的关键酶之一,可以水解MHC、肌球蛋白轻链、肌动蛋白、辅肌动蛋白、原肌球蛋白,但不能降解肌间线蛋白[31,33,47],组织蛋白酶D对鱼糜凝胶劣化的影响比组织蛋白酶B、H、L更大。Godiksen等人[48]通过SDS-PAGE电泳技术观察到组织蛋白酶D对17种鱼肉肌肉结构相关蛋白(不包括MHC)中的10种有影响,其中9种影响是不利于鱼肉质构的保持,比组织蛋白酶B、L(分别产生4种和2种不利于鱼肉质构的影响)更容易导致肌肉蛋白降解,从而导致鱼糜劣化。
2.2.3 抑制由天冬氨酸蛋白酶引起的鱼糜凝胶劣化的方法 由于组织蛋白酶D属于天冬氨酸蛋白酶,鱼糜制作过程中可通过添加天冬氨酸蛋白酶抑制剂抑制组织蛋白酶D对鱼MHC的降解,从而抑制鱼糜凝胶劣化。胃酶抑素A是公认的天冬氨酸蛋白酶抑制剂,在酸性条件(pH3.0,45 ℃)下对鱼糜凝胶的影响比任何一种半胱氨酸蛋白酶抑制剂都要好,可在很大程度上抑制MHC的降解,且同时添加胃酶抑素A和亮抑酶肽后MHC完全没有降解,这表明鱼糜中存在的酸性蛋白酶主要是组织蛋白酶D和半胱氨酸组织蛋白酶,其鱼糜TS比单独添加胃酶抑素A或任何一种半胱氨酸蛋白酶抑制剂都要高的多(高出27%~42%),而E-64+胃酶抑素A或抗痛素+胃酶抑素A均有类似效果[33],由此表明胃酶抑素A能有效抑制天冬氨酸组织蛋白酶D活性,提高鱼糜凝胶特性,配合半胱氨酸蛋白酶抑制剂,即可在极大程度上改善鱼糜凝胶特性。Klomklao等人[49]也发现胃酶抑素A对日本叉牙鱼内源性酸性蛋白酶的抑制率(89%)是最高的,相比之下,半胱氨酸蛋白酶抑制剂(E-64、N-乙基马来酰亚胺、碘乙酸)的抑制效果(<14%)显得相对较弱,再次证明了组织蛋白酶D对鱼糜凝胶劣化的影响比组织蛋白酶B、H、L更大。
3 肌原纤维结合型丝氨酸蛋白酶(MBSP)
3.1 MBSP的性质
鱼类的肌肉中普遍存在一种肌原纤维结合型丝氨酸蛋白酶(Myofibril-bound serine proteinase,MBSP),虽然含量少,但与肌肉中的肌原纤维蛋白紧密结合,且耐热性强。MBSP的最适温度和pH为50~55 ℃和7.0~8.0[50-52],这类酶的N-端氨基酸序列和酶特性均与胰蛋白酶非常相似[53],选择性裂解羧基端(P1位置)的精氨酸残基,在此基础上P2位置为脯氨酸残基的,专一性更强,对P1位置的赖氨酸残基也有轻微的水解作用,但不水解胰凝乳蛋白酶的专一性底物(Suc-Leu-Leu-Val-Tyr-MCA)[17,53,54],因此也称为胰蛋白酶样丝氨酸蛋白酶(Trypsin-like serine proteinase)[17]。MBSP是一种内切酶,其活性中心与其他丝氨酸蛋白酶一致,是由Ser195、His57、Asp102氨基酸残基构成[55],碱性(pH8.5~9.5)条件下容易被激活[49,54,56]。
3.2 MBSP对鱼糜凝胶特性的影响
MBSP是鱼糜制品在50~60 ℃条件下长时间加热而引起凝胶强度下降的主要原因[18-20,45]。该酶可有效降解肌原纤维中的MHC,对辅肌动蛋白、肌动蛋白和原肌球蛋白也具有不同程度的降解作用,从而导致凝胶强度下降。Cao等人[4]从鲤鱼中提取纯化得到MBSP,添加到鱼糜中,55、60 ℃时鱼糜凝胶强度比没有添加MBSP的分别下降了13%和16.7%。凝胶强度下降不大的原因可能是因为鱼肌肉中本身自带的MBSP对鱼糜凝胶已经有极大的破坏,在此基础上,外加的MBSP作用就显得不明显;另一个原因可能是与内源性MBSP相比,外加的MBSP处于非结合状态,与肌原纤维蛋白结合不紧密,从而影响酶的水解能力。通过蛋白免疫印迹法进一步证明了55~60 ℃时MBSP对MHC、肌动蛋白、辅肌动蛋白和原肌球蛋白均有不同程度的降解。欧洲鲫鱼体内也被鉴定出存在MBSP,50~60 ℃对MHC有明显的降解作用,长时间加热,原肌球蛋白也会被明显降解,而对其它肌原纤维蛋白(如辅肌动蛋白和肌动蛋白)的降解度较小[17]。也有人认为,MBSP对肌肉MHC和原肌球蛋白的降解较组织蛋白酶L更强,MBSP在120 min后可完全降解MHC,原肌球蛋白完全消失,而组织蛋白酶L处理300 min,MCH的残留率仍有约50%,而原肌球蛋白仅有轻微的降解[57]。
3.3 抑制由丝氨酸蛋白酶引起的鱼糜凝胶劣化的方法
丝氨酸蛋白酶抑制剂可与丝氨酸蛋白酶形成酶-抑制剂复合物,且结合紧密,导致水解后续反应速率降低,酶活性受到抑制[58],从而避免由MBSP引起的鱼糜凝胶劣化现象。表1列举了常用的丝氨酸蛋白酶抑制剂及其应用实例。半胱氨酸蛋白酶抑制剂E-64对由MBSP引起的MHC的降解也起到相对大的抑制作用,这种现象在鲫鱼[17]、鲤鱼肌肉[59]的丝氨酸蛋白酶中也有发现,这可能是因为丝氨酸蛋白活性中心附近存在有关键巯基团。另外,目前侧重研究的一些天然的抑制剂,如从鱿鱼卵巢中提取的丝氨酸蛋白酶抑制剂(SOSPI),对印度鲭鱼[60]和大眼鲷鱼[61]的鱼糜凝胶均具有良好的保护作用,可有效提高鱼糜的破断力。
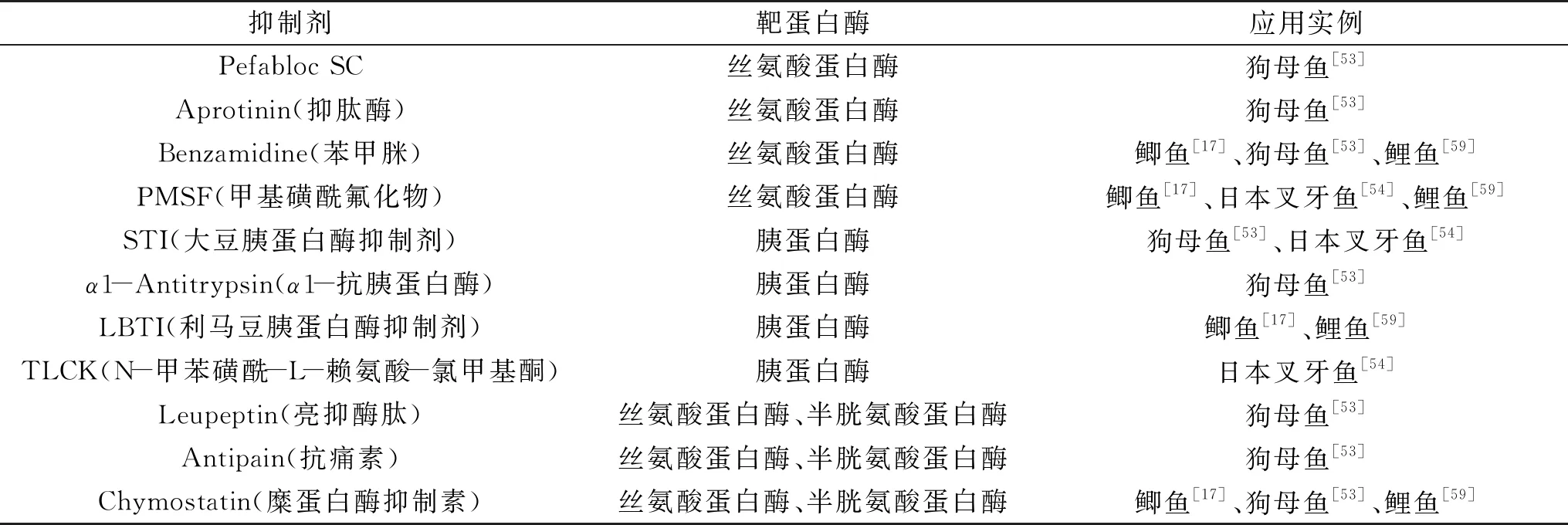
表1 常见丝氨酸蛋白酶抑制剂Table 1 Common serine protease inhibitors
4 其他改善鱼糜凝胶特性的方法
除了蛋白酶活性中心抑制剂外,一些蛋白质、脂类和多糖类等添加物也能起到很好的鱼糜凝胶特性改善作用。如水解小麦蛋白通过均匀分布在肌原纤维蛋白的网络结构中,避免高温条件下肌原纤维蛋白的相互聚合,从而抑制凝胶网络的破坏[62];加入纳米鱼骨激活内源性转谷氨酰胺酶催化交联网结构,进而影响持水力,提供鱼糜制品破断力[63];山茶油可能通过填充鱼糜蛋白基质空隙空间或通过提高疏水反应和增加β-折叠数量以坚固凝胶网络结构[64];脱乙基的魔芋葡甘聚糖能够保护鱼糜蛋白质二级结构和蛋白质组分在高温时不被破坏[65],支链淀粉在平滑蛋白质凝胶基质中分布均匀且填满具有小空隙的鱼糜凝胶[66],高溶胀能力的改性淀粉在高温下形成较高的粘度[67],这些多糖类通过多种方式和机理改善鱼糜凝胶特性。
随着新科技的发展,超高压技术[68-69]、超声波技术、辐照技术、微波加热等新技术陆续用于鱼糜加工,而且总体上对鱼糜凝胶特性有改善作用[70]。如超高压技术通过改变MBSP的蛋白构象,影响其活性部位[71];超声处理改变鱼糜肌原纤维蛋白二级结构变化,提高凝胶强度[70];辐照处理能够降低α-螺旋含量,提高β-折叠含量[72],有助于热诱导凝胶化过程鱼糜蛋白二硫键的形成[73];微波加热相比传统的加热方式,多糖链的网络结构会明显扩展,通过长链多糖的空间位阻效应阻止蛋白质的聚集,增强凝胶网络[74]。
5 总结与展望
鱼糜凝胶劣化现状一直困扰着生产企业。目前认为鱼糜凝胶劣化主要是由鱼肌肉中内源性蛋白酶引起的,包括钙蛋白酶、组织蛋白酶B、H、L、D和MBSP。由于钙蛋白酶往往伴随有钙蛋白酶抑制蛋白和其它钙蛋白酶抑制剂的存在,其对鱼糜凝胶劣化影响较小。组织蛋白酶是导致鱼糜劣化的主要内源性蛋白酶,包括半胱氨酸组织蛋白酶(组织蛋白酶B、H、L)和天冬氨酸组织蛋白酶D。在酸性条件下组织蛋白酶对鱼糜凝胶劣化的影响大致顺序为组织蛋白酶D>L>B、H,可添加半胱氨酸和天冬氨酸蛋白酶抑制剂加以抑制,此外,多次漂洗工序也可有效抑制肌浆结合型组织蛋白酶对鱼糜凝胶特性的影响。在碱性条件下以MBSP作用对鱼糜凝胶劣化影响较为显著,可考虑添加丝氨酸蛋白酶抑制剂。根据内源性蛋白酶的活性中心选择适当的抑制剂是控制鱼糜凝胶劣化的有效方法,此外,添加蛋白质、脂类和多糖等天然添加物以及新技术的应用逐渐成为改善鱼糜凝胶特性的重要手段。因此,添加内源性蛋白酶抑制剂配合其他鱼糜凝胶特性改善方法,可有效降低鱼糜凝胶劣化及提高鱼糜凝胶特性。
