不同配比红花籽、亚麻籽油对Ⅱ型糖尿病小鼠血糖的影响
2020-05-05赵圆圆杨晓君王秋平阿布杜萨拉木艾麦尔
赵圆圆,杨晓君,王秋平,冯 甜,张 圣,阿布杜萨拉木·艾麦尔
(新疆农业大学食品科学与药学学院,新疆乌鲁木齐 830052)
我国是世界上糖尿病患病人数最多的国家,其中Ⅱ型糖尿病占90%以上[1],2010年我国糖尿病标准化患病几率达到了11.6%,糖尿病患病人数已经达到了1.139亿人次,而糖尿病前期患病率则到了让人吃惊的50.1%的比率,其人数达到了 4.934亿人次,成为全球患糖尿病增长速度最快的国家之一[2]。近几十年来,随着人们生活水平的日益提高,高脂饮食的摄入过多,肥胖患者不断增加。遗传、环境、感染等诸多因素导致胰岛素抵抗,糖尿病的发生率逐年上升,且逐渐呈现年轻化的趋势[3]。糖尿病给社会医疗保障带来了沉重的压力,严重影响了患者的生活质量。
红花籽油,其富含亚油酸(ω-6脂肪酸),是已知植物食用油中含量最高的,平均含量78%左右[4]。现代研究表明,红花籽油具有软化心脑血管、促进血液循环、降血脂、降血压等作用[5-6],素有“血管清道夫”的美誉,是当之无愧的“亚油酸之王”。马琳[7]通过给SD大鼠连续灌胃红花籽油8周,得出红花籽油能显著升高大鼠血清中NO含量(P<0.01),并且能在一定程度上降低ET-1含量,但无统计学差异(P>0.05)。亚麻籽油,具有非常高的油活性,含有丰富的亚麻酸(ω-3脂肪酸),平均含量57%左右。亚麻酸是脂肪酸代谢中重要的调节因子,能够抑制脂肪合成,促进脂肪分解,具有降低血脂、保护心脑血管,对高血压、心脏病、糖尿病以及肥胖等有积极的防治作用[8-13]。
亚油酸(LA)和亚麻酸(ALA)分属不同系列的必需脂肪酸,在机体内不能互相转化[14-16],但在体内经同种酶代谢(脱氢酶和增碳酶),具有竞争性,竞争能力为ω-3>ω-6,即同一剂量的LA和ALA,ALA会产生更大的生物效应。因为LA(ω-6)和ALA(ω-3)在体内的竞争性,其机体摄入量和二者比例成为研究热点,严文波等[17]报导了人体必需脂肪酸摄入平衡的临床研究,若ω-6/ω-3比率为4∶1,就能使心血管疾病的病死率下降70%。齐珂珂等[18]探讨了不同比例LA和ALA对鸡原代干细胞增殖的影响,实验结果表明,LA/ALA比值为10时细胞增殖能力最强。因此确定LA和ALA最佳比例至关重要[19-21]。
本实验通过研究不同比例和剂量的红花籽、亚麻籽油对Ⅱ型糖尿病小鼠血糖的影响,进行糖耐量试验,并使用小鼠INS酶联免疫吸附测定试剂盒测定小鼠胰岛素水平。计算小鼠血糖(AUC)相对值、HOMA-β和HOMA-IR。以期探讨不同配比和剂量的红花籽、亚麻籽油对Ⅱ型糖尿病小鼠糖脂代谢的影响,为缓解Ⅱ型糖尿病的病症提供理论依据。为新疆红花籽油和亚麻籽油的精深加工及糖尿病人群功能性食品的开发与应用提供科学依据。
1 材料与方法
1.1 材料与仪器
SPF级KM种小鼠120只,雌雄各半,体质量18~22 g 购于新疆医科大学实验动物中心(动物生产许可证号:SCXK[新]2016-0003),正常饲养一周并观察无异常反应后进行试验;饲料为灭菌全价柱状饲料 由新疆医科大学实验动物中心提供;高脂高糖乳 实验室自制(10%胆固醇、20%猪油、2%胆酸钠和30%蔗糖);柠檬酸、柠檬酸钠、葡萄糖 分析纯,天津永晟精细化工有限公司;羧甲基纤维素钠 分析纯,天津市精细化工研究所;胆固醇 成都市科龙化工试剂厂;胆酸钠 国药集团化学试剂有限公司;蔗糖 天津市致远化学试剂有限公司;吐温-80 天津市福晨化学试剂厂;丙二醇 天津市大茂化学试剂厂;链脲佐菌素 生物技术级,上海麦克林生化科技有限公司;红花籽油 明亮的浅黄色油脂,亚油酸含量为78~83%,新疆红花缘科技有限公司;亚麻籽油 明亮的黄色油脂,新疆红果实生物制品有限公司;去离子水、亚麻籽油提取物 实验室自制,亚麻籽油提取物中α-亚麻酸含量为60.07%[22];小鼠胰岛素(INS)酶联免疫吸附测定试剂盒E-EL-M2614c Elabscience公司。
PHS-3C型pH计 上海雷磁仪器厂;FA2004N电子分析天平(d=0.1 mg)上海菁海仪器有限公司;三诺GA-3型血糖仪及血糖试纸 三诺生物传感股份有限公司;Neofuge 13R台式高速冷冻离心机 力康生物科技有限控股公司;Multiskan MK3全自动酶标仪 Thermo scientific公司;ICV-450电热恒温培养箱 日本ASONE公司;C2500-R-230V微型高速离心机 美国Labnet公司。
1.2 实验方法
1.2.1 溶液的配制 柠檬酸钠缓冲液的配制:称量柠檬酸2.10 g,用蒸馏水定容至100 mL容量瓶中,配制成A液;称量2.94 g柠檬酸三钠,用蒸馏水定容至100 mL容量瓶中,配制成 B液;按一定比例混合A∶B=1∶1.32混匀成C液,调整pH至 4.2~4.5间,于4 ℃冰箱保存24 h。
STZ的配制:注射之前将C液配制成1%(w/v)的STZ链脲佐菌素缓冲液,配制好的STZ溶液需按剂量在5 min 内注射完毕,现用现配,并时刻置于冰浴中备用。
高脂高糖乳的配制:取猪油20 g置于500 mL烧杯中,在电炉上加热融化,加入10 g胆固醇,融化,再加入2 g胆酸钠和30 g蔗糖,充分搅匀。然后放入20 mL吐温-80,20 mL丙二醇及30 mL蒸馏水,不断搅拌至溶解后,再加蒸馏水至100 mL,并充分混匀,即成高脂高糖乳剂。
1.2.2 小鼠的分组与Ⅱ型糖尿病小鼠模型的建立 将拟建模120只小鼠按体重随机分成2组,10只小鼠给予维持基础生长活动饲料量作为正常组,其余作为模型组,每7 d称量体重1次。模型组给予高脂高糖乳,剂量为10 mL/kg,28 d后,低剂量多次腹腔注射链脲佐菌素(STZ)溶液4 d,剂量为30 mg/kg,72 h后,正常组和模型组小鼠禁食后采尾静脉血,测其血糖,若空腹血糖值>11.1 mmol/L即Ⅱ型糖尿病模型造模成功[23]。再将模型组小鼠随机分为11组,每组10只,雌雄各半,组别为阳性对照组(二甲双胍组)、模型组、红花籽油分别以20%、40%、60%比例和80%、60%、40%亚麻籽油提取物组成的高、中、低三个剂量的复合油组,文中按A低、中、高剂量组,B低、中、高剂量组,C低、中、高剂量组表示。A为20%红花籽油与80%亚麻籽油提取物复合;B为40%红花籽油与60%亚麻籽油提取物复合;C为60%红花籽油与40%亚麻籽油提取物复合。灌胃过程中每组均给予等量正常饲料饲养,灌胃剂量依照世界卫生组织推荐的植物油摄入量进行设置,正常对照组给予相同剂量的生理盐水,阳性对照组按照体表面积法换算给药剂量,阳性对照组灌胃二甲双胍0.3 g/(kg·d),各比例复合油分别按0.18、0.36、0.54 g/(kg·d)的剂量灌胃小鼠,持续灌胃30 d。
1.2.3 不同比例受试物对Ⅱ型糖尿病小鼠体质量的影响 造模成功后每灌胃7 d,于固定时间记录小鼠的空腹体重,并计算平均体重。
1.2.4 不同比例受试物对Ⅱ型糖尿病小鼠糖耐量的影响 造模成功后每10 d对各组小鼠禁食不禁水12 h后,用采血针尾静脉采血测定空腹血糖,并给小鼠口服灌胃2 g/kg葡萄糖,分别测定0、30、60、90、120 min后的血糖值[24]。
1.2.5 不同比例受试物对Ⅱ型糖尿病小鼠胰岛素水平的影响 将持续灌胃给药30 d的各组小鼠禁食不禁水12 h后,眼眶取血1 mL置于2 mL离心管中,室温静置2 h,再于4 ℃冰箱静置4 h以上,4 ℃,3000 r/min(r=8 cm)离心 5~10 min,转移上层淡黄色血清[25],并用胰岛素酶联免疫分析试剂盒测定空腹血清胰岛素水平(FINS),计算胰岛β细胞功能指数(Homa beta cell function index,HOMA-β)和胰岛素抵抗指数(Homa insulin resistanceindex,HOMA-IR)。
1.2.6 指标的测定
1.2.6.1 空腹血糖 小鼠禁食不禁水,尾静脉取血,可利用血糖试纸和血糖仪检测。以mmol/L表示。
1.2.6.2 血糖曲线下面积 GAUC=(0.25×0 min血糖值+4×30 min血糖值3×120 min血糖值)
式中:GAUC为血糖曲线下面积[26]
1.2.6.3 胰岛素指数测定 胰岛素抵抗指数(HOMA-IR)=In[(胰岛素(FINS)×空腹血糖(FBG))/22.5]
胰岛β细胞功能指数(HOMA-β)=In[20×胰岛素(FINS)/(空腹血糖(FBG)-3.5)]
1.3 数据处理
2 结果与分析
2.1 Ⅱ型糖尿病小鼠模型建立
2.1.1 造Ⅱ型糖尿病小鼠模型期间小鼠体重分析 由表1可知,在造模前正常组与模型组体重基本一致,在造模期间,高血糖模型组小鼠均高于正常组小鼠体重,这可能是因为模型小鼠喂养的高脂高糖饲料使得体重增长幅度增大。正常组小鼠体重0~28 d均呈增长趋势,与正常组相比,高血糖模型组在造模0~21 d体重呈增长趋势,增长幅度大于同时间段的正常组小鼠,在21~28 d间体重略有下降,这可能是因为模型组出现了糖尿病中的“一少”表现即体重减轻。造模前,正常组与高血糖模型组小鼠体重无差异(P>0.05),造模28 d时,正常组与模型组小鼠体重差异极显著(P<0.01),且模型组体重出现下降,空腹血糖均值高于17.0 mmol/L,说明Ⅱ型糖尿病小鼠模型构建效果良好。且造模成功后小鼠的体征表现为进食进水量增大,排尿次数增多尿量多,垫料潮湿,体重减轻,毛色杂乱暗沉。

表1 造模阶段小鼠体重分析(g)Table 1 Analysis of mice body weight during modeling(g)
2.1.2 不同受试物对小鼠体重的影响 由表2可知,与正常对照组相比,模型组数据体重减轻明显,从第14 d开始体重极显著减轻(P<0.01)。阳性对照组及不同比例的受试物组体重均呈增长趋势,与模型组相比,B高、中、低剂量组体重均在第14 d开始出现极显著增长(P<0.01),其余组体重在第21 d开始出现极显著增长(P<0.01)。说明不同比例的受试物均可以缓解糖尿病中“三多一少”中的体重减轻,受试物组与阳性对照组差异不大,且40%红花籽油与60%亚麻籽油提取物复合油组(高、中、低剂量)缓解体重减轻症状的效果更明显。

表2 造模成功后灌胃给药期间小鼠体重变化(g)Table 2 Changes in body weight of mice during intragastric administration after successful modeling(g)
2.2 不同比例受试物对进食葡萄糖后血糖生成的影响
由表3可知,第10 d正常对照组与模型组相比,模型组血糖差极显著升高(P<0.01),说明模型组不能促进胰岛素的分泌;与模型组相比,阳性对照组,B低、高剂量组C中、高剂量组血糖应答曲线下面积显著减少(P<0.05),说明其能够促进葡萄糖在小鼠体内吸收从而促进胰岛素的分泌使血糖降低;B中剂量组血糖应答曲线下面积极显著减少(P<0.01),说明B中剂量组可以有效缓解小鼠餐后血糖浓度升高,有效促进胰岛素地分泌从而改善其调控血糖的能力,因此灌胃给药第10 d B中剂量组降血糖效果最为明显。从而也表明了LA和ALA是两种对人体健康非常重要的必需脂肪酸,摄入体内后可转变为EPA(Eicosapntemacnioc acid)和DHA(docosahexaenoic acid)而发挥降低血脂和血糖的作用[27],且摄入时间越长效果越明显。

表3 第10 d不同比例受试物对进食葡萄糖后血糖生成的影响Table 3 Effect of different proportions of test substances on blood glucose production after glucose consumption on the 10th day
由表4可知,第20 d正常对照组与模型组血糖差异极显著(P<0.01),与模型组相比,A低、高剂量组,B高剂量组,C低、高剂量组血糖应答曲线下面积减少,但不显著(P>0.05),说明其调控血糖能力相对较弱;阳性对照组、A中剂量组血糖应答曲线下面积显著减少(P<0.05),说明其能够促进胰岛素的分泌使血糖降低;B低、中剂量组,C中剂量组灌胃20 d后降血糖效果优于阳性对照组,血糖应答曲线下面积明显极显著减少(P<0.01),说明其均能够促进葡萄糖在小鼠体内吸收从而促进胰岛素的分泌使血糖降低,改善调控血糖的能力。因此灌胃给药第20 d B低、中剂量组,C中剂量组降血糖效果最明显。
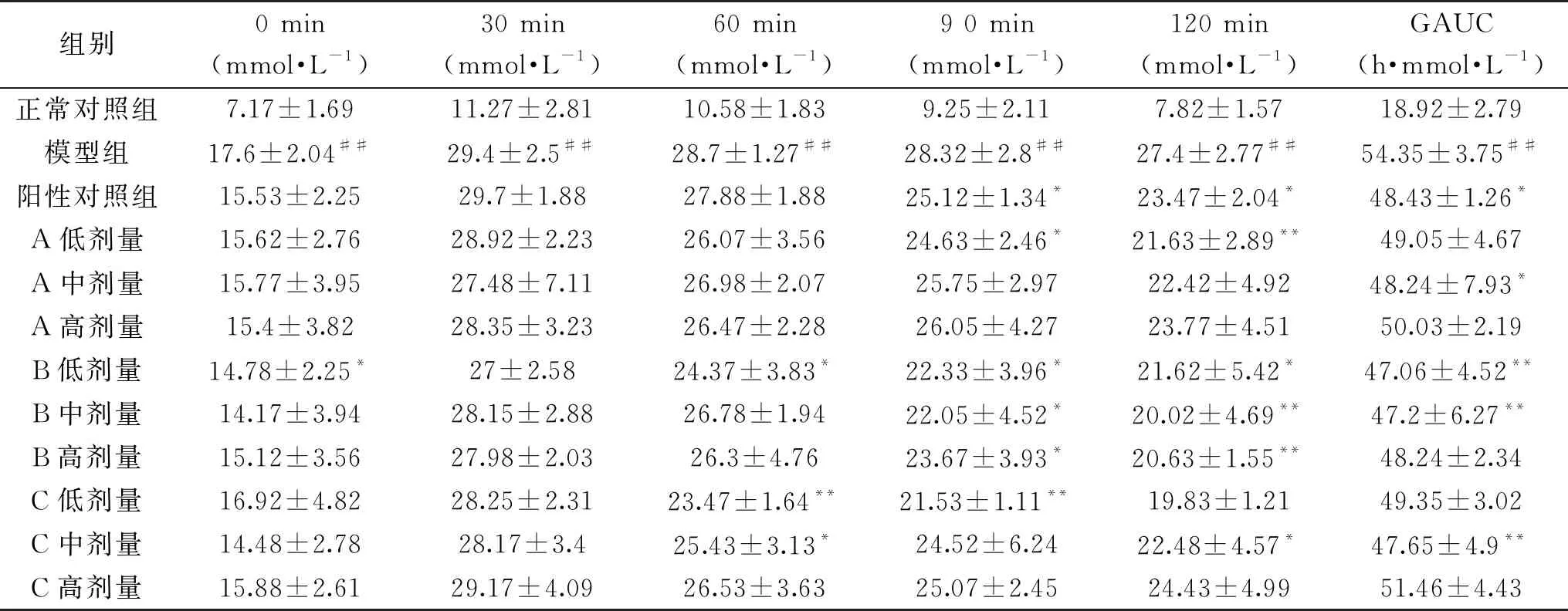
表4 第20 d不同比例受试物对进食葡萄糖后血糖生成的影响Table 4 Effect of different proportions of test substances on blood glucose production after glucose ingestion on the 20th day
由表5可知,第30 d正常对照组与模型组血糖差异极显著(P<0.01)。A低、高剂量组,B高剂量组,C低、中、高剂量组降糖效果弱于阳性对照组且血糖应答曲线下面积减少不显著(P>0.05)。阳性对照组血糖应答曲线下面积显著减少(P<0.05),说明灌胃给药二甲双胍30 d能促进胰岛素的分泌使小鼠血糖下降,A中剂量组,B低、中剂量组灌胃 30 d后降血糖效果优于阳性对照组,血糖应答曲线下面积明显极显著减少(P<0.01)其中B中剂量组第10、20、30 d血糖应答曲线下面积均极明显减少,因此得出灌胃给药30 d B中剂量组缓解小鼠餐后血糖浓度升高及改善调控血糖的能力最明显。

表5 第30 d不同比例受试物对进食葡萄糖后血糖生成的影响Table 5 Effect of different proportions of test substances on blood glucose production after glucose ingestion on the 30th day
2.3 不同比例受试物对Ⅱ型糖尿病小鼠胰岛素敏感性的影响
由表6可看出,模型组血清胰岛素含量与正常对照组相比,显著升高(P<0.05)。阳性对照组与不同比例的受试物组与模型组相比,阳性对照组、B低、中、高剂量组及C高剂量组血清胰岛素水平降低显著(P<0.05)。受试物组中B中剂量组血清胰岛素水平降低更明显,说明灌胃给予0.36 g/kg剂量的40%红花籽油和60%亚麻籽油提取物复合降糖效果最好。

表6 不同受试物对小鼠胰岛素敏感性的影响Table 6 Effect of different test substances on insulin sensitivity in mice
模型组胰岛β细胞能力与正常对照组相比,差异显著(P<0.05),模型组胰岛β细胞功能指数仅为1.29,说明该模型组小鼠胰岛β细胞能力受损。与模型组相比,阳性对照组,A中高剂量组与B中剂量组胰岛β细胞功能指数极显著增强(P<0.01),B低剂量组与C低剂量组胰岛β细胞功能指数显著增强(P<0.05),说明该比例和剂量下能使胰岛β细胞分泌能力增强,缓解糖尿病,同时也说明了红花籽油、亚麻籽油缓解糖尿病病症效果良好。
正常对照组与模型组胰岛素抵抗指数差异极显著(P<0.01)。与模型组相比,阳性对照组、A中剂量组与B中剂量组胰岛素抵抗指数下降极显著(P<0.01),B低、高剂量组胰岛素抵抗指数下降显著(P<0.05)。阳性对照组、A中剂量组与B中剂量组分别比模型组胰岛素抵抗指数下降57.14%、57.14%与66.67%。A中剂量组与阳性对照组对胰岛素抵抗降低效果相同,B中剂量组对胰岛素抵抗改善效果最佳。综合来看B中剂量组能有效改善胰岛素抵抗,使胰岛β细胞分泌能力增强,更能有效的缓解Ⅱ型糖尿病病症。
3 讨论与结论
不同配比红花籽、亚麻籽油均可使Ⅱ型糖尿病小鼠血糖得到降低,B中剂量组降低糖尿病小鼠餐后血糖效果最明显,改善调控血糖的能力最佳,并且B中剂量组血清胰岛素分泌水平高,改善葡萄糖耐受,胰岛β细胞功能指数增强,胰岛素抵抗指数降低,可得出B中剂量组(即40%红花籽油、60%亚麻籽油提取物中剂量组)能够提高其胰岛素的分泌及靶细胞对胰岛素的敏感性,降糖效果最佳。
本实验主要筛选对Ⅱ型糖尿病模型小鼠血糖干预作用最佳的红花籽、亚麻籽油的比例及剂量,后续将从机制出发,深入探讨红花籽亚麻籽复合油对Ⅱ型糖尿病大鼠血糖干预作用的信号通路,基于该信号通道分析对糖尿病产生直接原因的主要靶器官及并发症相应部位的影响,也为红花籽亚麻籽复合油的降血糖机制研究提供一定的思路及指导。
