磁性阴离子吸附剂的制备及其去除水中Ni2+离子的研究*
2020-04-30李嘉伟谷修成陈洪龄
李嘉伟,谷修成,陈洪龄
(南京工业大学 a.2011学院;b.化工学院,江苏 南京 211816)
近年来,工业废水的排放量迅速增加,其中的金属离子作为工业废水中的主要污染物之一,对环境和人类健康有很大危害[1],尤其在冶金、电镀等行业。本课题旨在利用磁性阴离子吸附剂除去废水溶液中的金属离子,并寻求在实际工业生产中高效、易行、可重复操作的方法。
常用于处理污水中金属离子的方法有物理处理法、化学处理法和生物处理法。化学处理法中的吸附法是利用吸附剂较大的比表面积、孔洞结构或特殊功能基团经物理或化学吸附,去除废水中重金属的方法[2]。吸附剂吸附性强,适合处理浓度低、水量大的废水,经济成本低、处理效率高、操作简单。近年来随着功能化磁性纳米材料的出现,如Fe3O4的核/壳结构纳米颗粒吸附材料,因其无毒、低成本、表面积大、表面电性可调节和独特的超顺磁性,能够在外加磁场的作用下实现与母液快速分离的效果,可以弥补传统吸附剂难以与母液分离的缺陷[3,4]。本文制备了具有核/壳结构的磁性纳米材料Fe3O4@SiO2,用马来酸酐和均苯四甲酸酐分别进行接枝改性,考察了对金属离子的吸附作用。
1 实验部分
1.1 试剂与仪器
FeCl3·6H2O 和 N,N-二甲基甲酰胺(C3H7NO),(国药集团化学试剂有限公司);FeCl2·4H2O(上海麦克林生化科技有限公司);NiSO4·6H2O(广东西陇化工厂);均苯四甲酸酐(C12H2O6)(阿拉丁化学试剂有限公司);顺丁烯二酸酐(C4H2O3),丙酮和无水乙醇,(上海凌峰化学试剂有限公司)。以上试剂均系化学纯。
WQF-510A傅立叶变换红外光谱仪、UV-1801紫外可见分光分度计,北京瑞利分析仪器有限公司;DYG 60H热重分析仪(日本岛津公司);S-4800扫描电镜(日本日立公司);QM-3SP04行星式球磨机(南京大学仪器厂)。
1.2 磁性纳米吸附剂的制备
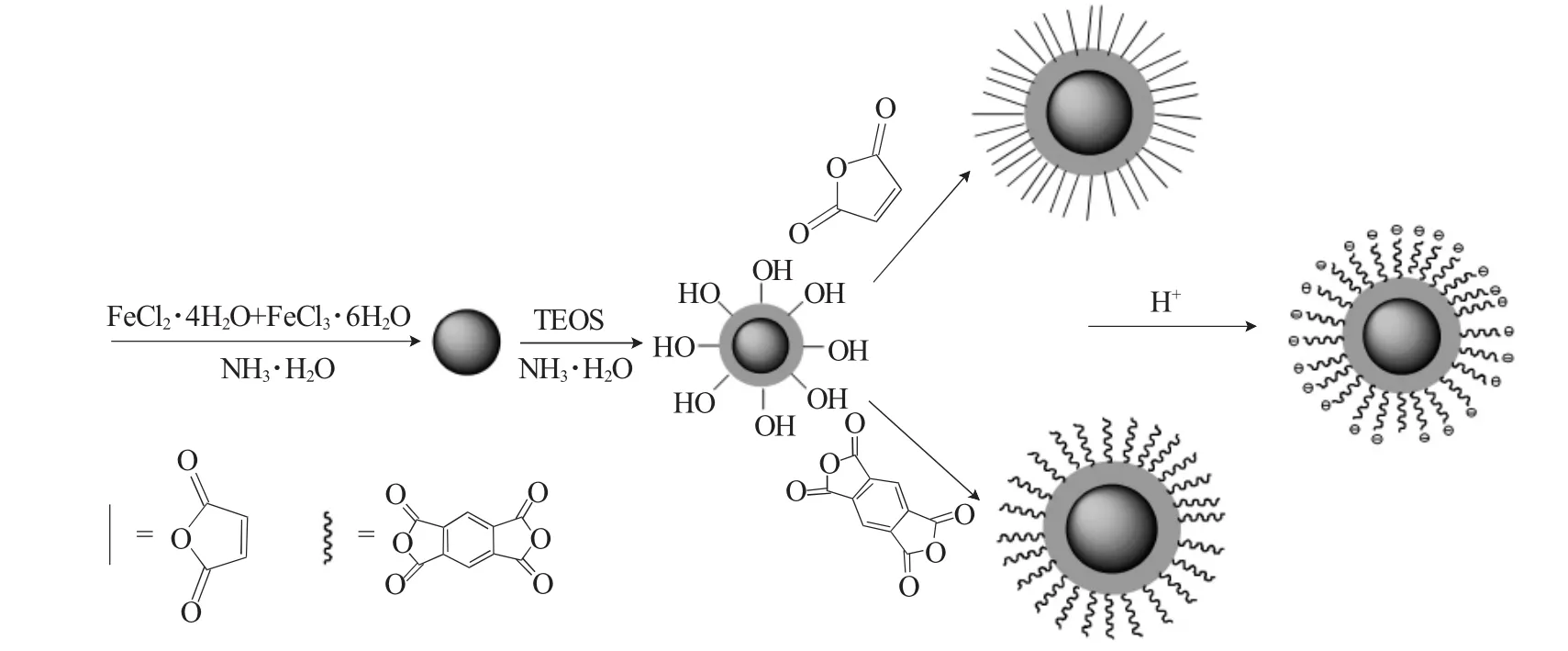
图1 核/壳磁性纳米粒子Fe3O4@SiO2@M和Fe3O4@SiO2@P的制备过程Fig.1 Preparation of core/shell magnetic nanoparticles Fe3O4@SiO2@M and Fe3O4@SiO2@P
1.2.1 纳米粒子Fe3O4的制备 将7.3g FeCl3·6H2O和2.7g FeCl2·4H2O分别溶解在120mL的去离子水中[2]。在超声条件下,向混合溶液中滴加到12mL NH3·H2O溶液,60℃下反应2h。用磁铁分离黑色胶状颗粒,水洗至中性,真空干燥后研磨保存[5,6]。
1.2.2 纳米粒子Fe3O4@SiO2的制备 向烧瓶中加入约含0.90g纳米Fe3O4颗粒,加入16mL超纯水,再先后加入10mL NH3·H2O和4mL正硅酸四乙酯,室温下搅拌24h。水洗至中性后真空干燥,得到的灰色固体即为SiO2包裹Fe3O4的纳米粒子Fe3O4@SiO2。
1.2.3 Fe3O4@SiO2颗粒的阴离子化表面修饰 取0.2g纳米粒子Fe3O4@SiO2和8g马来酸酐加入5mL的丙酮作为溶剂,滴加5μL的N,N-二甲基甲酰胺作为催化剂,运用球磨机反应,球磨机转速调为400r·min-1,反应进行2h。反应结束,采用乙醇洗涤后再用去离子水洗涤3~4次,然后放入烘箱干燥24h后取出研磨得到产品,标记为Fe3O4@SiO2@M。
取0.2g纳米粒子Fe3O4@SiO2和8g均苯四甲酸酐加入5mL的丙酮作为溶剂,滴加5μL的N,N-二甲基甲酰胺作为催化剂,运用球磨机反应,球磨机转速调为400r·min-1,反应进行2h。反应结束后采用乙醇洗涤后再用去离子水洗涤3~4次,然后放入烘箱干燥24h后取出研磨得到产品,标记为Fe3O4@SiO2@P。
1.2.4 吸附金属离子Ni2+配制不同浓度的Ni2+,采用紫外分光光度法测取Ni2+的吸光度,绘制出Ni2+浓度与吸光度标准曲线,得到标准工作方程。将0.015g修饰后的磁性阴离子吸附剂Fe3O4@SiO2@M、Fe3O4@SiO2@P分别加入到5mL、不同Ni2+浓度的溶液中,震荡1h后,用磁铁分离出磁性吸附剂,并取上层清液,用紫外分光度计进行检测,对照标准工作曲线读出吸附前后金属离子的浓度,并利用离子去除率计算式,计算磁性阴离子吸附剂的去除效率。

图2 磁性阴离子吸附剂吸附前、吸附中及分离效果图Fig.2 Diagram of magnetic anion adsorbent before adsorption,adsorption and separation
2 结果与讨论
2.1 吸附剂的表征
2.1.1 热重分析
马来酸酐和均苯四甲酸酐修饰后的磁性纳米粒子及其前驱体的热重分析见图3。
从图3可以看出,第一阶段是温度低于200℃的区域,失重约4%,这归因于Fe3O4@SiO2表面吸附水分的蒸发;第二阶段是200~600℃范围的持续失重,失重约3%。Fe3O4@SiO2@M表面连接的有机基团马来酸酐在200℃之后逐步分解,因而其失重大于Fe3O4@SiO2,也证明了马来酸酐基团成功连接在了磁性纳米粒子的表面。从均苯四甲酸酐修饰后的磁性纳米粒子及其前驱体的热重分析图可见,在温度低于150℃时,主要是水分的失去,失重约为5%,因均苯四甲酸酐相对分子质量较大,羧基较多,故其热重曲线下降迅速,在200℃之后,均苯四甲酸酐持续快速失重,表明均苯四甲酸酐成功连接在了磁性纳米粒子的表面。

图3 磁性纳米粒子Fe3O4@SiO2@M、Fe3O4@SiO2@P及其前驱体热重图Fig.3 TG of magnetic nanoparticles Fe3O4@SiO2@M,Fe3O4@SiO2@P and their precursors
2.1.2 红外光谱和SEM分析
马来酸酐和均苯四甲酸酐修饰磁性纳米粒子及其前驱体的红外光谱见图4。

图4 磁性纳米粒子Fe3O4@SiO2@M、Fe3O4@SiO2@P及其前驱体红外图Fig.4 FTIRof magnetic nanoparticles Fe3O4@SiO2@M,Fe3O4@SiO2@P and their precursors
样品在590cm-1附近都有吸收,这是Fe3O4的特征吸收峰,对应于Fe-O的伸缩振动;3450和1700cm-1处的吸收为Si-OH的伸缩振动和表面吸附水分子H-O-H的弯曲振动。接枝后的Fe3O4@SiO2@M在2390cm-1处的吸收为C=O的吸收峰,表明马来酸酐成功地接枝在了Fe3O4@SiO2磁性纳米粒子表面上,与此同时,1600cm-1左右苯环骨架的吸收峰也表明均苯四甲酸酐成功地接枝在了Fe3O4@SiO2磁性纳米粒子表面上。

图5 Fe3O4电镜照片Fig.5 SEMimagine of Fe3O4

图6 Fe3O4@SiO2电镜照片Fig.6 SEMimagine of Fe3O4@SiO2

图7 Fe3O4@SiO2@P电镜照片Fig.7 SEMimagine of Fe3O4@SiO2@P
从图5可以看出,单纯Fe3O4颗粒有一定的团聚,但当SiO2包裹形成Fe3O4@SiO2颗粒以后,团聚现象明显改善。可能是SiO2壳层有比较好的阻隔作用。当表面有机改性接枝有机酸以后,粉体状态没有明显变化。
2.2 吸附金属离子实验
2.2.1 Ni2+浓度与吸光度标准曲线的绘制 分别配制 0.5、1.0、2.0、3.0、4.0、5.0、6.0g·L-1等不同浓度 pH值为5的Ni2+标准溶液,采用紫外分光光度法测取Ni2+的吸光度。已知Ni2+在吸光度为400nm处存在最大吸收峰,根据不同浓度的Ni2+标准溶液在λm=400nm处的紫外吸光度数据,绘制出Ni2+浓度与吸光度标准曲线[7],并对标准曲线进行线性拟合,得到回归方程:y=0.1047x-0.0675

图8 Ni2+吸光度标准曲线Fig.8 Absorbance standard curve of Ni2+
2.2.2 磁性阴离子吸附剂去除效率计算 用紫外光度计测量加入磁性阴离子吸附剂前后的Ni2+的吸光度值,从Ni2+吸光度标准曲线图中读取阳离子初始质量浓度ρ0和吸附结束的平衡质量浓度ρe并代入离子去除率计算式[8]:

即可计算出磁性阴离子吸附剂的去除效率R。
2.3 金属离子底物浓度对吸附效率的影响
为了进一步探究修饰后的磁性阴离子吸附剂对Ni2+的吸附性能,我们控制Ni2+溶液pH值相同,将0.015g的修饰后的磁性阴离子吸附剂Fe3O4@SiO2@M、Fe3O4@SiO2@P分别加入到pH值为5、5mL不同Ni2+浓度的溶液中,同样采用紫外分光度法并结合标准工作曲线和去除率计算式,绘制出pH值为5条件下,金属离子底物浓度与两种吸附剂去除效率的关系曲线见图9。
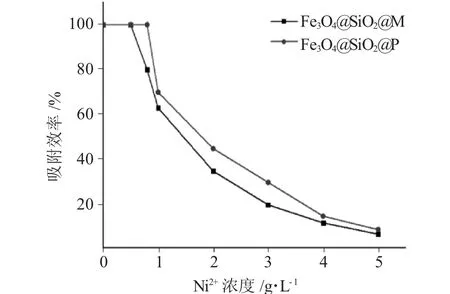
图9 Ni2+浓度与Fe3O4@SiO2@M与Fe3O4@SiO2@P去除效率曲线Fig.9 Removal efficiency curves of Ni2+concentration and Fe3O4@SiO2@M and Fe3O4@SiO2@P
从图9可以看出,均苯四甲酸酐修饰的吸附剂Fe3O4@SiO2@P的吸附性能总体优于马来酸酐修饰的吸附剂Fe3O4@SiO2@M,这应该和均苯四甲酸酐水解后产生更多的羧基有关。在浓度小于1.5g·L-1的Ni2+溶液中,两种吸附剂的去除效率均达50%以上。实验条件下,在浓度小于0.5g·L-1的Ni2+溶液中Fe3O4@SiO2@M吸附剂对Ni2+的去除效率达100%;而对于接枝均苯四甲酸酐的吸附剂Fe3O4@SiO2@P,在浓度小于0.8g·L-1的Ni2+溶液中,对Ni2+的去除效率达100%。当吸附剂用量一定时,随Ni2+浓度增加,去除效率逐渐下降,原因是吸附达到饱和,如果增加吸附剂用量,去除Ni2+的效率仍然可以提高。
3 结论
本文制备了具有核/壳结构的磁性纳米颗粒Fe3O4@SiO2,并分别用马来酸酐和均苯四甲酸酐进行接枝改性,得到Fe3O4@SiO2@M和Fe3O4@SiO2@P两种磁性阴离子吸附剂。均苯四甲酸酐改性的吸附剂Fe3O4@SiO2@P性能优于马来酸酐改性的吸附剂Fe3O4@SiO2@M性能。在浓度小于0.5g·L-1的Ni2+溶液中,两种吸附剂对的Ni2+去除效率均达100%。实验制备的两种磁性阴离子吸附剂在外加磁场条件下极易和母液分离,具有易分离、可重复性。本研究为工业废水中金属离子的吸附分离提供了新思路,具有可操作性,且绿色环保,简单易行。
