大孔树脂纯化杜仲多糖工艺及抗运动性疲劳研究
2020-04-30张涛涛
张涛涛
(三门峡职业技术学院,河南 三门峡 472000)
杜仲(Eucommia ulmoides)为杜仲科杜仲属药食两用植物,富含黄酮、多糖、槲皮素、杜仲胶和多种维生素[1,2],因其具有补益肝肾、强筋壮骨等功效,已被加工制成各类食品或药品使用[3]。近来有研究发现,其树皮中多糖具有抗氧化、降血糖和增强机体免疫功能等活性[4-6],特别是王一民等提取出该植物的树皮多糖,发现可较好改善运动性疲劳[7],然而该提取物中仍含有较多的鞣质、蛋白质等杂质,致使多糖含量偏低,可能影响产物的功效。
大孔树脂的吸附分离技术同时具有机械筛分与化学吸附的特点,选择性高,干扰因素少,且可重复循环利用,被广泛用于天然产物的活性成分分离与纯化[8,9],由于目前对于杜仲多糖提取物的纯化研究鲜有报道,因此,本研究在杜仲树皮的多糖提取研究基础上,探讨大孔树脂纯化其提取物的最佳工艺条件,同时考察不同产物的抗疲劳作用效果。
1 实验部分
1.1 材料与试剂
杜仲采购于河南禹州中药材市场,经鉴定为杜仲科植物杜仲的干燥树皮;葡萄糖(定量分析用,中国药品生物制品检定所);乙醇、丙酮、乙醚、苯酚、硫酸、氢氧化钠均为分析纯(国药集团化学试剂有限公司);试验用水为蒸馏水。
1.2 仪器与设备
721型紫外-可见分光光度计(上海仪电分析仪器有限公司);ME104型电子天平(梅特勒-托利多公司);DWT-B02型多功能粉碎机(河南耕晖机械设备有限公司);PR-2型旋转蒸发仪(普瑞科技有限公司);VFD-1000A型冷冻干燥箱(上海舜制仪器制造有限公司);ZWY-110X50型恒温振荡器(北京海天友诚科技有限公司);AB-8、D-101型大孔树脂(沧州宝恩吸附材料科技有限公司);NKA-9、HPD 600、DM 130型大孔树脂(天津西金纳环保材料科技有限公司)。
乳酸 (BLA)检测试剂盒、乳酸脱氢酶 (LDH)检测试剂(南京信帆生物有限公司)。
1.3 方法
1.3.1 提取物制备 杜仲树皮粉碎完全后,过40目筛,加入80%乙醇溶液浸泡后过滤,滤渣经80°C水回流 2 次(料液比:1∶15),每次 2h,合并滤液,减压浓缩,加入乙醇沉淀离心,即得杜仲多糖粗提物[10]。
1.3.2 树脂静态吸附考察 依照文献测定方法[11,12],准确称取5.0g经活化处理后的大孔树脂(D-101、DM-130、AB-8、NKA-9、HPD 600) 置于锥形瓶内,分别加入体积为50mL 5.1mg·mL-1提取液,静态吸附24h后过滤,所得饱和吸附后的树脂置于150 mL 70%乙醇内,静态洗脱24h,分别测得不同类型树脂对杜仲多糖的静态饱和吸附量、吸附率、洗脱率及回收率。
1.3.3 动态吸附与洗脱考察 根据预实验结果,以50mL无水乙醇为溶剂,分别考察提取液的浓度(0.2、0.4、0.6、0.8、1.0mg·mL-1)、pH 值(4.0、5.0、6.0、7.0、8.0)和流速(1.0、2.0、3.0、4.0、5.0mL·min-1)对树脂的吸附率影响;同时分别考察洗脱液乙醇的浓度(50、60、70、80、90%)、流速(0.5、1.0、2.0、3.0、4.0mL·min-1)及体积(100、120、140、160、180mL)对树脂的解吸率影响。
1.3.4 多糖定量分析 精密称取干燥恒重的葡萄糖对照品30mg,置于100mL容量瓶内,加水稀释至刻度后,分别精密移取 1、2、3、5、10mL 至 100mL 容量瓶中,另加入10mL 5%苯酚溶液和5.0mL浓硫酸后,以水定容至刻度线摇匀,置于40℃水浴加热15min后,冷却至室温,以水作空白,于480nm波长处测定吸光度值[13],绘制标准曲线方程:A=1.1325C+0.017(r=0.9986)。
精密移取样品溶液1mL,置于20mL容量瓶中,分别加入10mL浓硫酸与2.0mL 5%苯酚溶液后,以水定容至刻度线摇匀,测得样品吸光度值。
1.3.5 抗疲劳作用效果
1.3.5.1 试验设计 60只健康雄性小鼠,随机平均分为3组,分别标记为对照组、提取组和纯化组,其中对照组正常喂食,而提取组和纯化组的喂养饲料内分别掺入等量的提取物和纯化物,每天喂食2次,连续喂食30d[14]。
1.3.5.2 负重游泳时间 每组随机抽取10只,于鼠尾负重自身5%的重物,进行力竭性游泳试验,记录小鼠自入水开始游泳至沉没超过10s的时间[15]。
1.3.5.3 乳酸生化指标检测 动物游泳10min后,收集血清,利用试剂盒,分别测得不同组别小鼠血清中的乳酸浓度及乳酸脱氢酶活力[16]。
1.3.6 数据分析
利用SPSS 19.0对动物试验结果进行方差分析,检验水准α=0.05,当p<0.05表示具有显著性差异,p<0.01表示具有极显著性差异。
2 结果与讨论
2.1 树脂型号选择
表1为不同型号树脂的静态吸附与洗脱性能比较。
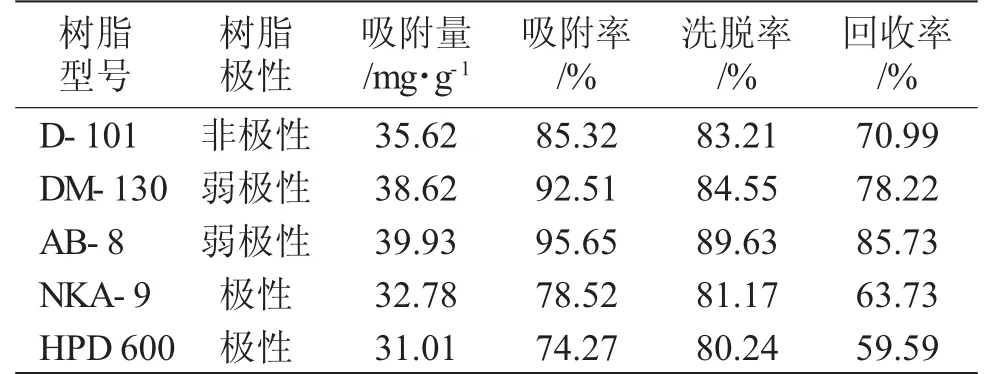
表1 不同树脂的静态吸附与洗脱性能比较Tab.1 Comparison of static adsorption and desorption performance of different type resins
从表1可知,弱极性树脂表现较好的吸附与洗脱性能,其中AB-8大孔树脂的回收率高于其它4类树脂,达到85.73%,因此,确定采用AB-8大孔树脂纯化杜仲多糖提取物。
2.2 动态吸附与洗脱条件考察
2.2.1 提取液浓度影响 分别考察不同杜仲多糖提取液的质量浓度对树脂的吸附率影响,结果见图1。
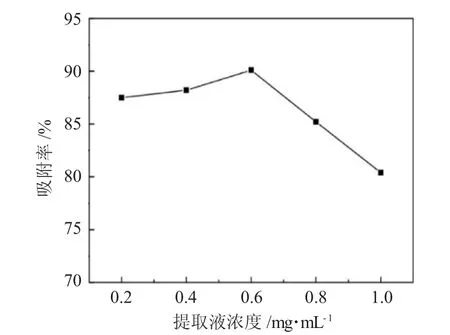
图1 提取液浓度对吸附率的影响Fig.1 Effect of extract solution concentration on adsorption rate
伴随提取液浓度的增大,树脂的吸附率先增高后降低,当浓度为0.6mg·mL-1时,吸附率达到最大,因此选择 0.5、0.6、0.7mg·mL-1作为正交试验中提取液浓度的考察水平。
2.2.2 上柱液pH值影响 不同提取液pH值对吸附率的影响,见图2。
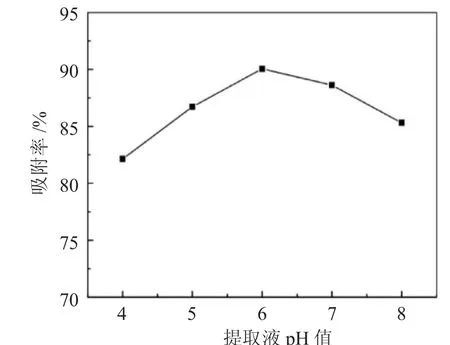
图2 提取液pH值对吸附率的影响Fig.2 Effect of loading solution pH on adsorption rate
随着提取液pH值的增大,树脂的吸附率先增高后降低,当pH值为6.0时达到最大,这可能由于在弱酸性环境下,杜仲多糖有利于保持分子形式,易于吸附,因此选择5.0、6.0、7.0作为正交试验中提取液pH值的考察水平。
2.2.3 上样流速影响 不同上样流速对树脂吸附率的影响,见图3。

图3 上样流速对吸附率的影响Fig.3 Effect of loading solution flow rate on adsorption rate
从图3可知,随着上样流速的增大,吸附率不断下降,考虑兼顾吸附效率,因此选择1.0、2.0、3.0mL·min-1作为正交试验中上样流速的考察水平。
2.2.4 洗脱液浓度影响 不同浓度的乙醇对杜仲多糖的洗脱效果,见图4。

图4 洗脱液浓度对洗脱率的影响Fig.4 Effect of eluent concentration on desorption rate
由图4可见,随着洗脱液浓度增大,洗脱率逐渐升高,至70%开始下降。这可能归因于乙醇浓度较低难以破坏多糖与树脂形成的氢键,而浓度过高则与多糖的作用力降低,因此,选择65%、70%、75%作为正交试验中乙醇溶液的浓度考察水平。
2.2.5 洗脱流速影响 不同洗脱流速对杜仲多糖的洗脱率影响,见图5。
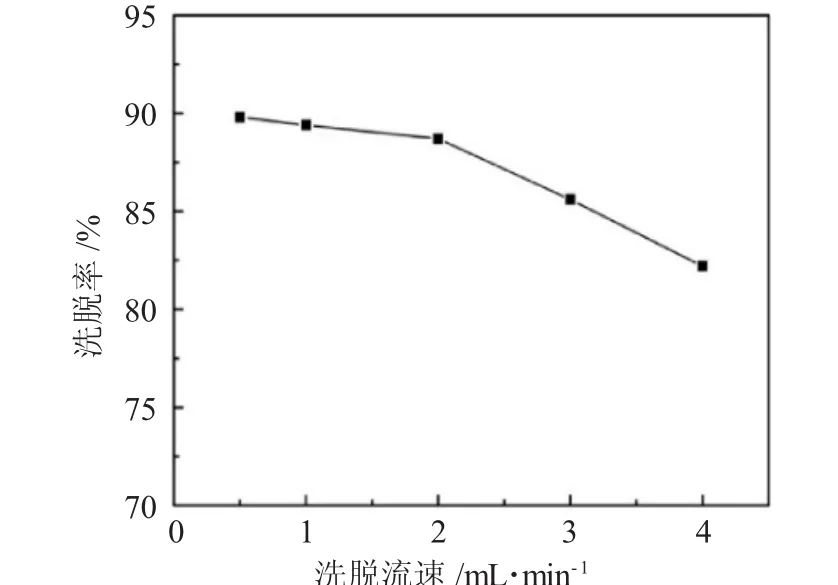
图5 洗脱流速对洗脱率的影响Fig.5 Effect of eluent flow rate on desorption rate
由图5可见,随着洗脱流速的增大,洗脱率不断降低,这归因于流速过快,不利于洗脱液和多糖充分接触,因此,选择 0.5、1.0、2.0mL·min-1作为正交试验中洗脱流速的考察水平。
2.2.6 洗脱液体积影响 不同洗脱液体积对杜仲多糖的洗脱率影响,见图6。
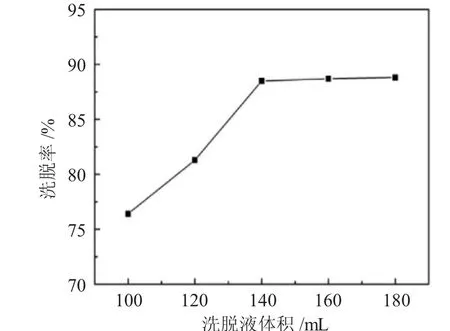
图6 洗脱液体积对洗脱率的影响Fig.6 Effect of eluent volume on desorption rate
从图6可见,当洗脱液用量增至140mL时,洗脱率逐渐趋于平衡,因此选择140、150、160mL作为正交试验中洗脱液体积的考察水平。
2.3 动态吸附工艺考察
在动态吸附单因素试验结果基础上,采取三因素三水平正交试验,以树脂的吸附率为衡量指标,确定吸附工艺最佳条件,具体因素考察水平见表2,试验结果见表3。
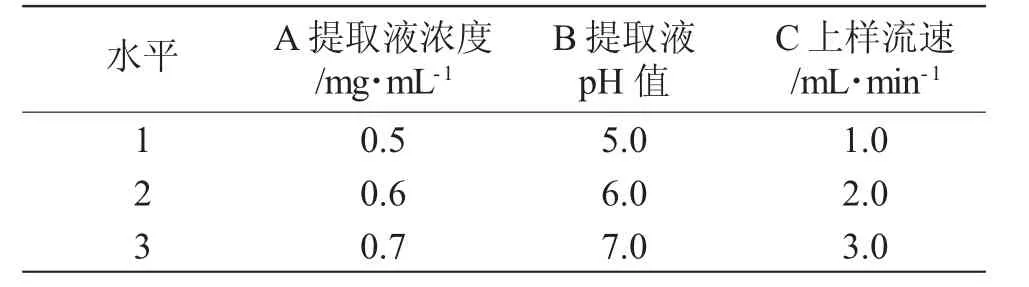
表2 吸附正交试验因素水平Tab.2 Factor level table of adsorption orthogonal test
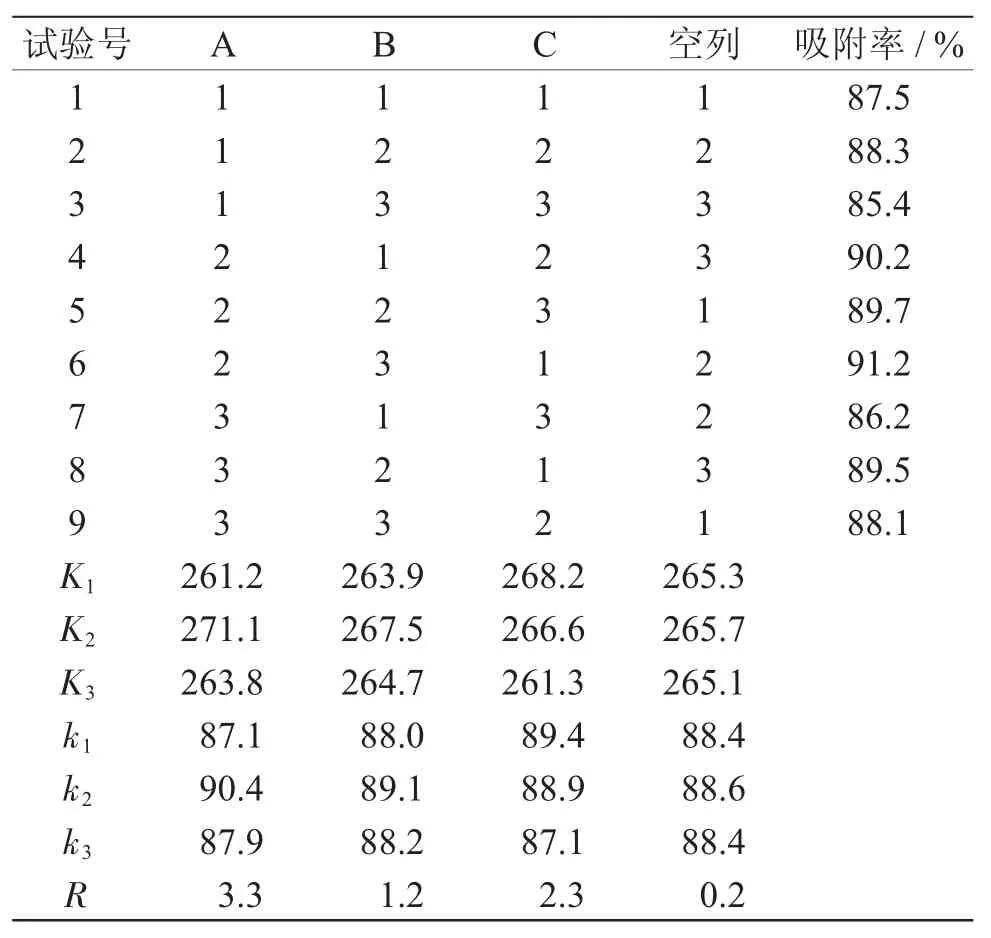
表3 吸附条件正交试验结果Tab.3 Results of adsorption orthogonal test
从表3极差分析结果可知,各因素影响大孔树脂吸附杜仲多糖的顺序依次为提取液浓度>上样流速>提取液pH值,最佳吸附工艺条件为A2B2C1,即0.6mg·mL-1,pH 值 为 6.0 杜 仲 多糖 提 取 液 ,以1.0mL·min-1流速上样至AB-8型大孔树脂中。
2.4 动态洗脱工艺考察
分别收集表3试验中9份洗脱液,根据表4洗脱试验的因素考察水平,进行正交试验,测定各自多糖含量,并计算洗脱率,结果见表5。
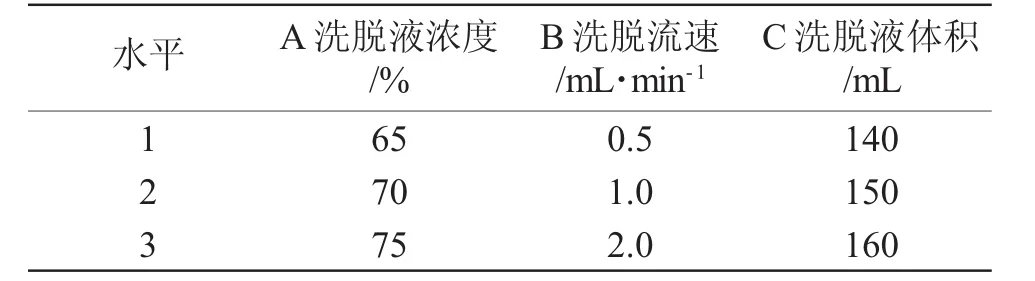
表4 洗脱正交试验因素水平Tab.4 Factor level table of desorption orthogonal test
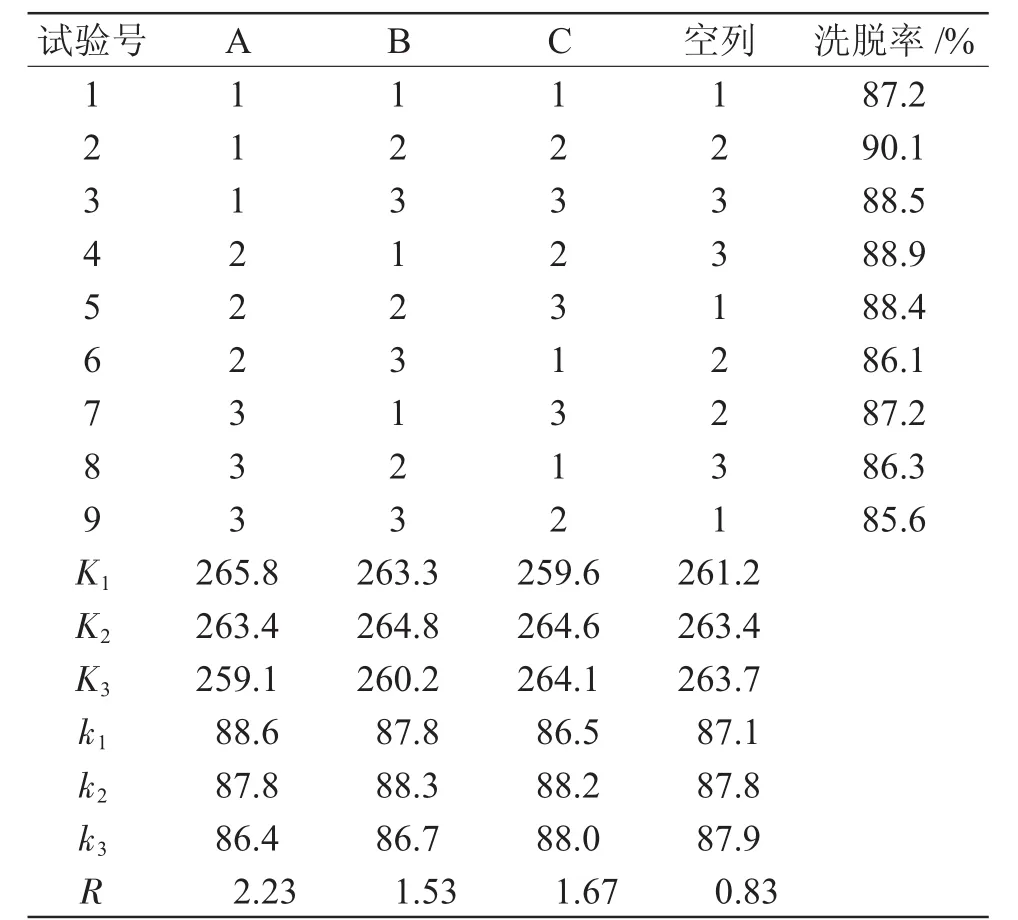
表5 洗脱条件正交试验结果Tab.5 Results of desorption orthogonal test
从表5极差分析结果可知,各因素对洗脱效果影响的顺序依次为洗脱液浓度>洗脱液体积>洗脱流速,最佳洗脱工艺条件为A1B2C2,即选择体积为150mL,65%乙醇溶液,以 1.0mL·min-1流速洗脱AB-8型大孔树脂吸附的杜仲多糖。
2.5 工艺验证与含量结果比较
0.6 mg·mL-1,pH值为6.0的杜仲多糖提取液,以1.0mL·min-1流速,上样至AB-8型大孔树脂吸附后,采用体积为150mL,65%乙醇溶液,于1.0mL·min-1流速洗脱,测得树脂吸附率与解吸率分别为91.6%和90.2%,而产物的多糖含量由纯化前10.2%提高至纯化后35.8%,约为纯化前的3.5倍。
2.6 负重游泳时间比较
由于负重游泳时间间接反映不同物质的抗疲劳作用效果,因此,对3组小鼠的负重游泳时间进行比较,结果见表6。

表6 不同组别小鼠的负重游泳时间Tab.6 Swimming times of different groups of mice
与对照组相较,其它各组小鼠的负重游泳时间均有所延长,而纯化组小鼠的游泳时间最长,差异具有极显著性(P<0.01),表明经纯化后的杜仲多糖有助于提高小鼠的运动时长。
2.7 乳酸生化指标影响
表7为不同物质对运动后小鼠的体内乳酸生化指标影响比较。

表7 不同物质对运动后体内乳酸生化指标影响Tab.7 Effect of different materialson biochemical indexes of lactic acid after exercise
与对照组相较,喂养混有多糖饲料的小鼠在剧烈运动后,体内乳酸浓度明显偏低,且乳酸脱氢酶活力显著提高,特别是纯化组小鼠的两类指标差异最为突出(P<0.01),表明杜仲多糖有助于改善小鼠体内的乳酸脱氢酶活力,加快体内乳酸代谢排出,从而抵抗运动疲劳状态。
3 结论
本研究通过大孔树脂分离纯化杜仲多糖提取物,利用单因素与正交试验优化最佳纯化工艺为:浓度为0.6mg·mL-1,pH值为6.0的杜仲多糖提取液,以1.0mL·min-1流速,上样至AB-8型大孔树脂吸附后,通过体积为150mL,65%乙醇溶液,以1.0mL·min-1流速洗脱,树脂对多糖的吸附率和解吸率分别为90.6%、90.2%,而产物的多糖含量由10.2%提高至35.8%,约为纯化前3.5倍。该纯化工艺操作简便、纯化效率较高,所得产物可明显改善运动疲劳状态,从而为杜仲多糖的后续保健开发提供参考。
