七种中药单体对大鼠肝细胞Oct1和Oatp1b2转运体的影响*
2020-04-29程睿杜娟吴伟江振洲张陆勇黄鑫
程睿,杜娟,吴伟,江振洲,张陆勇,黄鑫
(1.中国药科大学江苏省新药筛选重点实验室,南京 210009;2.中国药科大学药物质量与安全预警教育部重点实验室,南京 210009;3.中国药科大学江苏省药效研究与评价服务中心,南京 210009;4.广东药科大学药学院新药筛选与药效学评价中心,广州 510006)
研究发现中药在体内除了能改变药物代谢酶的表达和功能外,还能对转运体起到调节作用,从而影响其他药物的体内处置过程[1-2]。肝脏转运体是肝清除及维持内环境稳态的一个重要因素,已有大量文献报道肝脏转运体与药物肝毒性关系密切,因此近年来转运体在中药肝毒性的研究中也逐渐受到重视[3-6]。原代肝细胞是研究转运体摄取实验的主要体外模型,可以用来预测内、外源性物质在肝脏上的转运情况。本文通过建立“三明治”培养的大鼠原代肝细胞模型,测定大鼠原代肝细胞上Oct1和Oatp1b2的基因表达以及应用转运体的已知探针底物雷尼替丁和瑞舒伐他汀评价转运体的功能,在此模型上分别以维拉帕米及利福平作为Oct1和Oatp1b2的抑制剂研究雷公藤红素、雷公藤内酯酮、雷公藤内酯甲、甘草次酸、柴胡皂苷D、大黄素、大黄酸7种肝毒性中药单体对Oct1和Oatp1b2的作用,探讨该7种中药单体引起肝损伤的可能机制,为有毒中药的肝毒性研究提供思路。
1 材料与方法
1.1动物 实验动物:Wistar雄性大鼠,体质量200~220 g,SPF级,购自北京维通利华实验动物技术有限公司,实验动物许可证号码:SCXK(京)2016-0011。饲养温度为18~23 ℃,湿度为60%~80%,12 h/12 h光照明暗周期。
1.2药物与试剂 盐酸雷尼替丁对照品(含量:99.9%,批号:100163-201607)、瑞舒伐他汀钙对照品(含量:97.6%,批号:101028-201202)、内标醋酸可的松对照品(含量:97.6%,批号:101028-201202)、雷公藤内酯甲对照品(含量:99%,批号:111597-200402)、维拉帕米(含量:98%,批号:100223-200102)、利福平(含量:98.8%,批号:130496-201403)购自中国药品生物制品检定所;雷公藤红素对照品购自广州牌生物科技(含量:98%);雷公藤内酯酮对照品购自南京康满林化工实业有限公司(含量:98%,批号:20130726);大黄素对照品购自中国食品药品检定研究院(含量:98%,批号:110756-200110);柴胡皂苷D对照品购自成都思科华生物技术有限公司(含量:98%);胶原(collagen from calf skin,货号:C3867)、胶原酶(胶原酶Ⅰ,货号:C0130)、地塞米松(货号:D1756)购自Sigma公司;乙酸(色谱纯,批号:911273)购自TEDIA COMPANYINC,甲酸(色谱纯,货号:6F2941)购自ROE SCIENTIFIC INC,甲醇、乙腈(色谱纯)购自Merck Company。
1.3仪器与设备 Shimadzu LC-20AD泵,SIL-20AC自动进样器,CTO-20AC柱温箱,CBM-20A连接器(岛津公司);AB SciexTM 5500质谱检测器(AB SCIEX公司);Thermo TSQ Quantum Ultra液相色谱质谱联用仪(Thermo公司);THERMO LEGEND MICRO21R 高速冷冻离心机(Thermo Scientific 公司);SPD2010真空旋转干浓缩仪、Forma -80 ℃超低温冰箱(Thermo Electron公司);AE240万分之一电子分析天平(Mettler Toledo公司);自动纯水机(Thermo Electron公司);-20 ℃冰箱(青岛海尔公司);V20 Volumetric KF Titrator水分测定仪(METTLER TOLEDO 公司);XW-80A涡旋混合器(上海医科大学仪器厂);MX-S混匀仪(北京大龙兴创实验仪器有限公司)。
1.4原代肝细胞的提取与培养 大鼠分笼饲养,每笼3只,自由饮水与进食。动物适应性饲养1周后开始实验。实验前禁食12 h,自由饮水。大鼠腹腔注射20%乌拉坦麻醉,常规消毒后开腹,分离大鼠下腔静脉和门静脉。门静脉插管,起初以88 r·min-1的流速灌流乙二胺四乙酸(EGTA)缓冲液,几秒后肝变为土黄色,灌流泵流速改为144 r·min-1。2.5 min后,改灌流0.035%胶原酶溶液,泵流速为88 r·min-1,灌流8~11 min,此时肝变为粉红透明的状态,肝表面沁出一层水分,待肝脏局部出现塌陷,按压后不易恢复结束灌流。灌流结束后剪碎肝脏,收集在0.019%胶原酶溶液中,置于37 ℃摇床摇匀,100目滤网过滤,细胞悬液低速离心(4 ℃,50 g,5 min)后用预冷的William E培养基重悬细胞,相同条件下重复离心两次清洗细胞。最后一次用William E培养基重悬细胞后,台盼兰染色法测定细胞活率,活率达到 85% 以上即可用于实验。将细胞点入胶原包被的6孔板中,每天换液。
1.5逆转录定量PCR(qRT-PCR)测定各摄取转运体的mRNA水平 将提取的大鼠原代肝细胞培养4 h使其贴壁后再将其分别贴壁培养4,8,16,24 h,弃去培养基,加入1 mL Trizol 裂解细胞,提取细胞总RNA,PCR测定Oct1和Oatp1b2转运体各时间点的mRNA表达水平,各转运体的引物设计如表1,扩增程序为:95 ℃ 5 min,(95 ℃ 10 s,60 ℃ 30 s)×40 个循环。扩增后在60~95 ℃分析溶解曲线并用2-ΔΔCt法计算基因表达差异。

表1 目的基因引物序列
1.6原代肝细胞转运体摄取模型验证
1.6.1不同孵育时间和探针底物浓度下原代肝细胞对探针底物的摄取能力 用二甲基亚砜分别配制底物雷尼替丁和瑞舒伐他汀的母液,浓度为100 mmol·L-1,William E 培养基稀释雷尼替丁和瑞舒伐他汀母液,充分混匀,使雷尼替丁的终浓度分别为2,5,10,20,50 μmol·L-1,瑞舒伐他汀的终浓度分别为2,5,10,20 μmol·L-1。弃去细胞培养6孔板中的旧培养基,加入相应浓度的底物,置于37 ℃培养箱中孵育,孵育完成吸去6孔板中的培养基,按1.9方法进行操作。
用William E 培养基稀释雷尼替丁和瑞舒伐他汀母液,充分混匀,使其终浓度分别为由探针底物浓度依赖性实验筛选出的最佳条件。弃去细胞培养6孔板中旧培养基,往其中加入相应浓度的底物,置于37 ℃培养箱中孵育,分别在给予底物2,5,10,15,30,45,60 min后定点收取细胞样品,按1.9方法进行操作。
1.6.2抑制剂对探针底物在原代肝细胞上摄取的影响 由探针底物浓度依赖性和时间依赖性实验结果选择不同探针底物相应的给药浓度和时间。分别给予Oct1的抑制剂维拉帕米100 μmol·L-1;Oatp1b2的抑制剂利福平50,100 μmol·L-1。预孵育后给予各转运体相应的探针底物进行孵育,孵育完成后收取细胞样品,按1.9方法进行操作。
1.7原代细胞给药与培养 将肝细胞悬液加入6孔板中,每个孔加入2 mL William E 培养基,使细胞密度约为5.0×106cell·mL-1,6孔板放置于37 ℃培养箱中培养。给药前弃去6孔板中的旧培养基,加入含有受试药物的培养基,同时设置阳性对照[分别含维拉帕米(雷尼替丁)、利福平(瑞舒伐他汀)]和空白对照(仅加入探针底物)。雷公藤红素组、雷公藤内酯酮组和雷公藤内酯甲组共孵育15 min,大黄素组、大黄酸组、甘草次酸组和柴胡皂苷D组共孵育30 min后,弃去6孔板中的培养基,加入已用William E 培养基稀释为相应浓度的雷尼替丁和瑞舒伐他汀,放置于37 ℃培养箱中培养。加入雷尼替丁组的细胞共孵育10 min,加入瑞舒伐他汀的孵育15 min。孵育完成吸去板中的培养基,收集细胞样品并进行检测。
1.8原代肝细胞蛋白含量测定 在100 μL细胞裂解液中加入100 μL RIPA裂解液,涡旋混匀,冰上放置15 min充分裂解细胞后,4 ℃,12 000×g离心15 min,取上清。96孔板中分别加入20 μL浓度为0.5,0.25,0.125,0.062 5,0.031 25,0.015 625和0 mg·mL-1的蛋白标准品和20 μL用0.9%氯化钠溶液或磷酸盐缓冲液(PBS)稀释10倍的蛋白样品后每个孔中继续加入二喹啉甲酸混合工作液共200 μL(A液:B液=50:1),60 ℃条件下反应15 min,于562 nm处检测吸光度,根据标准曲线计算出样品的蛋白浓度。
1.9液相色谱-质谱/质谱联用法测定肝细胞摄取量
1.9.1细胞样品收集与前处理 预冷的PBS清洗细胞3次后,每孔加入200 μL预冷的三蒸水,冰上放置15 min。用细胞刮刀收集细胞并将收集的细胞放置于超声仪中30 min使其裂解。然后把分离的细胞置于-80 ℃冰箱反复冻融3次,彻底裂解细胞,涡旋混匀细胞裂解液。取细胞裂解液100 μL,加入70%乙腈(三蒸水:乙腈=3:7)配制的含IS(醋酸可的松,50 ng·mL-1)的沉淀剂 1 mL,涡旋3~5 min,4 ℃,13 300 r·min-1离心10 min,吸取上清液0.8 mL再次在4 ℃,13 300 r·min-1条件下离心10 min,取部分上清液进样。
1.9.2色谱和质谱条件 雷尼替丁色谱条件:色谱柱:Agilent ZORBAX SB-C18(3.0 mm×150 mm,3.5 μm);柱温:40 ℃;进样室温度:4 ℃,进样体积:2 μL;流动相:A:水相:5 mmol·L-1醋酸铵(含0.05%甲酸);B:有机相:甲醇(含5 mmol·L-1醋酸铵和0.05%甲酸),洗脱梯度:0 min,A:B 90/10(V/V);0.8 min,A:B 45/55(V/V);1.6 min,A:B 10/90(V/V);4.5 min,A:B 90/10(V/V);4.5~7 min,A:B 90/10(V/V);流速:0.45 mL·min-1。质谱条件:电喷雾离子源(electroprag ion source,ESI);正离子扫描;多反应监测(multiple reaction monitoning,MRM);检测离子:雷尼替丁:m/z315~176.2,醋酸可的松:m/z403.3~163.1。
瑞舒伐他汀色谱条件:色谱柱:Agilent ZORBAX SB-C18(3.0 mm×150 mm,3.5 μm);柱温:40 ℃;进样室温度:4 ℃;进样体积:5 μL;流动相组成:A:水相:0.03%乙酸;B:有机相:甲醇,洗脱梯度:0 min,A:B 85/15(V/V);1 min,A:B 10/90(V/V);4.5 min,A:B 10/90(V/V);5.5~8.5 min,A:B 85/15(V/V);流速:0.35 mL·min-1。质谱条件:电喷雾离子源(ESI);正离子扫描;检测方式:选择反应监测(SRM);检测离子:瑞舒伐他汀:m/z482.2~258.1,醋酸可的松:m/z403.3~163.1。

2 结果
2.1大鼠原代肝细胞模型Oct1和Oatp1b2的mRNA表达 应用qRT-PCR检测各摄取转运体在大鼠原代培养肝细胞上的表达水平,图1显示随培养时间的延长,大鼠原代肝细胞上Oct1和Oatp1b2的mRNA表达水平逐渐下调。4 h时,各转运体的mRNA表达水平最高,8 h与4 h相比有明显差异,且8 h后转运体的mRNA表达水平极显著性下调。综合结果可知,原代肝细胞上该两种转运体的mRNA表达水平随着培养时间延长逐渐下调,提示给药时间应定于贴壁完成后的4 h前后,实验应在4 h内完成。

①与4 h组比较,P<0.01。
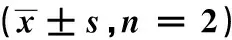
①Compared with 4 h group,P<0.01.

2.2大鼠原代肝细胞转运体摄取模型验证
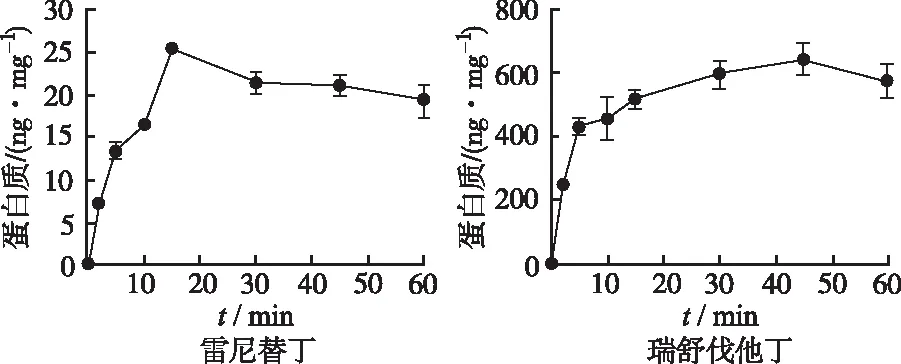
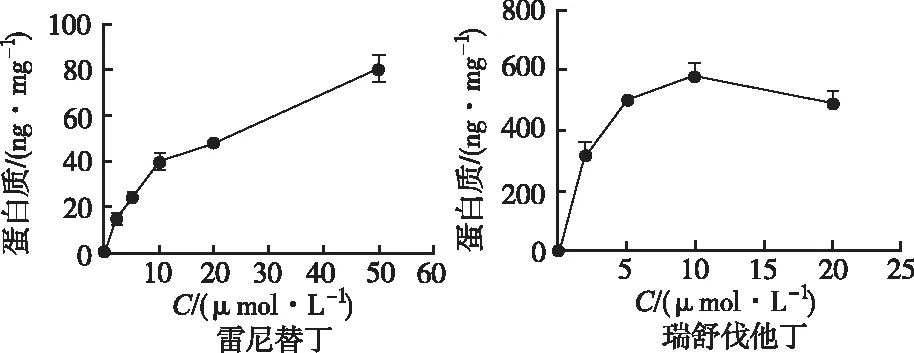
2.2.1不同孵育时间和探针底物浓度对大鼠原代肝细胞摄取功能的影响 转运体介导的肝细胞摄取是呈现底物浓度和时间依赖性的。因此,在不同浓度和孵育时间下筛查最适当的底物浓度和孵育时间是验证转运体摄取模型的重要一步。由两个探针底物在不同孵育时间(图2)和不同探针底物浓度下的肝摄取曲线(图3)可见:雷尼替丁和瑞舒伐他汀的摄取在15 min和20 min时趋于饱和,分别选取饱和的前一个时间点作为探针底物的给药时间,即10和15 min。当雷尼替丁浓度在10 μmol·L-1以下时,Oct1对其摄取较快,之后摄取变慢,所以实验选择雷尼替丁的给药浓度是5 μmol·L-1;瑞舒伐他汀(Oatp1b2探针底物)的摄取浓度转折点为10 μmol·L-1,以此作为其给药浓度。
2.2.2抑制剂对探针底物在原代肝细胞上摄取的影响 加入探针底物的抑制剂观察底物摄取量的变化是验证原代肝细胞摄取模型是否成功的关键一步。因此分别选择Oct1和Oatp1b2的抑制剂维拉帕米和利福平进行模型验证。由图4可见,给予维拉帕米100 μmol·L-1时,Oct1对雷尼替丁的摄取显著下调;给予利福平50,100 μmol·L-1时,Oatp1b2对瑞舒伐他汀的摄取下调且一定程度上呈现浓度依赖性。
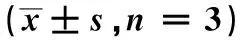

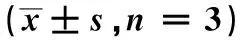

2.3中药单体对Oct1探针底物雷尼替丁摄取的影响 阳性对照组维拉帕米在给药浓度为100 μmol·L-1时,Oct1对雷尼替丁的摄取显著下调。与空白对照组比较,雷公藤红素、甘草次酸和柴胡皂苷D 3组中雷尼替丁的摄取水平显著下调;雷公藤内酯酮的低浓度(50 μmol·L-1)组中Oct1对雷尼替丁的摄取上调;而雷公藤内酯甲、大黄素、大黄酸和高浓度雷公藤内酯酮组(100 μmol·L-1)中雷尼替丁的摄取没有明显变化,见图5。
2.4中药单体对Oatp1b2介导的瑞舒伐他汀摄取的影响 阳性对照利福平在100 μmol·L-1时,Oatp1b2对瑞舒伐他汀的摄取显著下调。与空白对照组比较,雷公藤红素、高浓度大黄酸(10 μmol·L-1)、甘草次酸和柴胡皂苷D各组瑞舒伐他汀的摄取水平显著下调;雷公藤内酯酮、雷公藤内酯甲、大黄素和低浓度大黄酸对Oatp1b2介导的瑞舒伐他汀的摄取无显著影响,见图6。

①与对照组比较,P<0.01。

①Compared with control group,P<0.01.

3 讨论
近年来中药致肝损伤的事件不断增加,已成为制约中药发展的重要因素[7]。转运体是一种功能性跨膜蛋白,在药物的吸收、分布、消除及内环境稳态的维护中起着重要的作用[8-9]。肝脏上的转运体包括SLC家族和ABC家族[9],其中SLC类转运体成员主要有:有机阳离子转运体(organic cation transporter,OCTs)、有机阴离子转运体(organic anion transporter,OATs)和有机阴离子转运多肽(organic anion transporting polypeptide,OATPs)等。OCTs和OATPs都是位于血管侧膜的摄取型转运体,负责将外源性和内源性物质转入肝脏中,如胆汁酸结合物、多巴胺等[10]。本实验选择的Oct1和Oatp1b2是大鼠肝脏上Octs和Oatps的主要成员,参与介导多种物质在大鼠肝脏中的转运和消除[11]。
①与对照组比较,P<0.01。

①与对照组比较,P<0.01;②与对照组比较,P<0.05。
“三明治”培养的大鼠原代肝细胞模型是一种可以模拟体内肝细胞环境并能用于评价肝细胞摄取和外排功能的体外模型[12-13]。本文利用Selgen两步胶原酶灌注法建立了大鼠肝原代模型,应用qRT-PCR技术和各转运体的已知探针底物,从基因表达和摄取功能两方面对建立的原代肝细胞模型上两种转运体的表达和功能进行了表征。结果表明,所考察的转运体在肝细胞上的表达受时间和底物浓度等因素的影响,由此提示,在利用大鼠肝原代细胞模型评价转运体对药物的处置时需要注意细胞培养时间和底物浓度等因素。另外,笔者也同时考察了24 h~4 d时间段中各转运体的基因表达情况,发现Oct1和Oatp1b2的mRNA在分离培养后的24 h~4 d中保持在一个极低值,这与文献报道基本相符。本实验利用建立的大鼠肝原代细胞模型,从Oct1和Oatp1b2两种转运体的功能活性方面初步探讨了7种肝毒性中药单体的毒性机制。结果表明,雷公藤红素、甘草次酸、柴胡皂苷D组、大黄酸组和雷公藤内酯酮组中的一种或两种底物的摄取量与对照组相比存在显著差异。因此,推测该几种单体的肝毒性可能与Oct1和Oatp1b2有关。
综上所述,本实验结果表明,考察的7种肝毒性中药单体能对Oct1和Oatp1b2中的一种或两种产生影响,多数为对其摄取能力的抑制作用。可推测这7种肝毒性中药单体的肝脏损伤机制可能是通过下调或上调肝脏Oct1和Oatp1b2的摄取功能来实现的。这些结果可能为这7种中药单体的肝毒性和肝处置研究奠定了初步基础,并进一步为肝毒性中药的体内研究提供思路。
