藤黄酸作用后小鼠血清代谢组学研究*
2020-04-29吴晓霞于心悦胡诗浩黄寅赵凯
吴晓霞,于心悦,胡诗浩,黄寅,赵凯
(1.海口市人民医院药学部,海口 570208;2.中国药科大学药学院,南京 210009;3.中国药科大学基础医学与临床药学学院,南京 210009)
藤黄是藤黄科植物藤黄(GarciniahamburyiHook.f.)树干的裂口处分泌的干燥树脂,具有破血散结、解毒、止血、杀虫之功效,用于治疗癌症、脑水肿等多种病症[1]。藤黄酸(gambogic acid,GA)是中药藤黄的主要成分之一,占比约30%[2];现代药理学研究发现其具有抗肿瘤作用,对肝癌、肺癌、胃癌、胰腺癌等肿瘤细胞株均有明显的抑制作用[1,3]。其抗癌作用与一般的化疗抗癌药有所区别,能选择性地杀死癌细胞,而对正常的造血系统没有影响,是一种很有前景的化疗药物[4]。但目前对于藤黄酸的研究大多集中在化合物本身,例如含量测定[2,5]、药动学行为[6]、结构修饰[7]、新剂型开发[8]及作用后细胞表型观测[9]等,即使是分子机制的研究也大多关注一些经典的信号通路[9-10]。根据已有文献[11-13],藤黄酸在体内分布广泛,以肝、肾、肠最多,主要通过胆汁排泄,其在Hep3B、SH-SY5Y等多种肿瘤细胞中能激活半胱天冬酶依赖的线粒体凋亡,导致线粒体能量代谢途径改变,扰乱肿瘤细胞代谢,引起其凋亡。这提示藤黄酸对代谢稳态的影响可能是其发挥药效作用的机制之一,然而,目前对藤黄酸作用后机体效应分子的应答情况尚缺乏全面深入的研究。
代谢组学是研究生物体受药物、疾病、环境等因素扰动后其内源性代谢物种类、数量及其变化规律的新兴学科[14]。代谢物处于生命信息传递的终端,故可体现生物体整体状态或功能变化的最终结果。代谢组学在肿瘤、心血管疾病、神经系统疾病等疾病的机制研究和药物靶点发现发挥了重要作用[15-17]。本研究旨在整合运用液相色谱-质谱(LC/MS)和气相色谱-质谱(GC/MS)联用技术,全面表征藤黄酸作用后小鼠血清代谢指纹谱,筛选鉴定差异代谢物并探讨其可能影响的代谢通路,为深入揭示藤黄酸的作用机制提供一定参考。
1 材料
1.1药品与试剂 藤黄酸(中国药科大学药学院药物化学系提供,批号:20180321,纯度 > 97%);甲醇、乙腈(HPLC级,德国Merck公司,批号:I0935307804和JA063230);甲酸(HPLC级,美国ROE Scientific公司,批号:F8124-0500);氯化钠注射液(安徽双鹤药业有限责任公司,批号:H34023609);甲氧胺(MOX,批号:LC09000V,纯度 > 99.9%)、N-甲基-N-(三甲基硅基)三氟乙酰胺(MSTFA,批号:BCBW0186,纯度>98.5%)、吡啶(批号:180205300D,纯度>99.9%)以及十七酸(批号:SLBB1186V,纯度 > 99.9%)均购自美国Sigma-Aldrich公司。格列本脲(批号:121633-201012,纯度 > 99.0%)购买于中国食品药品检定研究院。
1.2仪器 快速液相色谱-离子阱飞行时间质谱仪(LC-IT-TOF-MS)、GCMS-QP2010 Ultra气相色谱质谱联用仪(日本岛津公司);5430R冷冻离心机(德国Eppendorf公司);TMS-200超级恒温混匀仪(杭州);低温恒温搅拌反应浴(郑州);CentriVap型离心浓缩仪(美国LABCONCO公司);MilliQ超纯水制备系统(美国Milipore公司)。
2 方法
2.1动物实验 SPF级雌性C57BL/6小鼠11只,体质量18~22 g,购自常州卡文斯实验动物有限公司[实验动物许可证号生产许可证:SCXK(苏)2016-0010]。动物房内温度(23±2) ℃,相对湿度50%~55%,动物自然昼夜节律光照。
小鼠适应性饲养1周后,随机(Excel软件中的RAND函数)分为对照组(5只)和GA组(6只)。GA组尾静脉注射藤黄酸(溶液浓度2.0 mg·mL-1;注射体积根据小鼠体质量调整,约0.1 mL;剂量10 mg·kg-1),对照组注射等量空白溶液。于1 h后眼球取血,室温静置40 min,离心(4 ℃,6 000 r·min-1,10 min)分离血清。
2.2质控样本 为保证分析方法的可靠性,从每只动物血清样本中取出等量,充分混合后分装,制得质控(quality control,QC)样品。于分析批中每4个真实样品插入一个QC样品,同法进行前处理和仪器分析。
2.3LC/MS分析 精密吸取血清20 μL,精密加入甲醇/乙腈(1:1,含内标格列本脲5 μg·mL-1)溶液200 μL,涡旋5 min,两次高速离心(4 ℃,16 000 r·min-1,10 min)后,取上清进样分析。LC/MS分析条件如下:色谱柱采用XSelect HSS T3 XP(2.1×100 mm,2.5 μm,美国Waters公司);以甲醇(A)和0.01%甲酸的水溶液(B)为流动相进行梯度洗脱:0.00~4.00 min,5~50%A;4.00~10.00 min,50~85%A;10.00~15.00 min,85~100%A;15.00~20.00 min,100%A;20.00~20.01 min,100~5%A;20.01~30.00 min,5%A。柱温:40 ℃;进样量:5 μL。质谱采用电喷雾离子化源(ESI)正负离子切换模式,质量扫面范围m/z100-1000。
2.4GC/MS分析 精密吸取血清10 μL,加入甲醇(含内标十七酸10 μg·mL-1)100 μL,涡旋5 min,两次离心取上清后,经MOX和MSTFA两步衍生化,产物转移至进样小瓶,供GC/MS分析。GC/MS仪器参数如下:进样口温度250 ℃,高纯氦气为载气,流速为57 cm·s-1;进样量体积为1 μL,分流比为20:1;Rtx-5MS石英毛细管柱(30 m×0.25 mm,0.25 μm,美国Restek公司)进行色谱分离,升温程序如下:70 ℃保持2 min,以10 ℃·min-1的速度升至320 ℃,保持2 min。质谱采用电子轰击离子源(EI),电压70 eV,质量扫描范围m/z45-600。
2.5数据处理与统计分析 采用Profiling Solution软件(日本Shimadzu公司)对UFLC-IT-TOF/MS和GC/MS采集的原始数据进行峰提取和峰匹配,所得的数据矩阵导入Mathematica软件(Ver 11.3,Wolfram,USA),利用实验室编写的软件包进行预处理(扣减空白、缺失值填补、面积归一化)和统计分析。以变量投影重要性(VIP)>1、调整P值(adjustedP)<0.05以及绝对变化倍数(FC)>1.3为条件筛选差异变量。通过与标准品或数据库比对,鉴别差异代谢物。
3 结果
3.1数据可靠性 采用Profiling Solution软件从LC/MS和GC/MS原始图谱中分别提出3297和3242个离子。QC样本总离子流图如图1所示,所有谱图重叠度较高;超过90%的离子的峰面积RSD<30%。此结果表明本研究采用的LC/MS和GC/M分析方法稳定、可靠,所得数据可用于进一步的分析。
3.2差异离子筛选 提取出的数据经预处理后,首先利用偏最小二乘法判别分析(PLS-DA)对样品进行模式识别,其得分图如图2所示,可以看出,在LC/MS和GC/MS上,对照组与GA组组内聚集良好、组间区分明显。进而采用Stuendent’s T Test或Mann-Whitney U Test比较各个离子组间差异的显著性,并计算变化倍数。最后,以VIP > 1、调整P<0.05以及|FC|>1.3为阈值筛分别选出差异变量75和55个。
3.3差异代谢物鉴定与通路分析 基于PLS-DA和非参数检验的结果,LC/MS和GC/MS分别筛选得到差异变量75和55个。对于LC/MS中的差异变量,根据保留时间、加和离子等相关信息,结合已有标准品和HMDB等数据库进行对比归属,初步鉴定出差异代谢物12个(表1);对于GC/MS中的差异变量,通过与标准品和NIST数据库对比,初步鉴定出差异代谢物9个(表2)。在这21个差异代谢物中,亮氨酸、缬氨酸、苏氨酸等7个物质含量显著增加,琥珀酸、LysoPE、PC、色氨酸等14个物质含量显著降低。将筛选得到的21个代谢物进行整合分析,参考KEGG、HMDB等数据库,构建了藤黄酸影响小鼠的代谢通路,主要涉及氨基酸代谢、磷脂代谢等通路(图3)。
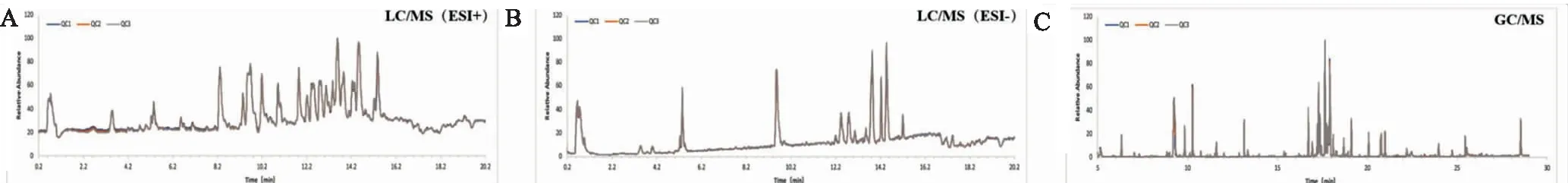
图1 QC样本的总离子流图

图2 LC/MS(A)和GC/MS(B)中对照组和GA组的PLS-DA得分图

表1 基于LC/MS鉴定出的差异代谢物
①由商业标准确定。
①Confirmed by the commercial standards.

表2 基于GC/MS鉴定出的差异代谢物
①由商业标准确定。
①Confirmed by the commercial standards.
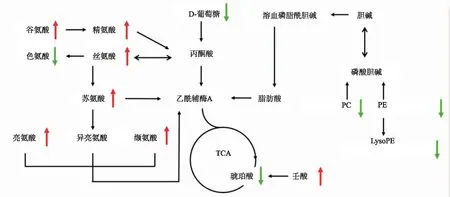
PC:磷脂酰胆碱;PE:磷脂酰乙醇胺;LysoPE:溶血磷脂酰乙醇胺;TCA:三羧酸循环;红色和绿色箭头分别代表GA组与对照组相比差异代谢物含量的升高和降低。
图3 藤黄酸作用后小鼠血清中受影响的代谢通路
PC:phosphatidylcholine;PE:phosphatidylethanilamine;LysoPE:lysophosphatidylethanilamine;TCA:Tricarboxylic acid cycle;Red and green arrows indicate increase and decrease in GA groupvscontrol group,respectively
Fig.3Metabolicpathwaysinmouseserumaftergambogicacidtreatment
4 讨论
本研究利用LC/MS和GC/MS平台对藤黄酸作用后小鼠血清样本进行了分析,筛选和鉴定出21个差异代谢物,主要包括氨基酸类、磷脂类等物质。其中,氨基酸在细胞生长中发挥着核心作用,氨基酸作为重要信号分子参与机体多种生理病理学的调控[18]。有代谢组学研究报道[19-20],肿瘤的发生、发展过程中伴随着氨基酸含量的显著变化。如,刘长庭等[21]发现肺癌患者血浆中苏氨酸、丝氨酸、谷氨酸、亮氨酸、精氨酸等氨基酸含量与正常人相比均显著降低,缬氨酸较正常人也有所下降。肿瘤细胞快速增长需要从血浆中摄取大量氨基酸作为底物合成蛋白质和氨基酸,同时肿瘤组织吸收氨基酸使整个机体蛋白质处于分解状态,大量的机体蛋白质分解为氨基酸进入血浆得以补充血浆的不足,从而使血浆总氨基酸维持正常,肿瘤患者大多处于高代谢状态,长期易造成营养不良[22-23]。利用肿瘤细胞和正常细胞代谢的差异,具有针对性的调节某些特定氨基酸的含量,可能对肿瘤的治疗有所帮助[24]。本研究筛选出7种含量显著变化的氨基酸,其中谷氨酸、精氨酸、丝氨酸、苏氨酸、亮氨酸和缬氨酸共6种氨基酸含量升高,色氨酸含量降低。这一结果提示,藤黄酸很可能对某些肿瘤的治疗有所帮助。
除氨基酸代谢外,本研究还发现了磷脂代谢途径中的8个节点物质含量显著改变,说明藤黄酸干扰了小鼠的磷脂代谢。磷脂是细胞膜的主要组成成分并参与细胞的生命活动,肿瘤细胞需要更多的膜成分来维持细胞的快速增殖[25]。有文献报道[26],藤黄酸可通过脂代谢紊乱诱导肿瘤细胞的自噬。在本研究中,注射藤黄酸后,小鼠血清中LysoPA(a-13:0/0:0)、PC(20:4/22:6)和PC(22:2/16:1)含量降低,表明干扰磷脂代谢可能是藤黄酸抗肿瘤作用的机制之一。
此外,鉴定出的其他差异代谢物也可能与藤黄酸的体内作用相关。如,葡萄糖、琥珀酸在能量代谢通路中占据重要地位,两者含量均有所下降,说明藤黄酸可能抑制了能量代谢[27-28];硬脂酸可经过一些列生化反应转化为合成前列腺素的前体物质,而前列腺素等生物活性物质可以促进肿瘤细胞的生长代谢[29],藤黄酸作用后硬脂酸含量下降可能会间接减少前列腺素的生成。
本实验利用基于色谱-质谱联用技术的代谢组学方法,研究了藤黄酸作用后小鼠血清代谢物的整体变化,发现氨基酸代谢、磷脂代谢、能量代谢等通路受到显著影响,提示藤黄酸很有可能通过干扰相关通路发挥药效作用,也说明藤黄酸的作用有单成分、多靶点的特点。下一步可采用荷瘤鼠模型、结合抑瘤率等药效学指标,深入研究疾病状态下藤黄酸的体内效应分子,为其作用机制阐释和安全应用提供科学数据。
